Аэртал или артрозилен что лучше
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство
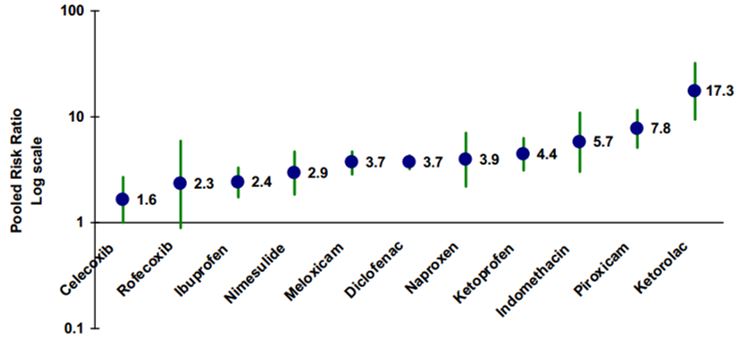
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
Нестероидные противовоспалительные препараты: список и цены
Нестероидные противовоспалительные препараты используются достаточно широко для подавления воспалительных процессов в организме. НПВП доступны в различных формах выпуска: таблетки, капсулы, мази. Они обладают тремя основными свойствами: жаропонижающими, противовоспалительными и болеутоляющими.
Лучший нестероидный противовоспалительный препарат может подобрать только врач, отталкиваясь от индивидуальных особенностей пациента. Самолечение в данном случае может быть чревато развитие серьезных побочных реакций или же передозировки. Предлагаем ознакомиться со списком препаратов. Рейтинг разработан на основании соотношения цена-качество, отзывов пациентов и мнения специалистов.
Как работают НПВП?
Нестероиды ингибируют агрегацию тромбоцитов. Терапевтические свойства объясняются блокадой фермента циклооксигеназы (ЦОГ-2), а также снижением синтеза простагландина. По мнению специалистов они оказывают влияние на симптомы заболевания, но не устраняют причину его возникновения. Поэтому не следует забывать о средствах, с помощью которых должны быть устранены первичные механизмы развития патологии.
Если у пациента обнаружена непереносимость НПВП, тогда они заменяются лекарствами других категорий. Часто в таких случаях применяют комбинацию противовоспалительного и болеутоляющего средства.
Как показывает практика, нецелесообразно заменять одно лекарство другим той же группы, если при приеме обнаруживается недостаточный терапевтический эффект. Удвоение дозы может привести только к клинически незначительному увеличению воздействия.
Классификация НПВП
Нестероидные противовоспалительные средства классифицируются в зависимости от того, являются ли они селективными для ЦОГ-2 или нет. Таким образом, с одной стороны, есть неселективные НПВП, а с другой – селективные ЦОГ-2.
Эффективность комбинации различных лекарственных форм кетопрофена лизиновой соли (Артрозилен) у пациентов с выраженной мышечно-скелетной болью в реальной клинической практике. Результаты исследования КУЛОН
Опубликовано в журнале «Клиническая фармакология и терапия», 2013.-N 4.-С.23-30
Каратеев А.Е., Журавлева М.В., Алексеев В.В., Денисов Л.Н., Цапина Т.Н.
Острая боль, возникающая на фоне патологии опорно-двигательного аппарата – одна из наиболее частых причин потери трудоспособности и обращения за медицинской помощью. Поэтому эффективное обезболивание традиционно считается одной из первоочередных задач, стоящих перед лечащим врачом. Значение анальгетической терапии определяется не только очевидной необходимостью наиболее полно и быстро устранить симптом, вызывающий основные страдания больного. В последние годы врачи пришли к четкому пониманию того факта, что купирование острой боли играет ключевую роль в предупреждении развития хронической боли. Это принципиально важно, ведь хроническая мышечно-скелетная боль рассматривается сегодня как самостоятельный клинический синдром, который не только выступает в числе главных причин инвалидизации, но и является фактором, существенно влияющим на продолжительность жизни пациентов 3.
Одним из главных инструментов контроля мышечно-скелетной боли являются нестероидные противовоспалительные препараты (НПВП). Эти лекарства сочетают в себе обезболивающий, противовоспалительный и жаропонижающий потенциал, что обеспечивает их преимущество в сравнении с другими анальгетиками – парацетамолом и опиоидами, в частности, трамадолом [4,5].
Хотя НПВП достаточно эффективны, тем не менее, существенное улучшение при их использовании отмечается далеко не у всех пациентов. Нюансы фармакокинетики конкретных препаратов, индивидуальные особенности клинической ситуации и пациента (включая такие «тонкие материи» как генетические особенности метаболизма ксенобиотиков и психологический настой в момент назначения терапии) могут существенно повлиять на достижение терапевтического успеха. Поэтому перед практикующим врачом часто оказывается проблема выбора препарата для дебюта анальгетической терапии, а также подбора альтернативного средства в том случае, если после первого назначения не удалось достичь существенного улучшения состояния.
Одним из представителей группы НПВП, который отлично подходит в качестве средства «первой линии» для купирования острой боли, а также для замены оказавшегося малоэффективным препарата, может считаться кетопрофен. Этот препарат используется в мире с 1971 г. и завоевал доверие врачей как эффективный и удобный анальгетик, обладающий хорошей переносимостью. Он прошел серьезную проверку в ходе большого числа клинических испытаний при самых разных заболеваниях, сопровождающихся выраженной болью – начиная от анестезиологической практики и заканчивая системными ревматическими заболеваниями [6,7].
Особый интерес представляет «улучшенный» кетопрофен – кетопрофен лизиновая соль (КЛС), которая обладает высокой биодоступностью и устойчивой фармакодинамикой. Эффективная концентрация препарата к плазме крови достигается уже через 15-20 мин. после перорального приема и 10-15 минут – после в/м введения. Малый размер и липофильность молекулы КЛС определяет хорошую абсорбцию при накожном нанесении – поэтому он является весьма удачной субстанцией для производства локальных форм НПВП.
Для оценки терапевтических возможностей Артрозилена ® было проведено исследование КУЛОН.
Цель исследования: оценить результаты комбинированного и/или последовательного применения различных лекарственных форм КЛС у больных с выраженной мышечно-скелетной болью в реальной клинической практике.
План исследования: Участниками исследования были врачи различных специальностей, проводящие поликлинический прием и занимающиеся в своей повседневной практике лечением пациентов, испытывающих мышечно-скелетные боли: терапевты, неврологи, травматологи, ревматологи. Всего приняло участие 115 врачей из городов: Москвы, Санкт-Петербурга, Воронежа, Липецка, Саратова, Тольятти, Белгорода, Курска, Новосибирска, Красноярска, Волгограда, Ростова, Краснодара, Н.Новгород.
Им предлагалось в течение календарного месяца проводить ретроспективный анализ результатов 2-х недельного применения КЛС у больных, обратившихся с жалобами на выраженные боли (не менее 40 мм по 100 мм визуальной аналоговой шкале – ВАШ), связанные с острой или хронической патологией опорно-двигательного аппарата. Необходимость назначения КЛС, а также лекарственная форма препарата (или их комбинация) определялись лечащим врачом по собственному усмотрению, в зависимости от клинической ситуации. Все данные вносились в специально разработанные анонимные исследовательские карты, которые затем были собраны организаторами исследования для проведения соответствующего анализа.
Патология, ставшая причиной обращения к врачам, представлена в таблице 1. Как видно, подавляющее большинство пациентов страдали от боли в различных отдела спины («дорсопатия») – всего 1601 пациент (47.8%). Учитывая неоправданное разнообразие диагнозов, используемых в нашей стране для обозначения этой патологии (основным из которых оставался архаичный «остеохондроз»), в таблице приведена лишь основная локализация боли – соответственно, в шейном, грудном или поясничном отделе. Детальное же рассмотрение формулировок, используемых российскими врачами для обозначения «дорсопатий» представляет большой интерес и будет представлено нами в отдельной работе.
Таблица 1.
Заболевания и патологические состояния, ставшие причиной обращения к врачу в поликлинике
| Группы | Число больных | Основные заболевания | Число больных |
|---|---|---|---|
| Воспалительные ревматологические заболевания | 203 | Ревматоидный артрит | 125 |
| Подагра | 46 | ||
| Серонегативные спондилоартриты, включая АС и ПсА | 22 | ||
| Реактивный артрит | 10 | ||
| Остеоартроз | 1008 | Полиартроз | 348 |
| Коксартроз | 140 | ||
| Гонартроз | 401 | ||
| Плечевые суставы | 18 | ||
| Кисти | 24 | ||
| Локти | 8 | ||
| Стопы | 24 | ||
| Не уточнен | 45 | ||
| Дорсопатия | 1601 | Боль в шейном отделе позвоночника | 381 |
| Боль в грудном отделе позвоночника | 66 | ||
| Боль в поясничном отделе позвоночника | 1254 | ||
| Не уточнен | 214 | ||
| Острые травмы | Переломы костей, ушибы, растяжения связок и мышц | 101 | |
| Воспаление околосуставных мягких тканей ревматической природы | 156 | Плечелопаточный периартрит | 73 |
| Тендиниты | 22 | ||
| Бурсит локтя | 5 | ||
| Субакромиальный бурсит | 5 | ||
| Эпикондилит | 23 | ||
| «Периартрит» | 22 | ||
| Пяточная шпора | 3 | ||
| Трохантерит | 3 | ||
| Неуточненный моно- олигоартрит | 53 | ||
| Редкие диагнозы | 13 | Метастазы рака (1), ОРЛ (1),СКВ (1), узловатая эритема (3), трофические язвы (4), карбункул шеи (1), «хроническая головная боль» (1), фибромиалгия (1) | |
На втором месте по частоте обращения находится остеоартроз – 1008 пациентов (30.1%), причем наибольшее число из них составили лица, страдающие поражением крупных суставов нижних конечностей – гонартрозом и коксартрозом, а также поражением суставов нескольких групп («полиартроз»).
Третью по численности группу пациентов представляли лица, страдающие воспалительными ревматическими заболеваниями (n=203), преимущественно ревматоидным артритом и подагрой.
Меньшее число составили пациенты с острым воспалением околосуставных мягких тканей ревматической природы (тендиниты, тендовагиниты, бурситы и др.), n=156, острыми травмами (переломы, ушибы мягких тканей, повреждение связок и др.), n=101 и моно/ олигоартритом неясной этиологии (n=53).
Более трети пациентов (n=1380, 41.2%) на момент назначения артрозилена уже получали другие НПВП, в основном нимесулид (n=412, 35.3%), диклофенак (n=304, 22.0%) и мелоксикам (n=248, 17.9%). Однако это практически не влияло на выраженность боли и ухудшения самочувствия. Так, при первом визите, у больных, принимавших НПВП, оценка этих параметров составила 67.5 + 17.6 и 59.1 + 21.8 мм ВАШ соответственно, у не принимавших – 65.6 + 16.2 и 57.4 + 20.9 мм ВАШ соответственно.
Кроме НПВП, 555 (16,6%) больных на момент начала исследования принимали различные миорелаксанты: 274 (49.4%) толперизон, 208 (37.5%) тизанидин и 73 (13.8%) баклофен. Другие лекарства, применяемые включенными в исследования больными, представлены в таблице 2.
Таблица 2.
Сопутствующая терапия, получаемая больными
Все больные, включенные в исследование, получали КЛС в виде различных лекарственных форм и их комбинации (рисунок 1).
Рисунок 1. Различные лекарственные формы и их сочетания,
использованные в исследовании КУЛОН
В работе были использованы Артрозилен ® 320 мг (капсулы с контролируемым высвобождением КЛС), р-р для парентерального введения 80 мг/мл и 15% спрей КЛС. Как видно, большинство предпочитали назначать инъекционные препараты в сочетании с другими лекарственными формами или использовать последовательное назначение – в первые 3 дня в/м инъекции, а затем переходить на капсулы. Кроме этого, у небольшой части больных (в основном при острых травмах и остром воспалении мягких тканей ревматической природы) врачи посчитали возможным ограничиться лишь кратковременным курсом парентерального введения артрозилена.
Электронная база данных была создана с помощью программы Microsoft Office Excel 2007, статистический анализ проводился с помощью программы SPSS 10.0. Средние значения даны в формате M + m. Для оценки статистической значимости отличия количественных параметров был использован t-тест Стъюдента, качественные параметры сравнивались с помощью показателя χ 2 или точного теста Фишера.
Результаты:
Большинство больных после проведенного курса лечения отметило существенное улучшение состояния. Так, средняя оценка боли в конце исследования составили 15.3 + 13.6 мм, а нарушения самочувствия 12.2 + 12.4, т.е. их значение уменьшилось на 76.9% и 79.0% по сравнению с исходным уровнем (р 40 мм). Как видно, почти у половины больных было достигнуто практически полное купирование боли. Лишь у 27.7% больных после использования артрозилена сохранялись выраженные болевые ощущения.
Рисунок 2. Выраженность боли в конце периода наблюдения
Эффективность КЛС подтверждается субъективной оценкой удовлетворенности проведенным лечением (рис.3). Подавляющее большинство больных (суммарно 87%) оценили результат применения артрозилена как «отличный» или «хороший».
Рисунок 3. Субъективная оценка эффективности лечения
Проведенный анализ показал, что эффективность артрозилена различалась при использовании разных форм препарата и их комбинаций (таблица 3). Так, наилучшим образом «работала» схема, при которой дебютом лечения было в/м введение препарата, а затем, после получения быстрого облегчения боли, прием препарата продолжался перорально. В этой подгруппе большинство больных оценили эффективность артрозилена как «отличную».
Таблица 3. Зависимость эффективности от формы препарата
| Форма препарата | Оценка эффекта терапии (% от общего числа больных) | |||
|---|---|---|---|---|
| «Отличный» | «Хороший» | «Умеренный» | «Низкий или отсутствует» | |
| Только капсулы | 39.2 | 40.5 | 16.8 | 3.5 |
| Капсулы и спрей | 39.1 | 47.5 | 11.0 | 2.4 |
| Инъекции и капсулы | 60.4* | 26.4 | 10.1 | 3.1 |
| Только инъекции | 45.1 | 40.4 | 11.2 | 3.3 |
| Инъекции и спрей | 48.1 | 41.7 | 4.1 | 6.1 |
| Все формы | 44.1 | 43.5 | 11.3 | 1.1 |
Следует отметить, что при парентеральном введении лекарства – как в качестве монотерапии, так и в комбинации с другими формами, достигалось большее облегчение боли, чем при его пероральном применении.
Отдельно был рассмотрен вопрос эффективности артрозилена при различных нозологических формах (таб. 4). Наилучшее действие препарата было отмечено у пациентов с острым подагрическим артритом: 67.4% посчитали его «отличным», и – что особенно важно, никто из этих больных не сообщил об отсутствии значимого облегчения боли.
Таблица 4.
Зависимость эффективности от нозологической формы
Артрозилен оказался весьма эффективным и у пациентов с дорсопатиями и воспалительным поражением мягких тканей воспалительной природы: отличный эффект был отмечен более чем у половины участников исследования (от 51.0% до 56.0%, в зависимости от локализации патологии). Существенно хуже результат терапии оказался у пациентов, страдающих ОА крупных суставов. Хотя при гонартрозе и коксартрозе большинство больных отметили значительное улучшение (суммарно 76.3% и 69.2%), тем не менее «отличную» оценку новому препарату дали лишь чуть более четверти больных, т.е. в 2 раза меньше, чем при дорсопатиях (р Безопасность:
Артрозилен хорошо переносился и достаточно редко вызывал серьезные побочные эффекты. В основном проблемы касались ЖКТ. Так, у 1 больной развилась язва желудка, а у двух пациентов, у которых появились гастралгии, при проведении эндоскопического исследования были выявлены множественные эрозии слизистой желудка. У 15 пациентов возникла выраженная диспепсия (гастралгии, тошнота, тяжесть в эпигастральной области), что потребовало прерывания лечения и назначения противоязвенных средств.
Кардиоваскулярные осложнения практикующие врачи не зафиксировали – лишь у одного пациента на фоне приема артрозилена отмечена стойкая артериальная гипертензия, потребовавшая коррекции антигипертензивной терапии, которую тот ранее получал.
У двух больных были отмечены постинъекционные осложнения (выраженная боль в месте введения препарата), а еще у двух возникла кожная аллергическая реакция.
Такими образом, серьезные побочные эффекты, которые привели к прерыванию лечения, могли представлять угрозу здоровью больных или потребовали назначения специальных средств для их коррекции, были зафиксированы у 23 больных (0.75%).
Анализ показал, что появление осложнений существенно влияло на субъективную оценку эффективности лечения. Так, при возникновении диспепсии существенно меньше больных определяли результат использования артрозилена как «отличный», в сравнении с теми, кто не испытывал каких-либо осложнений: 25.8% и 49.1% соответственно (р Обсуждение результатов
Подавляющее большинство больных – 87%, отметили значительное улучшение, дав препарату отличную или хорошую оценку. Важно отметить, что субъективный критерий оценки эффективности точно совпадал с более объективным критерием снижения боли (по ВАШ). Так, значительное уменьшение ее выраженности (Артрозилен оказался особенно эффективен у лиц, испытывающих острую боль – при подагрическом артрите, воспалительном поражении мягких тканей и дорсалгии. Хороший, однако не столь яркий результат был получен и у пациентов, испытывающих болевые ощущения в течение длительного времени: в частности, у больных ОА крупных суставов.
Следует отметить, что практика парентерального назначения НПВП в качестве дебюта анальгетической терапии при использовании артрозилена себя полностью оправдала: оценка эффективности была достоверно выше у пациентов, которым этот препарат вначале назначался в/м, а затем осуществлялся переход на пероральный прием и/или использование локальных форм.
Конечно, результаты открытых неконтролируемых исследований, к которым относится КУЛОН, всегда следует трактовать с определенной осторожностью. Очевидно, что надежды, связываемые с появлением нового препарата, в значительной степени влияют на оценку результатов его применения, как со стороны пациентов, так и лечащих врачей – особенно в том случае, когда предыдущие методы терапии не обеспечили существенного улучшения состояния. Именно поэтому эффективность лекарств, оцениваемых в ходе открытых клинических испытаний, всегда существенно выше, чем при проведении «правильных», с точки зрения доказательной медицины исследований – рандомизированных, слепых, плацебо-контролируемых (РКИ).
Продолжительность лечения определялась лечащими врачами, исходя из особенностей клинической ситуации, и в среднем составила 2 недели. В конце периода наблюдения, 85% пациентов определили терапевтическое действие ацеклофенака как «очень хорошее», а 32% сообщили о полном прекращении боли. При этом число пациентов, которые на момент включения в исследование оценивали боль как «тяжелую» сократилось с 41% до 2% [9].
Однако мы можем предположить, что высокая эффективность КЛС, показанная в нашем исследовании, определяется в большей степени не субъективными, а объективными факторами. Кетопрофен заслуженно считается одним из наиболее удачных по своим терапевтическим свойствам представителей группы НПВП [7,11]. Именно поэтому он так долго и успешно используется в мировой клинической практике; более того, в последние годы отмечается отчетливый рост его популярности в европейских странах. Например, по данным Venegoni M. и сотр., на фоне небольшого, но явного снижения общих продаж основных «рецептурных» НПВП в Италии, продажа кетопрофена за период с 2006 по 2009 гг. выросла на 93%, т.е. почти в 2 раза [12].
По мнению ряда экспертов, высокий анальгетический потенциал кетопрофена может быть связан с липофильностью и относительно небольшими размерами его молекулы [7,13]. Благодаря этим параметрам он может легко проникать в воспаленную ткань, что обеспечивает высокую концентрацию действующего вещества непосредственно в зоне поражения [7,13].
Большое значение придается также способности кетопрофена к диффузии через гематоэнцефалический барьер и воздействию на центральные структуры ноцицептивной системы [14,15]. Экспериментальные данные четко подтверждают равновесие между концентрацией несвязанной фракции кетопрофена в плазме крови, и его концентрацией в цереброспинальной жидкости [16].
Необходимо заметить, что центральное действие этого препарата может определяться не только характерным для всех НПВП механизмом (блокада ЦОГ-2). В частности, обсуждается стимулирующее воздействие S-стереоизомера кетопрофена на серотонинэргическую антиноцицептивную систему [17].
Важным подтверждением преимуществ кетопрофена стала работа итальянских ученых Atzeni F. и сотр., представленная на ежегодном конгрессе американской коллегии ревматологов (ACR), прошедшем в ноябре 2012 в г. Чикаго. Исследователи провели мета-анализ РКИ, в которых сравнивалось обезболивающее действие кетопрофена 50-200 мг/сутки с ибупрофеном 600-1800 мг/сутки или диклофенаком 75-100 мг/сутки. В мировой литературе им удалось найти 13 исследований такого рода: 8 сравнений с ибупрофеном и 5 с диклофенаком, суммарно 898 участников. Препараты назначались больным РА, ОА, АС, БНЧС и страдающим болью в плече.
Кетопрофен, согласно полученным результатам, в 9 из 13 РКИ оказался достоверно более эффективным, чем препараты сравнения. При этом вероятность достижения значительного улучшения при назначении кетопрофена в среднем была почти в 2 раза выше (p=0.000) [18].
В качестве примера эффективности кетопрофена можно привести работу Jokhio I. и сотр. Они сравнили лечебное действие этого препарата и диклофенака у 180 пациентов, испытывающих выраженные боли (среднее значение по ВАШ
70 мм) вследствие травмы или острой патологии мягких тканей ревматической природы. При этом – как и в нашем исследовании, была использована т.н. «ступенчатая» терапия: в первый день НПВП применяли в виде в/м инъекций, а затем они назначались перорально. Соответственно, половина пациентов получили две инъекции кетопрофена по 100 мг, а затем принимали этот препарат по 100 мг 2 раза в день. Другая половина получила две инъекции диклофенака по 75 м, а в дальнейшем 3 раза в день принимали его по 50 мг 3 раза в день внутрь. Курс лечения составил 2 недели. К концу периода наблюдения, в группе кетопрофена у 75% пациентов интенсивность боли уменьшилась до умеренной или слабой, а у 25% она полностью купировалась. В группе диклофенака результаты лечения был скромнее: сильная боль сохранялась у 3%, умеренная или слабая у 87%, а отсутствие боли было зафиксировано лишь у 10% пациентов. При этом 72% больных, получавших кетопрофен, оценили его переносимость как «хорошую или отличную»; такую оценку диклофенаку дали лишь 50% пациентов [19].
Необходимо отметить, что кетопрофен, помимо выраженного обезболивающего действия, обладает хорошим противовоспалительным потенциалом. Этот факт подтверждается успешным опытом применения кетопрофена при анкилозирующем спондилоартрит и подагре – заболеваниях, когда эффективное подавление воспаления имеет принципиальное значение для достижения клинического успеха [20,21].
Результаты Altman R. подтверждают наши данные, показавшие наилучшее действие Артрозилена у больных с подагрическим артритом: более высокую частоту достижения субъективно отличного эффекта, в сравнении с пациентами, страдающими другими нозологическими формами.
Следует учесть, что артрозилен представляет собой кетопрофен в виде лизиновой соли, т.е. препарат, обладающий, по мнению европейских экспертов, более высоким терапевтическим потенциалом, чем «обычный» кетопрофен [7]. При этом лекарственные формы артрозилена содержат максимальное количество активной субстанции. Так, в капсуле артрозилена находится 320 мг КЛС – высшая суточная доза этого препарата, которую обеспечивает однократный прием. Аналогично, в/м введение артрозилена (2 мл содержат 160 мг КЛС) 2 раза в день также обеспечивает поступление в организм пациента максимальной суточной дозы действующего вещества. Учитывая хорошую фармакодинамику КЛС, применение артрозилена с первого же дня формируют устойчиво высокую концентрацию активного вещества в плазме крови, что должно обеспечить наилучший клинический эффект.
Максимально высокую концентрацию субстанции имеют и локальные формы артрозилена, в особенности спрей (15%). Как было отмечено выше, кетопрофен очень удобно использовать в качестве действующей субстанции для препаратов, которые наносятся на кожу. Его липофильная, небольшая молекула достаточно легко проникает через кожные покровы, обеспечивая терапевтическую концентрацию действующего вещества в пораженных областях человеческого тела. По мнению экспертов, фармакологические особенности кетопрофена, используемого в качестве действующего начала местных обезболивающих препаратов, определяет его преимущество в сравнении с другими НПВП [7, 22-24].
Четким доказательством эффективности локальной формы кетопрофена стало масштабное британское рандомизированное исследование Patel R. и сотр. В ходе этой работы 1575 больных с острой травмой мягких тканей (вывихи, ушибы, перенапряжение мышц и др.) три раза в день на протяжении 5 дней получали гелевые формы кетопрофена (2.5%), диклофенака (1%) или пироксикама (0.5%). Согласно полученным результатам, кетопрофен достоверно превосходил препараты контроля: так, «значительное улучшение» отметили 38%, 30% и 26% больных соответственно. Аналогично, большая часть больных, получавших кетопрофен, отметила «охлаждающий» эффект геля, в сравнении с контрольными средствами: 71%, 60% и 49% соответственно.
Переносимость геля кетопрофена, по мнению авторов исследования, оказалась «превосходной» [25].
Другим примером успешного использования локальной формы кетопрофена является работа Esparza F. и отр. В ходе этого исследования 223 пациента, перенесших острую спортивную травму, в течение 7-ми дней локально (в области повреждения мягких тканей) наносили ТДС с кетопрофеном или гель диклофенака. Через неделю число пациентов, у которых боль отсутствовала, у получавших кетопрофен составило 64%, в то время как в контрольной группе – только 46% (р=0.001) [26]. Учитывая благоприятный опыт использования локальных форм «обычного» кетопрофена, следует думать, что включение в схему терапии острой мышечно-скелетной боли высокодозных локальных форм КЛС должно существенно повышать суммарную эффективность анальгезии.
Полученные нами данные показывали хорошую переносимость артрозилена. Хотя нежелательные явления отмечались более чем у 10% участников исследования, в подавляющем большинстве случаев это была слабая или умеренно выраженная диспепсия, не потребовавшая отмены терапии или назначения дополнительных лекарств. Серьезные осложнения возникали очень редко – менее чем у 1% больных.
В России также был проведен ряд клинических исследований кетопрофена, которые подтвердили хорошую репутацию этого препарата: он демонстрировал хороший терапевтический потенциал и низкую частоту нежелательных явлений 33.
Это исследование показало одно из наиболее ценных преимуществ кетопрофена, которому в последнее время придается столь больше значение – низкий риск осложнений со стороны сердечно-сосудистой системы (ССС).
Похожие данные были получены Solomon M. и сотр., которые сравнили использование различных НПВП у 4425 больных, у которых развился инфаркт миокарда, и 17700 лиц без данного осложнения, основываясь на данных медицинской системы штата Нью-Джерси, США. Согласно полученным данным, разницы по приему кетопрофена в этих группах не было: его получали 53 больных, развивших кардиоваскулярное осложнение (1.2%) и 190 лиц, составлявших контроль (1.1%). Таким образом, использование кетопрофена, по данным этого исследования не повышало риск
Разумеется, хорошая переносимость КЛС не отменяет необходимости учета факторов риска осложнений со стороны ЖКТ и сердечно-сосудистой системы перед его назначением, и проведения в случае необходимости всего комплекса соответствующих профилактических мероприятий.
Таким образом, мы можем заключить, что артрозилен является эффективным средством для купирования острой и контроля хронической боли. Разнообразные лекарственные формы этого препарата позволяют выбирать индивидуальную схему анальгетической терапии для конкретного пациента и конкретной клинической ситуации. Он показал хорошую переносимость, редко вызывая серьезные осложнения со стороны ЖКТ и сердечно-сосудистой системы. Такое сочетание клинических достоинств может позволить считать артрозилен препаратом выбора для существенной части больных, страдающих патологией опорно-двигательного аппарата.
Литература:
1. Боль (практическое руководство для врачей). Под ред. Яхно Н.Н., Кукушкина М.Л., Москва, Издательство РАМН, 2012, 512 c.
2. Lee Y. Effect and treatment of chronic pain in inflammatory arthritis. Curr Rheumatol Rep. 2013; 15(1): 300.
3. Яхно Н.Н., Кукушкин М.Л. Хроническая боль: медико-биологические и социально-экономические аспекты. Вестник Российской Академии медицинских наук, 2012, N 9, 54-58
4. van de Laar M. Pergolizzi J., Mellinghoff H., et al. Pain Treatment in Arthritis-Related Pain: Beyond NSAIDs. The Open Rheumatology Journal, 2012, 6, 320-330
5. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и сотр. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Москва, «ИМА-ПРЕСС», 2009, 167 с.
6. Veys E. 20 years’ experience with ketoprofen. Scand J Rheumatol Suppl. 1991; 90: Suppl 1-44.
7. Sarzi-Puttini P., Atzeni F., Lanata L., et al. Pain and ketoprofen: what is its role in clinical practice? Reumatismo. 2010, 62(3): 172-188.
8. Zeidler H., Kaltwasser J., Leonard J., et al. Prescription and tolerability of meloxicam in day-to-day practice. Postmarketing observational cohort study of 13.307 patients in Germany. J. Clin. Rheumatol., 2002, 8, 305-315
9. Lemmel E., Leeb B., De Bast J., Aslanidis S. Patient and physician satisfaction with aceclofenac: results of the European Observational Cohort Study (experience with aceclofenac for inflammatory pain in daily practice). Curr Med Res Opin. 2002, 18(3), 146-153.
10. Le Loet X. Safety of ketoprofen in the elderly: a prospective study on 20,000 patients. Scand J Rheumatol Suppl. 1989; 83: 21-27.
11. Barden J., Derry S., McQuay H., Moore R. Single dose oral ketoprofen and dexketoprofen for acute postoperative pain in adults. Cochrane Database Syst Rev. 2009 Oct 7;(4):CD007355.
12. Venegoni M., Da Cas R., Menniti-Ippolito F., Traversa G. Effects of the European restrictive actions concerning nimesulide prescription: a simulation study on hepatopathies and gastrointestinal bleedings in Italy. Ann Ist Super Sanita. 2010;46(2):153-157.
13. Kokki H. Ketoprofen pharmacokinetics, efficacy, and tolerability in pediatric patients. Paediatr Drugs. 2010; 12(5):313-329.
14. Netter P., Lapicque F., Bannwarth B., et al. Diffusion of intramuscular ketoprofen into the cerebrospinal fluid. Eur J Clin Pharmacol. 1985; 29(3): 319-321.
15. Mannila A., Kokki H., Heikkinen M., et al. Cerebrospinal fluid distribution of ketoprofen after intravenous administration in young children. Clin Pharmacokinet. 2006; 45(7): 737-743.
16. Mannila A., Kokki H., Heikkinen M., et al. Cerebrospinal fluid distribution of ketoprofen after intravenous administration in young children. Clin Pharmacokinet. 2006; 45(7): 737-743.
17. Díaz-Reval M., Ventura-Martínez R., Déciga-Campos M., et al. Evidence for a central mechanism of action of S-(+)-ketoprofen. Eur J Pharmacol. 2004; 483(2-3): 241-248.
18. Atzeni F., Sarzi-Puttini P., Lanata L., Bagnasco M. Efficacy of Ketoprofen Vs Ibuprofen and Diclofenac: A Systematic Review of the Literature and Meta-Analysis. Arthritis Rheum., 2012, 64 (10), 114-115
19. Jokhio I., Siddiqui K., Waraich T., et al. Study of efficacy and tolerance of ketoprofen and diclofenac sodium in the treatment of acute rheumatic and traumatic conditions. J Pak Med Assoc 1998; 48: 373-376.
20. Dougados M., Béhier J., Jolchine I., et al. Efficacy of celecoxib, a cyclooxygenase 2-specific inhibitor, in the treatment of ankylosing spondylitis: a six-week controlled study with comparison against placebo and against a conventional nonsteroidal antiinflammatory drug. Arthritis Rheum. 2001, 44(1):180-185.
21. Altman R., Honig S., Levin J., Lightfoot R. Ketoprofen versus indomethacin in patients with acute gouty arthritis: a multicenter, double blind comparative study. J Rheumatol. 1988, 15(9):1422-1426.
22. Kawai S., Uchida E., Kondo M., et al. Efficacy and safety of ketoprofen patch in patients with rheumatoid arthritis: a randomized, double-blind, placebo-controlled study. J Clin Pharmacol. 2010, 50(10):1171-1179.
23. Coaccioli S. Ketoprofen 2.5% gel: a clinical overview. Eur Rev Med Pharmacol Sci. 2011; 15(8): 943-949.
24. Komatsu T., Sakurada T. Comparison of the efficacy and skin permeability of topical NSAID preparations used in Europe. Eur J Pharm Sci. 2012; 47(5): 890-895.
25. Patel R., Leswell P. Comparison of ketoprofen, piroxicam, and diclofenac gels in the treatment of acute soft-tissue injury in general practice. General Practice Study Group. Clin Ther. 1996; 18(3): 497-507.
26. Esparza F., Cobián C., Jiménez J., et al. Topical ketoprofen TDS patch versus diclofenac gel: efficacy and tolerability in benign sport related soft-tissue injuries. Br J Sports Med. 2007, 41(3): 134-139.
27. Castellsague J., Riera-Guardia N., Calingaert B., et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project).Drug Saf. 2012; 35(12): 1127-1146.
28. Helin-Salmivaara A., Saarelainen S., Gronroos J., et al. Risk of upper gastrointestinal events with the use of various NSAIDs: A case-control study in a general population. Scan J Gastroenterol, 2007; 42: 923-932
29. Schattenkirchner M. Long-term safety of ketoprofen in an elderly population of arthritic patients. Scand J Rheumatol Suppl. 1991; 91: 27-36.
30. Чичасова Н.В., Иммаметдинова Г.Р., Каратеев А.Е., и соавт. Эффективность и безопасность кетопрофена (кетонал) при ревматоидном артрите (клинико-эндоскопическое исследование). Научно-практическая ревматология 2001; 1; 47-52
31. Осипова Н.А., Петрова В.В., Ермолаев П.М., Береснев В.А. Нестероидные противовоспалительные препараты в лечении послеоперационной боли у онкологических больных. Фарматека, 2006, №6 (121)
32. Шмидт Е.И., Коган К.М., Белозерова И.В. Оценка эффективности кетонала ретард у больных остеоартрозом. Научно-практическая ревматология 2000; 2:77-79.
33. Новиков Г.А., Вайсман М.А., Прохоров Б.М. и др. Кетонал в лечении болевого синдрома у пациентов с распространенными формами злокачественных новообразований. Паллиативная медицина и реабилитация, №3, 2002, 48–51.
34. Лазебник Л.Б., Дроздов В.Н., Коломиец Е.В. Сравнительная эффективность и безопасность применения кетопрофена, лорноксикама, нимесулида и целекоксиба у больных остеоартрозом. РМЖ, 2004, 12 (14), 844-847.
35. Singh G., Mithal A., Triadafilopoulos G. Both selective COX-2 inhibitors and non-selective NSAIDs increase the risk of acute myocardial infarction in patients with arthritis; selectivity is with patients, not the drug. Ann Rheum Dis 2005, 64 (suppl 3), 85
36. Solomon D., Glynn R., Levin R., Avorn J. Nonsteroidal Anti-inflammatory Drug Use and Acute Myocardial Infarction. Arch Intern Med. 2002; 162: 1099-1104
37. Helin-Salmivaara A., Virtanen A., Vesalainen R., et al. NSAID use and the risk of hospatalisation for first myocardial infarction in the general population: a national case-control study from Finland. Eur Heart J 2006; 27: 1657-1663