Аик в медицине что это
Операции с АИК и без остановки сердца – что лучше?
До появления аппарата искусственного кровообращения (АИК) кардиохирурги не имели альтернативы. Им приходилось действовать в технически тяжелых условиях сокращающегося миокарда и наполненного кровью операционного поля. Разработка технологии АИК, выключающего сердце на время операции из системы кровообращения, казалась панацеей. Хирурги стали выполнять тончайшие манипуляции, невозможные в других условиях.
Однако операции с АИК оказались не лишены недостатков. Самый существенный – глобальная воспалительная реакция, затрагивающая все органы и системы. Она возникает из-за стимуляции иммунной системы циркуляцией крови в искусственном контуре кровообращения. Но подобные изменения, пусть и существенно меньшие, вызванные операционной травмой, происходят и после операций на работающем сердце.
Примечательно, что операции с АИК и без остановки сердца непрерывно прогрессируют, последовательно избавляясь от присущих им недостатков. Например, разработаны способы снижения остроты генерализованной воспалительной реакции после применения АИК. Это:
Совершенствуются и операции без остановки сердца. Так, созданы и широко применяются компрессионные и вакуумные стабилизационные системы для обеспечения неподвижности и мобилизации отдельных участков миокарда.
Поэтому операции с АИК и без остановки сердца не конкурируют между собой, а расширяют возможности кардиохирургов в оказании помощи пациентам в разных клинических ситуациях. Неслучайно в одном из лучших профильных учреждений – Немецком кардиоцентре в Берлине – частота тех и других вмешательств примерно одинакова с постепенным увеличением (на 10% за 10 лет) операций без применения АИК. В их числе:
Тех же позиций дифференцированного подхода придерживается руководитель известного кардиоцентра в больнице Шаарей Цедек (Иерусалим). Ведущий кардиохирург Израиля профессор Даниэль Битран при выборе метода проведения операции оценивает множество факторов, причем в особо сложных случаях – непосредственно в ходе операции. Среди них:
Операция АКШ – наиболее удачный пример для сравнения вариантов с АИК и без остановки сердца в силу ее широкой распространенности и большого числа многоцентровых исследований обоих методов. Рассмотрим этот вопрос с нескольких позиций.
АКШ без остановки сердца
требуется, например кардиоплегия или перемежающаяся фибрилляция
не требуется, но может обеспечить дополнительное преимущество
Нарушения системного кровообращения во время выделения коронарных артерий, поворота и смещения сердца
часто. Одна из причин перехода во время операции к АИК
Условия для манипулирования сердцем
Условия для качественного наложения анастомоза на артерии малого размера
Полнота реваскуляризации (восстановления кровоснабжения) миокарда
часто неполная реваскуляризация, вынуждающая в 2 раза чаще прибегать в дальнейшем к повторным операциям, чем после АКШ с АИК
определяется послеоперационными осложнениями
определяется интраоперационными осложнениями, обусловленными технической сложностью
Смертность через 1 месяц
Инфаркт миокарда в послеоперационном периоде
Инсульт в послеоперационном периоде
Свобода от повторной операции реваскуляризации миокарда в %
В течение первого года
Первичная операция с АИК
Первичная операция без остановки сердца
Достоверно доказано безусловное и явное преимущество АКШ на работающем сердце только для пациентов с высоким хирургическим риском, обусловленным осложнениями ишемической болезни сердца, дисфункцией левого желудочка, почечной недостаточностью или другими значимыми заболеваниями.
Таким образом, однозначного ответа на вопрос что лучше – операция с АИК или без остановки сердца – не существует. Оптимальный вариант может выбрать только профессионал. Важно, когда пациенты имеют возможность лечиться у лучших кардиохирургов, в отлично оснащенных кардиоцентрах, где гарантированы:
Такими преимуществами пользуются пациенты широко известных во всем мире Кардиохирургического центра больницы Шаарей Цедек в Иерусалиме и Немецкого кардиоцентра в Берлине.
Аик в медицине что это
Применение аппаратов искусственного кровообращения в кардиохирургии стало на сегодняшний день достаточно распространенной практикой. Но, несмотря на накопленный клинический опыт, этот метод остается небезопасным. Главным образом это связано с применением донорской крови. В результате её использования возникают различные осложнения, для устранения которых многие исследователи искали альтернативные растворы для первичного заполнения АИК [1]. Также немаловажную роль в развитии осложнений в послеоперационный период играют физиологические, технические, хирургические и деонтологические аспекты.
С течением времени аппараты искусственного кровообращения постоянно модифицировались, появились дополнительные устройства, позволяющие минимизировать повреждающее действие на организм, такие как оксигенаторы, экстракорпоральные контуры с минимальным первичным объемом заполнения, изготовляемые из биосовместимых материалов.
Но, несмотря на все достижения кардиохирургии в этом направлении до сих пор высок риск послеоперационных осложнений, так как эта процедура расстраивает все звенья гомеостаза.
Пациентом современной кардиохирургической клиники всё чаще становится человек, находящийся в очень тяжелом состоянии: новорожденный, ребёнок с малым весом или тяжелым врожденным пороком сердца или же взрослый, подвергающийся повторному хирургическому вмешательству или имеющий сопутствующие патологии [2].
Главной целью перфузиолога, как и много лет назад, является обеспечение наибольшей безопасности пациента во время проведения операции и минимизация послеоперационных осложнений.
Целью работы является проведение анализа литературных источников, научных статей и статистических данных по вопросу применения аппарата искусственного кровообращения в кардиохирургической практике.
Материалы и методы исследования
Материалами исследования послужили научные публикации отечественных и зарубежных ученых, опубликованные за последние 10 лет.
Результаты исследования и их обсуждение
Перфузиология – интенсивно развивающаяся отрасль медицины, которая изучает использование аппарата искусственного кровообращения при оперативных вмешательствах на сердце, которые предполагают выключение сердца из кровообращения.
Первые аппараты искусственного кровообращения (АКИ) были применены в клинической практике более 60 лет назад, причем довольно-таки успешно. С развитием кардиохирургии аппараты для перфузии длительно совершенствовались, многократно модифицировались и корректировались; в практику вводились новые методы искусственного кровообращения.
Создателем первого АИК считается советский ученый-патофизиолог С.С. Брюхоненко. В 20-е годы XX века он подробно изучал механизмы терморегуляции и причины повышения температуры тела. На основании полученных данных Брюхоненко разработал методику «переживания» головы собаки, отделенной от тела, с помощью так называемого автожектора, который со временем был запатентован в Англии, Франции и Германии. Сначала автожектор применялся для выведения организма из состояния клинической смерти, а с 1929 года он стал использоваться и для экспериментальных операций на сердце с отрытым доступом. Идея оживления после наступления клинической смерти нашла практическое применение в методиках вспомогательного кровообращения [4].
Первая успешная операция на человеке с выключением сердца из кровообращения при ушивании дефекта между предсердиями была проведена 6 мая 1953 года. В России же операции, проводимые с использованием АИК вошли в практику чуть позже, в 1957 году (первые операции были проведены под руководством А.А. Вишневского).
Тем не менее, долгое время подобные операции не находили широкого применения ввиду большого количества недостатков аппарата и высокими показателями послеоперационных осложнений. АИК для своего заполнения требовал до 4-6 литров донорской крови, аппараты были крайне ненадежны, так как физиологические узлы аппарата использовались многократно, да и способы управления таким устройством были крайне тяжелыми.
С момента первой операции аппараты постоянно усовершенствовались, появились оксигенаторы с минимальными первичными объемами заполнения; кроме того постоянно внедрялись новые биосовместимые материалы. Все это минимизировало неблагоприятное воздействие перфузии на организм. Разработка и внедрение гемодилюции (Panico F., Neptune W., 1959 г.), гипотермии в сочетании с искусственным кровообращением (Sealy W., 1958 г.) и защиты миокарда (Melrose D.G., 1955 г.) способствовали оптимизации перфузионных протоколов и повлекли за собой ряд фундаментальных исследований, посвященных изучению патофизиологических и клинических аспектов этих направлений [3].
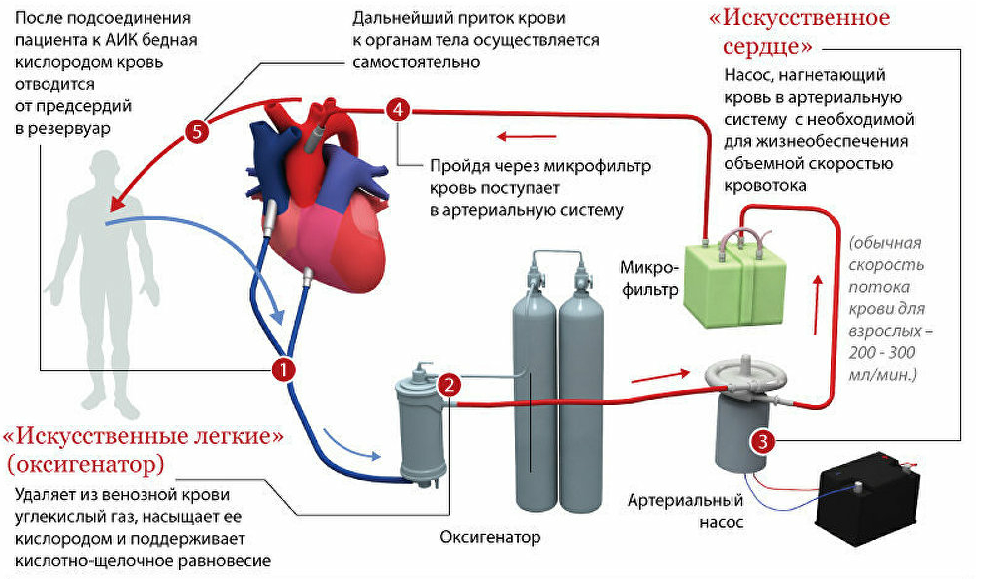
АИК состоит из двух блоков: механического и физиологического. Механический блок включает в себя собственно сам АИК, который имеет центрифужные и роликовые насосы [7], электронные системы контроля (температуры, давления, уровня в кардиотомном резервуаре, пузырьков воздуха) и безопасности. Главным узлом механического блока является артериальный насос, замещающий функцию сердца и регулирующий минутный объем крови. Другие роликовые насосы используются в качестве коронарных отсосов, для нагнетания раствора, а также осуществляют ультрафильтрацию [4].
Физиологический блок состоит из одноразового экстракорпорального контура, выполняющего роль оксигенатора, то есть замещающего легкие. Его основная функция заключается в насыщении крови кислородом и выведении углекислого газа. Для пациентов разных возрастных и весовых категорий применяются оксигенаторы с различной максимальной производительностью и разными объёмами первичного заполнения. ЭК-контур состоит из кардиотомного резервуара, который может быть как жестким, так и мягким; насосного сегмента; теплообменника; артериального фильтра-ловушки; двух или трех магистралей для отсосов и артериальной/венозной линий.
Перед тем, как начать искусственное кровообращение, ЭК-контур заполняют, диаэрируют, и только после этого подсоединяют к сердечно-сосудистой системе [9].
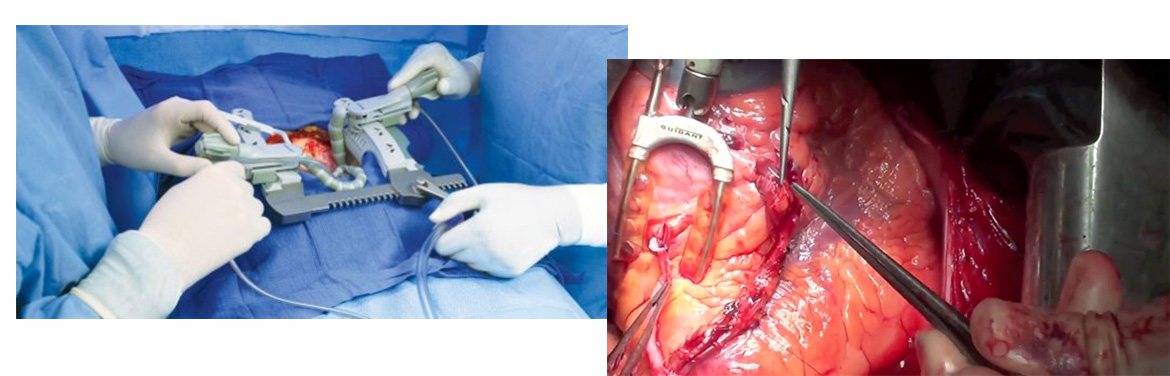
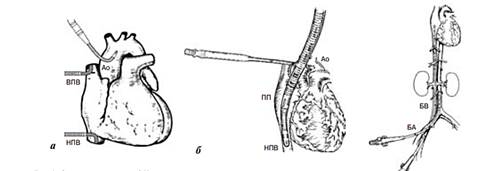
Существуют различные схемы и методы подключения ЭК-контура к сердцу, в зависимости от патологической причины, которую будут устранять во время операции. При стандартном подсоединении используется следующая схема: верхняя полая вена (ВПВ), нижняя полая вена (НПВ), аорта (Ао) (рис. 1a).
При проведении операций без вскрытия камер сердца или при остановке кровообращения с глубокой гипотермией считается достаточным применение одного венозного катетера. Также существует метод двухсекционного подключения, при котором один порт забора подсоединяют к сердцу на уровне правого предсердия, а другой – на уровне нижней полой вены. (Рис. 1б). В случаях, когда операцию проводят на аорте, а именно на восходящей её части или дуге, а также при повторных вмешательствах канюлю присоединяют к бедренной артерии. (Рис 1в).
Редкими случаями подключения являются бедренно-бедренный метод канюлирования и метод левожелудочкового обхода. Последний метод широко используется при реконструктивных операциях торакоабдоминального отдела аорты, для создания частичного сердечно-легочного обхода.
Для определения размера аортальных канюль, использующихся при присоединении ЭК-контура, учитывают максимальный минутный объем кровообращения индивидуальный для каждого конкретного пациента, а также пропускную способность канюли определенного диаметра. Выбор диаметра венозного катетера зависит от массы тела пациента и от диаметра полых вен, который хирург определяет визуально. В норме диаметр катетера должен быть не более 2/3 от просвета сосуда.
Если невозможно обеспечить адекватный венозный отток крови, в частности из-за низкой пропускной способности катетеров, применяют технику вспомогательного венозного дренажа. Эта методика является эффективной и безопасной благодаря тому, что улучшается венозный возврат без изменения градиента между кардитомным резервуаром и правыми камерами сердца, не травмируются форменные элементы крови, а также не происходит образование микроскопических эмболов.
Как только хирург подключил катетеры к магистральным сосудам, начинается перфузия. Существует две её разновидности: параллельная и полная. Параллельной перфузия считается до момента пережатия полых вен и, соответственно, прекращения притока крови к сердцу, а полной – после пережатия полых вен.
После снятия турникетов с полых вен и зажима с аорты начинается параллельная перфузия, которая может проводиться с полными объемными скоростями, когда необходимый минутный объем крови обеспечивается аппаратом искусственного кровообращения, и во вспомогательном режиме, когда часть минутного объема крови обеспечивается работой сердца, а часть – производительностью артериального насоса.
Составы первичного объема заполнения (прайма) разнообразны и зависят от многих показателей (объема циркулирующей крови, возраста и массы тела пациента, исходного гематокрита и т. д.). К основным компонентам прайма относят кристаллоидные и корригирующие растворы (KCl, NaHCO3), эритроцитарную массу, гепарин, растворы естественных (альбумин, сверхзамороженная плазма) и синтетических коллоидов (гидроксиэтилкрахмал и производные желатины), маннитол, апротинин и антибиотик [5].
АИК оказывает негативно воздействие на организм, вызывает гипероксию, гипотермию, гемодилюцию; его использование повреждает форменные элементы крови и запускает воспалительный процесс; кроме того при его использовании кровоток становится непульсирующим, что приводит к нарушению постоянства внутренней среды организма [4].
В результате этого развивается синдром системной воспалительной реакции (ССВР), к его развитию приводят активация фибринолиза, коагуляции, системы комплемента и калликреин-кининовой системы. Активируются тромбоциты и лейкоциты, повреждаются клетки эндотелия сосудов. Все это приводит к увеличению проницаемости сосудов, накоплению жидкости в интерстициальном пространстве, нарушению микроциркуляции и гипоперфузии ткани с морфофункциональными изменениями [6]. Могут возникнуть такие осложнения, как кровотечение и повреждение легких.
Клиническими проявлениями чрезмерного иммунного ответа является постперфузионный синдром, включающий в себя лихорадку, респираторные нарушения, почечную недостаточность, коагулопатии, дисфункцию миокарда и неврологические осложнения. Новорожденные и дети первого года жизни наиболее подвержены негативным влияниям переливания крови, это связано с морфофункциональными особенностями молодого организма и незрелостью иммунной системы.
Достижением перфузионных технологий является применение мини-контуров, гепариновых и биосовместимых покрытий. Применение мини-контуров без кардиотомных резервуаров позволили сократить контактную поверхность и уменьшить нарушение целостности ткани [8]. А это в свою очередь исключает возникновение ССВР за счет повышения биологической совместимости применяемых материалов, так как уменьшается контакт с чужеродной поверхностью.
Усовершенствованные оксигенаторы минимально травмируют форменные элементы и белки крови, а также обеспечивают оптимальный газовый состав.
Инновационными внедрениями в технику перфузии стали лейкодеплеция (уменьшение числа лейкоцитов) и ультрафильтрация, а также добавление в прайм (первичный объем заполнения) кортикостероидов, донорских NO-соединений и апротинина. Активированные лейкоциты повреждают эндотелий сосудов, поэтому их непрерывное удаление из переливаемой крови предотвращает возникновение воспалительного процесса. Также с донорскими лейкоцитами возможен перенос различных вирусных заболеваний (ВИЧ-инфекция, гепатиты B и C). В связи с этим для удаления лейкоцитов применяют специальные фильтры, гидрофильная синтетическая поверхность которых имеет высокое сродство к лейкоцитам, что обеспечивает высокую степень очистки.
Для новорожденных и маловесных детей разрабатываются педиатрические ЭК-контуры, которые позволяют не только уменьшить контактирующую поверхность, но и минимизируют первичный объем заполнения этих систем вплоть до полного отказа от компонентов донорской крови.
Значительный вклад в развитие кардиохирургии принесло внедрение гипотермии в процесс искусственного кровообращения. Гипотермия оказывает на организм как положительные, так и отрицательные воздействия. К положительным характеристикам гипотермии, улучшающим показатели гемодинамики при применении аппарата искусственного кровообращения, относятся снижение интенсивности метаболических процессов и потребности организма в кислороде. Благодаря этому увеличивается устойчивость организма к гипоксии. За счет увеличения растворимости газов и снижения парциального давления углекислого газа в крови наблюдается сдвиг кислотно-щелочного равновесия в кислую сторону. К отрицательным эффектам относятся централизация кровообращения за счет резкого снижения скорости кровотока в мышцах, коже и жировой ткани, повышение вязкости крови, а также увеличение сродства гемоглобина к кислороду, благодаря сдвигу кривой диссоциации оксигемоглобина влево.
Метаболизм катехоламинов в организме значительно снижается при гипотермии, в результате чего кровоснабжение сердечных и скелетных мышц ухудшается. При полной перфузии из кровотока выключаются легкие, что также негативно влияет на организм, так как в них происходит инактивация многих гормонов и вазоактивных веществ.
В современной кардиохирургии имеется тенденция к ограничению использования низких температур, однако в хирургии сложных врожденных пороков сердца гипотермическая перфузия по-прежнему остается предпочтительным методом [5].
Современные технологии позволяют минимизировать негативное влияние АИК на организм человека и значительно снижают риск возникновения послеоперационных осложнений. Общей тенденцией в дальнейшем совершенствовании аппаратов является модифицирование физиологического блока для одноразового пользования, микропористых фильтров в артериальной линии и переход к мембранным оксигенаторам.
Своевременная диагностика расстройств, возникающих во время и после проведения перфузии, является одним из главных элементов, на основании, которого проводятся многочисленные эксперименты по улучшению и повышению качества перфузии. Большинство признаков адекватности перфузии являются интегральными показателями, характеризующими «среднее» состояние организма. Поэтому мнение В.П. Осипова (1971 г.) о том, что «состояние кровотока на уровне микрососудов является прямым признаком качества перфузии» и что «ряд признаков адекватности перфузии достоверны только при отсутствии нарушений микроциркуляции», особенно актуально сегодня, когда наши возможности понять и оценить параметры микроциркуляции значительно расширились.
Аппарат искусственного кровообращения
Схема принципа работы искусственного кровообращения
Аппарат искусственного кровообращения (АИК), или аппарат «искусственное сердце — лёгкие» — специальное медицинское оборудование, обеспечивающее жизнедеятельность человека при частичной или полной невозможности выполнения функций сердца и/или лёгких.
Принцип работы
Аппарат искусственного кровообращения временно замещает функцию сердца и легких. Поэтому он состоит из нескольких блоков, а именно:
1) Оксигенатор. Кровь попадает туда из катетеризированных вен правого предсердия самотеком. В оксигенаторе она насыщается кислородом и освобождается от углекислого газа. В некоторых оксигенаторах кровь соприкасается с газом (пузырьковые, пленочные), в других она насыщается кислородом через газопроницаемую мембрану.
2) Артериальный насос. По своей конструкции он может быть мембранный, камерный, роликовый, пальчиковый. Основная функция его состоит в нагнетании оксигенированной крови в артерию.
4) Теплообменник. Согревает или охлаждает кровь до определенной требуемой температуры. Так, чтобы избежать травматизации клеток крови во время перфузии, а это возможно при длительных оперативных вмешательствах, когда она проходит через циркуляторный контур многократно, используют гипотермию. Теплообменник может быть трубчатым или щелевым.
5) Фильтр-ловушка. Кровь, попадая в аппарат искусственного кровообращения, может образовать сгустки, содержать пузырьки газа, поэтому перед обратным поступлением в кровеносное русло больного ее фильтруют.
Где используется
В основном аппарат искусственного кровообращения (АИК) применяется в кардиохирургии, при операциях на открытом сердце. Во время оперативного вмешательства сердце не может выполнять свою функцию насоса и ее заменяют механическим перекачиванием оксигенированной крови. Есть и другое применение аппарата искусственного кровообращения – это регионарная перфузия.
Осложнения при искусственном кровообращении
Основные осложнения, которые могут возникнуть при использовании аппарата искусственного кровообращения это:
Кардиоплегия
Большое значение в предупреждении воздушной эмболии имеет искусственная остановка сердца (кардиоплегия). Кардиоплегию применяют не только для предупреждения воздушной эмболии, а в основном для предупреждения гипоксических изменений в миокарде в период, когда прекращено коронарное кровообращение, и для создания удобств оперирующему на открытых полостях сердца хирургу. Кроме того, вследствие кардиоплегии удается уменьшить кровопотерю из операционной раны сердца, если во внутрисердечном периоде операции не включено коронарное кровообращение.
Экстракорпоральная мембранная оксигенация (ЭКМО, ЭМО) — инвазивный экстракорпоральный метод насыщения крови кислородом (оксигенации) при развитии тяжёлой острой дыхательной недостаточности. Используется в кардиологии при острой сердечной недостаточности и для поддержания жизнедеятельности при проведении операции на открытом сердце совместно с аппаратом искусственного кровообращения.
История
Впервые метод экстракорпоральной оксигенации был применён в 1952 году в Великобритании у больного с дыхательной недостаточностью. В 1953 году впервые успешно проведена операция на открытом сердце с искусственной перфузией и оксигенацией крови. В 1965 году пузырьковый оксигенатор впервые использован у новорождённого, умирающего от дыхательной недостаточности. В 1969 году группой врачей под руководством T.G.Baffes впервые использован мембранный оксигенатор для искусственного кровообращения у детей. В 1970 году компания Avecor создала мембранный оксигенатор, ставший прообразом всех современных аппаратов ЭКМО.
Механизм
Для проведения ЭКМО к больному подсоединяют мембранный оксигенатор. Существует два способа подключения — вено-артериальная канюляция (ВАК) и вено-венозная канюляция (ВВК). При ВАК кровь забирается из венозного русла, очищается, насыщается кислородом и подаётся в артериальное русло. ВАК рекомендуется к применению у новорождённых, а также у взрослых с компенсированным инфарктом миокарда. При ВВК кровь забирается и возвращается в венозное русло. ВВК может применяться у взрослых с изолированным поражением лёгких. Для соблюдения физиологических механизмов забор и вливание крови осуществляется максимально близко к сердцу. ВАК предпочтительнее, так как при этом способе не происходит смешивание артериальной и венозной крови. ВВК требует вдвое большую поверхность мембран оксигенатора, поэтому на практике данный способ применяется реже.
При проведении процедуры новорождённым для компенсации объёма крови, циркулирующего в аппарате, используется донорская кровь.
ЭКМО является симптоматической терапией, не устраняющей фактор развития заболевания.
Возможные осложнения и недостатки
Использование донорской крови может вызвать аллергическую реакцию и привести к развитию шока. Кроме того, для исключения свёртывания крови в аппарате на протяжении всего времени использования ЭКМО пациенту вводят антикоагулянты, что может спровоцировать тромбоцитопению, кровоизлияния в головной мозг и в полости в месте канюляции, усиленный гемолиз. Недостаточность или неэффективность антикоагулянтов может привести к тромбообразованию и закупорке механизмов аппарата ЭКМО. Неисправность аппарата может вызвать воздушную эмболию сосудов, отказ аппарата фатален для пациента.
Главными недостатками метода являются необходимость наличия дорогостоящего оборудования, высококвалифицированного персонала и высокая стоимость процедуры.
Надежность. Превосходная работа и практическая функциональность.
Постоянный и равномерный уровень обмена газов крови является залогом максимальной безопасности наших пациентов. Немецкое качество. Модели оксигенаторов производятся со стандартными микропорами или с инновационными плазменными тонкими волокнами, используемых в оксигенаторах длительного использования. Все модели оксигенаторов MEDOS имеют следующие преимущества:
— Исключительный трансфер газа.
— Низкий обьем заполнения.
— Оптимизированный поток крови, газа и жидкости.
— Компактная, простая в сборке конструкция.
Купить оксигенатор Medos производства Германии Вы можете обратившись к менеджеру-консультанту Акжолу Марасулову (+996 555 710 885).