Астенический синдром после коронавируса что делать
Как приборы «Солнышко» помогают в борьбе с астеническим синдромом после коронавируса
Коварный COVID-19 может оставить после себя целый шлейф последствий: осложнения пневмонии, дисбаланс иммунной, сердечно-сосудистой системы, неврологические проблемы. Некоторые переболевшие жалуются на нарушения в работе почек, ЖКТ, на суставные боли. В числе наиболее часто встречающихся изменений особое место занимает пресловутая астения. Как помочь ослабленному организму, как быстрее распрощаться с астеническом синдромом? Ведь слабость после коронавируса так мешает жить в привычном ритме и наслаждаться жизнью.
Что такое астенический синдром?
На начальных этапах пандемии специалисты предполагали, что патологические нарушения затрагивают исключительно легкие. Но со временем стало понятно, что вирусы способны «захватывать» многие органы и системы. Из-за многочисленных жалоб по поводу астено-невротического (астеновегетативного) синдрома пристальное внимание стали уделять и признакам упадка сил после ковида, а также и способам борьбы с ними.
Астения – это целый комплекс органически связанных симптомов, которые объединены между собой одним механизмом появления, некая реакция переболевшего организма.
Причины появления астении после коронавируса
Ученым и врачам удалось «раскрыть» основные причины такого поведения организма человека, это:
Именно причинно-следственная связь подсказала, как лечить астению после коронавируса и на что обращать большее внимание в сложных ситуациях.
Особенности течения и симптомы заболевания после COVID-19
Состояние при астении отличается от обычной усталости тем, что не уходит и после полноценного отдыха, и в дальнейшем может стать почвой для более серьезных психосоматических патологий.
Из симптоматики характерными являются:
Человек может не ощущать былой уверенности или желания что-либо делать, у него нарушается сон, теряется жизненный тонус. Конечно же, в случае астении не обойтись без соответствующего лечения, ведь иногда собственных ресурсов для полного восстановления после коронавируса может и не хватить.
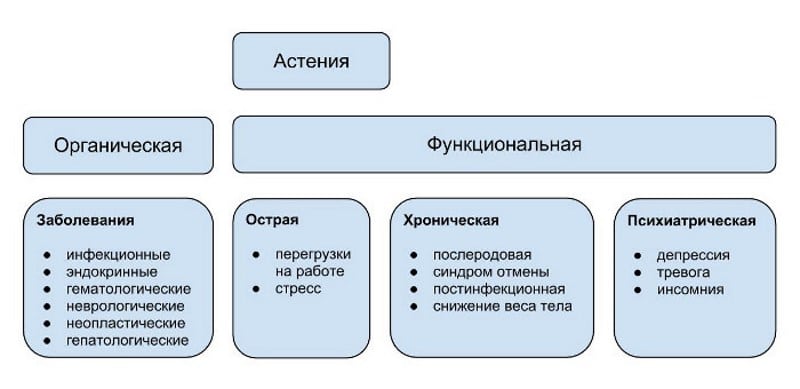
Классификация астении
Методы лечения
Чтобы в кратчайшие сроки распрощаться с такими негативными проявлениями болезни, стоит придерживаться всех рекомендаций врачей и соблюдать оптимальный режим труда, отдыха и сна. Нужно также правильно настроиться на то, что процесс полного исчезновения упадка сил после ковида может быть долгим и кропотливым.
Комплексное лечение в астении включает в себя несколько направлений:
Именно медицинские приборы, разработанные и выпускаемые ООО «Солнышко», в комплексной терапии по программе реабилитации Минздрава РФ, могут оказать неоспоримую помощь в борьбе с последствиями COVID-19. Кроме оборудования для магнито-, ДМВ-терапии, рециркуляторов производственная компания «Солнышко» имеет в своем арсенале ультрафиолетовые и бактерицидные облучатели различных моделей.
Приборы «Солнышко» могут быть использованы в домашних условиях не только для лечения астенического синдрома после коронавируса, а также:
К тому же, все аппараты зарегистрированы в Министерстве Здравоохранения РФ, снабжены сертификатами и регистрационными удостоверениями, активно закупаются и используются лечебными и профилактическими учреждениями, санаториями. Преимуществом такой методики является более быстрое возвращение «в строй», обходясь без платных санаториев.
Дефицит электролитов на фоне новой коронавирусной инфекции и постковидного астенического синдрома
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Астения — неспецифический синдром, широко распространенный в общемедицинской практике у больных острыми и хроническими соматическими заболеваниями, в том числе инфекционной природы. Новая коронавирусная инфекция COVID-19 на сегодняшний день является одной из ведущих причин развития выраженного и стойкого астенического синдрома. Важную роль в развитии астении играет гипоталамо-гипофизарно-адреналовая система, изменение функции которой под влиянием различных факторов, в том числе инфекционных, приводит к нарушениям электролитного обмена с развитием гипокалиемии и гипомагниемии. В статье описан предполагаемый механизм развития астенического синдрома на фоне коронавирусной инфекции, предусматривающий избыточную активацию ренин-ангиотензин-альдостероновой системы, что приводит, в частности, к гипокалиемии. Отмечена роль лекарственных средств, используемых в лечении пациентов с коронавирусной инфекцией. Представлены результаты исследований, свидетельствующие о высокой частоте развития гипокалиемии у пациентов с COVID-19 и позволяющие предполагать наличие прямой зависимости между степенью гипокалиемии и активностью вирусной инфекции. Отмечена важность выявления электролитных нарушений как в остром периоде вирусной инфекции, так и после перенесенного заболевания и предложены способы коррекции патологического состояния.
Ключевые слова: новая коронавирусная инфекция, COVID-19, постинфекционная астения, ангиотензинпревращающий фермент, гипокалиемия, гипомагниемия.
Для цитирования: Эбзеева Е.Ю., Остроумова О.Д., Кроткова И.Ф. и др. Дефицит электролитов на фоне новой коронавирусной инфекции и постковидного астенического синдрома. РМЖ. Медицинское обозрение. 2021;5(5):245-251. DOI: 10.32364/2587-6821-2021-5-5-245-251.
1 Russian Medical Academy of Continuous Professional Education, Moscow,
Russian Federation
2 Central Clinical Hospital «RZD-Meditsina», Moscow, Russian Federation
Asthenia is a non-specific syndrome common in general practice and occurs in patients with acute and chronic somatic disorders, including infectious ones. The novel coronavirus infection (COVID-19) is one of the leading causes of severe and persistent asthenia. The hypothalamic-pituitary-adrenal axis is essential for the development of asthenia since its dysfunction provoked by various factors (including infections) results in electrolyte metabolism impairment with hypokalemia and hypomagnesemia. This paper describes a hypothetical pathogenic mechanism of asthenia after the COVID-19, which implies over-activation of the renin-angiotensin-aldosterone system that, in particular, leads to hypokalemia. The role of pharmacotherapy prescribed for the COVID-19 is highlighted. Study results demonstrate a high rate of hypokalemia in patients with the COVID-19 and suggest a direct correlation between the severity of hypokalemia and the activity of viral infection. Furthermore, the detec tion of electrolyte abnormalities is essential in both acute infection and convalescence. Finally, the authors consider ways of relieving this pathological condition.
Keywords: novel coronavirus infection, COVID-19, post-infectious asthenia, angiotensin-converting enzyme, hypokalemia, hypomagnesemia.
For citation: Ebzeeva E.Yu., Ostroumova O.D., Krotkova I.F. et al. Electrolyte deficiency after the novel coronavirus infection and post-COVID asthenia. Russian Medical Inquiry. 2021;5(5):245–251 (in Russ.). DOI: 10.32364/2587-6821-2021-5-5-245-251.
Введение
Астенический синдром является защитной реакцией организма на дистресс различного характера, ведущий к истощению энергетических ресурсов, и развивается у пациентов с острой соматической патологией или в период обострения хронического заболевания [1]. Проявляется астения неспецифическими жалобами на патологическую слабость, утомляемость (вне зависимости от вида нагрузки), бессонницу, раздражительность, неспособность расслабиться в сочетании с мышечной болью, головной болью напряжения, головокружением и вегетативной дисфункцией [2].
Распространенность астенического синдрома в общесоматической практике варьирует от 15% до 57%: у пациентов с хроническими соматическими заболеваниями встречается в 45% наблюдений, у больных, перенесших острое заболевание, в том числе инфекционное, — в 55% [3]. Постинфекционный астенический синдром (ПИАС) встречается у 75% пациентов после перенесенного заболевания бактериальной или вирусной природы.
Клинические проявления астении возникают через 1–2 нед. после купирования симптомов инфекционного заболевания и могут сохраняться в течение нескольких месяцев [3, 4]. Их выраженность зависит от тяжести интоксикационного синдрома, наличия осложнений, возраста и преморбидного фона. Для легкой степени ПИАС характерны жалобы на слабость, усталость, разбитость, незначительные проблемы со сном. Средняя степень выраженности ПИАС проявляется болевым синдромом (миалгии, артралгии, краниалгии) и стойким нарушением сна. При выраженной степени ПИАС пациент неспособен выполнять какую-либо физическую или умственную нагрузку, отмечает тремор, тахикардию, одышку, реже тошноту. Появляются трудности с засыпанием, тревожные сновидения [4]. В Международной классификации болезней 10-го пересмотра отдельно выделен синдром G93.3 — синдром усталости после перенесенной вирусной инфекции [5].
ПИАС — один из самых частых и стойких синдромов у пациентов, перенесших COVID-19 — инфекционное заболевание, вызванное SARS-CoV-2, его симптомы могут сохраняться в течение 100 дней и более после перенесенной инфекции. Отдельно выделено «Состояние после COVID-19» (МКБ-10 U09.9) [5], которое характеризуется прогрессирующей органной патологией, полинейропатией, аутоиммунными нарушениями и длительным выраженным астеническим синдромом [6].
Патогенез ПИАС при COVID-19
Патогенетическая концепция развития астении при COVID-19 связана, в частности, с особенностями самого вируса. Вирус SARS-CoV-2 тропен к рецепторам ангиотензинпревращающего фермента 2 (АПФ2), широко представленным на клетках эндотелия сосудов, вызывает развитие эндотелиита с увеличением проницаемости сосудистой стенки, обменные нарушения, что способствует длительному персистированию астении и когнитивных нарушений на фоне COVID-19. В условиях эндотелиальной дисфункции повышенный синтез тромбоксана увеличивает агрегационные свойства тромбоцитов, приводя к снижению церебральной перфузии вследствие нарушения микроциркуляции, что также может вносить вклад в патогенез астении и когнитивных нарушений [4].
F. Silhol et al. [8] предполагают у пациентов с COVID-19 избыточную активацию ренин-ангиотензин-альдостероновой системы (РААС). При проникновении коронавируса SARS-CoV-2 в клетки-мишени посредством АПФ2 уменьшается количество последнего на их поверхности, что сопровождается нарушением клиренса ангиотензина II и избыточной секрецией альдостерона и ведет к развитию гипокалиемии вследствие чрезмерного выведения калия почками [8].
Причинами гипокалиемии у пациентов с COVID-19 могут быть и повышенные потери калия в желудочно-кишечном тракте вследствие рвоты и диареи [9].
Роль калия и магния в поддержании гомеостаза организма
Прежде чем говорить о ПИАС и сопряженных с ним нарушениях электролитного баланса, хотелось бы коротко остановиться на основных эффектах калия и магния.
Магний влияет на процессы образования молекул АТФ и адекватную работу трансмембранного ионного насоса через участие в рецепторных образованиях, поддерживающих процессы окислительного фосфорилирования в митохондриях клеток [20].
Ионы магния принимают участие в трансмембранном переносе ионов кальция, что определяет, в частности, электрическую стабильность миокарда [21]. Действуя как естественный блокатор кальциевых каналов, магний оказывает гипотензивный эффект [22–24]. При этом комбинация магния с калием усиливает антигипертензивное действие [25].
Магний — важный кофактор, принимающий участие в синтезе простагландина E1 — мощного вазодилататора и ингибитора агрегации тромбоцитов [26]. При участии ионов магния реализуется мышечная и нейрональная деятельность, осуществляется передача сигнала в тканях, обладающих электрической активностью, происходит синтез белков [21].
Нормы содержания магния в крови в среднем составляют 0,65–1,05 ммоль/л, что представляет собой очень небольшую (0,3%) часть общего фонда данного иона в теле человека [21].
Таким образом, калий и магний — чрезвычайно важные микроэлементы, принимающие участие в поддержании гомеостаза и адаптации организма как в норме, так и при различных патологических состояниях [12].
Коронавирусная инфекция, дефицит электролитов и постковидный астенический синдром
Новая коронавирусная инфекция COVID-19 в 5–20% случаев протекает с развитием двусторонней пневмонии, которая может сопровождаться острым респираторным дистресс-синдромом и требовать госпитализации [27, 28]. У госпитализированных пациентов в качестве частого электролитного нарушения выявляется гипокалиемия, распространенность которой достигает 20% [29]. В исследовании, целью которого было непосредственное изучение гипокалиемии в условиях стационара у пациентов с COVID-19, данное нарушение выявлялось в 61,7% случаев [30]. По данным А.И. Циберкина и cоавт. [31], у 37,2% больных COVID-19, госпитализированных в стационар с пневмонией, определялась гипокалиемия (К + менее 3,5 ммоль/л). Для этих пациентов были характерны более высокие уровни С-реактивного белка и лактатдегидрогеназы, более низкая сатурация О2 и значимо больший объем поражения легких по данным КТ на момент поступления в стационар. У них выявлялись более высокие уровни pH венозной крови в сравнении с пациентами без нарушений обмена К + : 7,46 (7,44–7,47) ммоль/л и 7,35 (7,31–7,39) ммоль/л соответственно. Вопрос, является ли алкалоз следствием гипокалиемии или возникает с развитием легочной недостаточности, требует дальнейшего изучения.
D. Chen et al. [30] в своей работе также выявили зависимость выраженности неспецифических лабораторных показателей воспаления, изменения легких на компьютерной томограмме от уровня калия и высказали предположение, что степень гипокалиемии и активность вирусной инфекции находятся в прямой корреляции и что регресс электролитных нарушений является благоприятным прогностическим признаком в отношении заболевания [30]. В ходе ретроспективного когортного исследования с участием 306 пациентов с пневмонией на фоне коронавирусной инфекции, госпитализированных в академический центр Университета Аликанте, установлено, что среди пациентов с нормокалиемией лишь 9% требовали госпитализации в отделение интенсивной терапии, тогда как из пациентов с легкой гипокалиемией госпитализированы были 30,3%, а с тяжелой гипокалиемией — 33,3%. Инвазивной механической вентиляции легких требовали 6,2, 25 и 33,3% пациентов, а средняя продолжительность пребывания в отделении интенсивной терапии составила 7, 11 и 16,5 дня соответственно. Как показали результаты исследования, гипокалиемия независимо связана с необходимостью инвазивной механической вентиляции легких у госпитализированных пациентов [32]. Уровень калия менее 3,5 ммоль/л у пациентов с коронавирусной инфекцией также ассоциирован с увеличением смертности от всех причин и сердечно-сосудистой смертности [33, 34]. По данным Национальной комиссии здравоохранения Китая, среди лиц, умерших от COVID-19, около 12% не имели ранее сердечно-сосудистого заболевания, но при этом у них определялся повышенный уровень сердечного тропонина I (hs-cTnI) или была остановка сердца во время госпитализации [35].
Гипокалиемия и гипомагниемия, в свою очередь, могут стать причиной развития резистентных к лекарственной терапии нарушений ритма, особенно у больных с заболеваниями сердечно-сосудистой системы, поскольку в условиях дефицита АТФ и нарушения функции калий-натриевого насоса при дистрессе отмечается избыточное проникновение в кардиомиоциты ионов натрия и кальция.
Неспецифическое учащенное сердцебиение было общим проявлением вирусной инфекции у 7,3% пациентов с COVID-19, у 16,7% отмечалась аритмия [36], которая, возможно, обусловлена воспалительными, нейрогормональными изменениями, гипоксией, нарушениями метаболизма и гипокалиемией. Около 10% пациентов с COVID-19 были переведены в отделение интенсивной терапии из-за аритмии [37].
Кардиоповреждающее действие гипокалиемии проявляется характерными изменениями на ЭКГ в виде удлинения QТ, снижения сегмента SТ, депрессии или инверсии зубца Т, появления зубца U. Прослеживается корреляция между выраженностью гипокалиемии и характером нарушений ритма. Так, при уровне калия
3,0–3,8 ммоль/л возможна желудочковая экстрасистолия, а выраженная гипокалиемия ( 2+ усугубляет гипокалиемию, нарушая реабсорбцию К + в почечных канальцах [38–40]. К последствиям гипокалиемии относят также развитие мышечной слабости, рабдомиолиз [37]. Гипокалиемия может привести к снижению сухожильных рефлексов, к параличу дыхательных мышц [38]. В условиях гипокалиемии развиваются нейровегетативные расстройства в виде приступов тремора, повышенной потливости, покраснения кожи, спонтанного дермографизма, нарушений ритма и гипертонических кризов [41]. Хроническая гипокалиемия сопровождается дисфункцией центральной нервной системы с развитием тревожно-депрессивного, ипохондрически-сенестопатического или астенического синдромов. Наблюдение за 183 больными после COVID-19 (в среднем 35 дней после «выздоровления») показало, что у 55% пациентов сохранялся выраженный астенический синдром [42]. По результатам дальнейшего наблюдения из 120 пациентов выраженная астения сохранялась у 55% даже через 110 дней после «выздоровления», что свидетельствует о развитии стойкого ПИАС при коронавирусной инфекции.
Не вызывает сомнений, что постинфекционный/постковидный астенический синдром представляет собой серьезную проблему и требует дальнейшего изучения этиологических и патогенетических факторов его развития с целью повышения эффективности терапии и определения профилактических мер. Однако распространенность и значимость ПИАС в практической медицине требуют медикаментозной коррекции уже сейчас.
Диагностика и дифференциальная диагностика ПИАС
Специфических лабораторных или инструментальных методов для подтверждения диагноза астении не существует.
Диагностика ПИАС включает в себя: сбор жалоб, анамнестических данных (имеют значение самочувствие пациента и его работоспособность перед манифестацией заболевания), обязательно проводится детализация истории болезни, включая используемые пациентом медикаменты.
Поскольку клиническая картина астенического синдрома представлена преимущественно субъективными симптомами, для его выявления используются опросники, основанные на отчете больных. В медицинской практике, как правило, используется Субъективная шкала оценки астении MFI-20 (Multidimensional Fatigue Inventory). Данная шкала выявляет астению, а входящие в опросник субшкалы позволяют оценить общую усталость, физическую и умственную утомляемость, редукцию мотиваций и активности. Также используется Шкала астенического состояния Л.Д. Малковой и Т.Г. Чертовой [43].
Дифференциальную диагностику проводят с синдромом хронической усталости (СХУ) на основании Оксфордских диагностических критериев и критериев Центров по контролю и профилактике заболеваний (Centers for Disease Control and Prevention) [44]. Также следует указать, что диагноз СХУ предполагает наличие определенных симптомов (боль в груди, фокальные неврологические дефициты, боли в суставах, болезненность лимфатических узлов, повышение температуры тела, ощущение нехватки воздуха, одышка и др.) в течение 6 мес. и более, тогда как ПИАС развивается через 1–2 нед. после перенесенной инфекции [45].
Симптомы гипокалиемии и гипомагниемии также неспецифичны, что делает необходимым лабораторное исследование уровня электролитов.
Гипокалиемию констатируют при уровне калия в сыворотке крови 3,5 ммоль/л и ниже [12]. При этом важно тщательное соблюдение правил забора крови при исследовании. Надо помнить, что продолжительное наложение жгута перед венепункцией, массаж предплечья и традиционное сжимание-разжимание кулака неизбежно приведут к повышению концентрации калия в венозной крови данной конечности, что в свою очередь нивелирует легкую гипокалиемию.
Гипомагниемия по российским стандартам диагностируется при уровне магния в крови ниже 0,85 ммоль/л [12].
Лечение ПИАС
Стандартизованных фармакологических подходов к лечению ПИАС нет, однако проявления неспецифического характера, сохраняющиеся после купирования симптомов инфекционного заболевания и вызывающие длительное снижение работоспособности и качества жизни у большинства пациентов, определяют необходимость медикаментозной коррекции — назначения препаратов с высоким профилем безопасности, высокой эффективностью и способностью воздействовать на основные патогенетические звенья развития ПИАС. Перед назначением медикаментозной терапии пациентам с ПИАС важно тщательно оценить их состояние с целью исключения осложнений коронавирусной инфекции.
Учитывая значимость дефицита ионов калия и магния в развитии серьезных нарушений в организме при коронавирусной инфекции и постковидной астении, необходимо корректировать электролитный дисбаланс. В этой связи рациональным подходом к терапии является назначение комбинации калия аспарагината и магния аспарагината (КАМА).
Учитывая, что основной контингент больных, в том числе и коронавирусной инфекцией, страдает полиморбидной патологией, важно подчеркнуть мультимодальный механизм действия КАМА с множеством плейотропных эффектов. КАМА активизирует анаболические процессы, оказывает протективное действие на миокард, сочетает в себе качества антиаритмиков I класса (оказывает мембраностабилизирующее действие) и IV класса (выступает как антагонист кальция) [46]. По мнению экспертов, пациентам с уровнем калия в сыворотке крови 2,5–3,9 ммоль/л необходимо назначать КАМА перорально амбулаторно, а при выраженной гипокалиемии (при концентрации калия в сыворотке крови ® ) принимается по 1–2 таблетки 3 р/сут, Панангин ® Форте — по 1 таблетке 3 р/сут.
Следует еще раз подчеркнуть, что клиническая эффективность препарата Панангин ® обусловлена следующими фармакологическими свойствами: он улучшает эндотелиальную функцию, оказывает антигипертензивный эффект и уменьшает вязкость крови и тромбообразование, что особенно актуально для пациентов, перенесших новую коронавирусную инфекцию COVID-19 [13].
Заключение
Проявления ПИАС и дефицита калия и магния неспецифичны и часто остаются нераспознанными. Однако их влияние на качество жизни и на прогноз, в том числе у пожилых пациентов с полиморбидной патологией, определяет необходимость своевременной диагностики и коррекции этих состояний.
Аспарагинат калия и магния можно рекомендовать в качестве одного из оптимальных препаратов для лечения ПИАС, в том числе постковидного, особенно у пациентов с полиморбидной патологией.
Авторы и редакция благодарят ООО «Гедеон Рихтер Фарма» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.
The authors and Editorial Board are grateful to Gedeon Richter LLC for providing full-text foreign articles required to write the review.
Сведения об авторах:
Эбзеева Елизавета Юрьевна — к.м.н., доцент кафедры терапии и полиморбидной патологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0001-6573-4169.
Остроумова Ольга Дмитриевна — д.м.н., профессор, заведующая кафедрой терапии и полиморбидной патологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0002- 0795-8225.
Кроткова Ирина Федоровна — к.м.н., доцент кафедры терапии и полиморбидной патологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0002-9597-1648.
Миронова Елена Владимировна — к.м.н., заведующая кардиологическим отделением ЧУЗ «ЦКБ «РЖД-Медицина»; 125367, Россия, г. Москва, Волоколамское шоссе, д. 84; ORCID iD 0000-0002-2988-1767.
Романовский Ростислав Русланович — аспирант кафедры терапии и полиморбидной патологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0001-5553-856X.
Контактная информация: Эбзеева Елизавета Юрьевна, е-mail: veta-veta67@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 29.06.2021.
Поступила после рецензирования 22.07.2021.
Принята в печать 16.08.2021
Elizaveta Yu. Ebzeeva — C. Sc. (Med.), associate professor of the Department of Therapy and Polymorbid Diseases, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0001-6573-4169.
Olga D. Ostroumova — Dr. Sc. (Med.), Professor, Head of the Department of Therapy and Polymorbid Diseases, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002- 0795-8225.
Irina F. Krotkova — C. Sc. (Med.), associate professor of the Department of Therapy and Polymorbid Diseases, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-9597-1648.
Elena V. Mironova — C. Sc. (Med.), Head of Cardiology Department, Central Clinical Hospital «RZD-Meditsina»; 84, Volokolamskoe road, Moscow, 125367, Russian Federation; ORCID iD 0000-0002-2988-1767.
Rostislav R. Romanovskiy — postgraduate student of the Department of Therapy and Polymorbid Diseases, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0001-5553-856X.
Contact information: Elizaveta Yu. Ebzeeva, е-mail: veta-veta67@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Только для зарегистрированных пользователей