Ацеклофенак или диклофенак что безопаснее
Большое проспективное открытое многоцентровое исследование по сравнению безопасности применения ацеклофенака и диклофенака у пациентов с ревматическими заболеваниями
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Нестероидные противовоспалительные препараты (НПВП) широко используются при ряде заболеваний опорно–двигательного аппарата, и их эффективность уже достаточно хорошо изучена. Однако развитие побочных реакций, в частности, со стороны верхних отделов желудочно–кишечного тракта, часто приводят к отмене терапии. У пациентов с повышенным риском (пожилые люди и пациенты с желудочно–кишечными заболеваниями в анамнезе) могут развиваться более серьезные побочные явления, такие как пептические язвы и их осложнения [1]. Иногда встречаются и побочные реакции со стороны печени и почек [2]. Очевидно, что существует потребность в препаратах с лучшим профилем побочных реакций.
Нестероидные противовоспалительные препараты (НПВП) широко используются при ряде заболеваний опорно–двигательного аппарата, и их эффективность уже достаточно хорошо изучена. Однако развитие побочных реакций, в частности, со стороны верхних отделов желудочно–кишечного тракта, часто приводят к отмене терапии. У пациентов с повышенным риском (пожилые люди и пациенты с желудочно–кишечными заболеваниями в анамнезе) могут развиваться более серьезные побочные явления, такие как пептические язвы и их осложнения [1]. Иногда встречаются и побочные реакции со стороны печени и почек [2]. Очевидно, что существует потребность в препаратах с лучшим профилем побочных реакций.
После перорального приема ацеклофенак, новое производное фенилуксусной кислоты ([2–(2’,6’–дихлорофениламино) фенил] ацетооксиуксусная кислота), быстро и хорошо абсорбируется. Время полужизни препарата составляет 4 часа [3]. Его эффективность, как действенного НПВП в терапии остеоартритов, ревматоидных артритов и анкилозирующих спондилитов, была доказана многими клиническими испытаниями, проводившими сравнение с кетопрофеном [4], индометацином [5,6], диклофенаком [7–10], напроксеном [11,12], пироксикамом [13] и теноксикамом [14]. Доклинические исследования на животных позволили предположить, что ацеклофенак в меньшей степени способен вызывать повреждения желудочного–кишечного тракта, чем диклофенак или другие НПВП [15–17]. У грызунов ульцерогенная активность ацеклофенака оказалась менее выраженной, чем у напроксена, диклофенака или индометацина [16].
Рандомизированные двойные слепые исследования у пациентов с остеоартритом предположили, что ацеклофенак реже вызывает побочные эффекты со стороны желудка и кишечника, а также отмену терапии, чем сравнивавшиеся НПВП [8,18]. Мета–анализ 13 испытаний III фазы [19], включивший 3574 пациентов, сравнивал ацеклофенак с другими НПВП. Частота развития побочных эффектов, желудочно–кишечных осложнений и отмены терапии на фоне приема ацеклофенака была значимо ниже (p Пациенты и методы
Для сравнения безопасности ацеклофенака и диклофенака было проведено открытое, неслепое обсервационное исследование в соответствии со стандартами SAMM, предложенными рабочей группой специалистов. В эту группу входят представители Агентства по контролю за лекарственными средствами (Medicines Control Agency (MCA)), Комитета по безопасности лекарственных средств (Committee on the Safety of Medicines), Британской медицинской ассоциации (British Medical Association), Ассоциации Британской фармакологической промышленности (Association of the British Pharmaceutical Industry) и Королевского Колледжа врачей общей практики (Royal College of General Practitioners).
Пациенты из Великобритании включались в исследование своими лечащими врачами на протяжении двух лет. Соответствующими критериям включения считались мужчины и женщины старше 18 лет, имеющие клинически признаки ревматоидного артрита, остеоартрита или анкилозирующего спондилита. Критериями исключения были следующие: пептическая язва в стадии обострения, желудочно–кишечное кровотечение, умеренное и тяжелое нарушение функции почек (уровень сывороточного креатинина > 300 мкмоль/л), беременность или планируемая беременность, побочные явления в анамнезе (например, приступы бронхиальной астмы, острый ринит или крапивница) или гиперчувствительность к НПВП или ацетилсалициловой кислоте, а также предшествующая терапия (за исключением ибупрофена) в течение 30 дней до первого визита.
Исследуемые препараты, стратификация и методы оценки
До включения в исследование по выбору лечащего врача пациентам назначался ацеклофенак 100 мг дважды в день или диклофенак 75 мг дважды в день. Протокол исследования рекомендовал придерживаться соотношения пациентов, получающих ацеклофенак или диклофенак, равным 3:1 соответственно, для того чтобы с большей точностью выявить необычные побочные эффекты от приема ацеклофенака. Период лечения продолжался 12 месяцев, и в это время был разрешен прием сопутствующих медикаментов.
По каждому пациенту была получена и зафиксирована исходная информация (анамнез заболевания, состояние почек, курение и употребление алкоголя). Побочные эффекты регистрировались в специальных формах во время плановых визитов к лечащему врачу на 1, 6 и 12–м месяцах исследования. Наблюдение за развитием побочных реакций продолжалось еще на протяжении 30 дней после приема последней в исследовании дозы препарата.
Первичным исходом исследования была безопасность лечения, оценивавшаяся по частоте развития побочных реакций, отмены терапии вследствие развития побочных реакций, частоте наступления тяжелых побочных эффектов или смерти. В подгруппах безопасность препаратов также оценивалась в зависимости от пола, возраста, расовой принадлежности и других клинически значимых характеристик пациентов (например, характер и тяжесть заболевания, употребления табака и алкоголя).
Данные по всем пациентам, получавшим исследуемые препараты, были включены в анализ безопасности терапии. Побочные эффекты регистрировались по системам организма в соответствии с кодовыми знаками для Толкового словаря терминов побочных реакций (COSTART).
Побочные реакции оценивались пациентами, как легкие, умеренные или тяжелые, а лечащим врачом – как несвязанные с препаратом, возможно связанные с приемом препарата или связанные с препаратом.
Тяжелыми побочные реакции считались при наличии следующего: летальный исход, госпитализация или продление госпитализации, другие угрожающие жизни состояния, постоянная инвалидизация, передозировка, рак или врожденные нарушения.
Отмена препарата проводилась при следующих условиях: побочные реакции, недостаточный терапевтический эффект, отклонение от протокола исследования, некомплаентность, невозможность наблюдения за пациентом или другие причины, в том числе и недоступность информации.
Статистические методы анализа были применены для сравнения демографических показателей, продолжительности приема исследуемых препаратов, частоты возникновения всех побочных эффектов, тяжелых побочных реакций и смерти в обеих группах.
Категориальные (непараметрические) характеристики, такие как пол и раса, сравнивались с использованием c 2 – теста. Непрерывные параметры обеих групп сравнивались при помощи вариантного анализа (ANOVA).
Сравнение частоты развития побочных эффектов, связанных с препаратами, и тяжелых побочных реакций в каждой группе проводилось с использованием точного теста Фишера. Сравнение числа пациентов, выбывших из исследования досрочно, проводилось при помощи c 2 – теста.
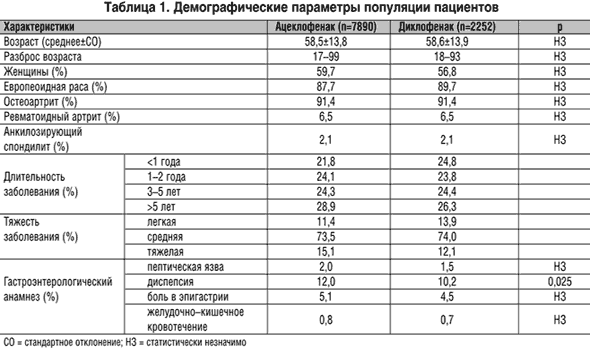
В исследование 1078 врачами было включено 10142 пациента. Среди них ацеклофенак получали 7890 пациентов, диклофенак – 2252 пациента, что соответствует соотношению 3,5:1. Кроме того, 159 пациентов получали неспецифическую терапию.
Большинство пациентов были в возрасте і 50 лет (73,9%), европеоидной расы (88,1%) и страдали остеоартритом (91,4%). Большинство пациентов были женщины (59,9%), кроме пациентов с анкилозирующим спондилитом, где доминировали мужчины (76,6%). Большая часть пациентов страдала артритом более 1 года (76,1%), а 28,1% пациентов имели длительность заболевания более 5 лет.
В целом между двумя группами не было различий по демографическим характеристикам, которые включали в себя пол, возраст, расу и вид заболевания (табл. 1). Тем не менее у пациентов, получавших ацеклофенак, длительность заболевания была значимо больше (p=0,019). Более того, значительно большее число пациентов, получавших ацеклофенак, имели тяжелые клинические проявления артрита (15,1%) по сравнению с получавшими диклофенак (12,1%).
Около 20% всей популяции пациентов страдали или имели в анамнезе желудочно–кишечные заболевания. По этому показателю значимых различий между группами установлено не было, хотя диспепсия в анамнезе чаще встречалась в группе ацеклофенака (p=0,025; табл. 1).
12–месячный период терапии закончили 27,9% пациентов, получавших ацеклофенак, и 27,0% получавших диклофенак. Средняя продолжительность приема лекарств в обеих группах была примерно одинакова: 168,1 дней для ацеклофенака и 170,0 дней для диклофенака.
Оба препарата переносились хорошо, и большинство побочных реакций носили легкий или умеренный характер. Пациенты, получавшие ацеклофенак, сообщили о меньшем числе побочных реакций (22,4%) по сравнению с диклофенаком (27,1%) (p Обсуждение результатов
В данной статье представлены результаты самого большого длительного проспективного обсервационного исследования по оценке в повседневной клинической практике побочных реакций, возникающих на фоне приема НПВП. Дизайн исследования четко согласовался с рекомендациями SAMM и был одобрен MCA. Выборка пациентов была репрезентативной и соответствовала популяции пациентов в обычной клинической практике.
Самым важным результатом этой работы стало то, что применение ацеклофенака сопровождалось лучшим профилем желудочно–кишечных побочных явлений и лучшей переносимостью, даже несмотря на то, что пациенты, принимавшие ацеклофенак, имели в анамнезе большую частоту заболеваний желудочно–кишечного тракта, чем пациенты из группы диклофенака. Различия между группами были большими и статистически значимыми. Например, частота возникновения абдоминальной боли, диареи и тошноты, которые вели к отмене терапии, у пациентов, получавших диклофенак, была в два раза больше, чем на фоне приема ацеклофенака. Это может обусловливать лучшую приемлемость терапии ацеклофенаком.
Механизм, лежащий в основе улучшенного профиля побочных эффектов ацеклофенака, остается неизвестным. Соответствующие механизмы сложны и вряд ли обусловлены каким–либо одним биологическим эффектом, например, таким как дифференциальная суппрессия циклооксигеназы–1 или циклооксигеназы–2. Тем не менее недавно проведенное гастроскопическое исследование показало, что диклофенак в значительной степени нарушает содержание гексозамина и локальный кровоток в слизистой оболочке желудка [22]. При терапии ацеклофенаком, напротив, содержание гексозамина в слизистой оболочке желудка значительно повышено, а локальный кровоток остается неизмененным [22]. Хотя точные механизмы повышения содержания гексозамина неизвестны, небольшая структурная модификация ацеклофенака может оказать превентивный эффект в отношении повреждения слизистой оболочки желудка в результате недостаточной секреции слизи.
Улучшенная переносимость ацеклофенака по сравнению с диклофенаком, о которой сообщалось в этом большом когортном SAMM–исследовании, подтверждает результаты нескольких клинических испытаний и мета–анализов, проводивших сравнение ацеклофенака с другими препаратами группы НПВП. Поскольку исследования типа SAMM дают ценную информацию по препарату, касающуюся его безопасности у большого числа пациентов, отражающих обычный контингент клинической практики, мы можем предположить, что описанный нами улучшенный профиль безопасности ацеклофенака приведет к меньшему количеству серьезных осложнений в обычных клинических ситуациях.
Камчатнов П.Р., Радыш Б.Б., Михайлова Н.А., Кутенев А.В.
Лечение
Желательны полное и раннее устранение боли с целью активного вовлечения пациента в процесс лечения и реабилитации, разъяснение больному доброкачественного характера заболевания, обучение его методам профилактики обострения. Важным является обеспечение оптимального уровня повседневной физической активности. Избыточая иммобилизация нежелательна не только у больных с изолированной БНС, но и у большинства пациентов радикулопатией. Ранняя активизация больного имеет исключительное значение в отношении предупреждения развития депрессивных расстройств и формирования болевого поведения [38].
В соответствии с Европейскими рекомендациями по лечению пациентов с острой БНС препаратом первого ряда для ее купирования является парацетамол. По обезболивающему эффекту он эквивалентен ацетилсалициловой кислоте и сопоставим с большинством нестероидных противовоспалительных препаратов (НПВП) или незначительно уступает им. Противоболевой эффект реализуется вследствие угнетения активности циклооксигеназ в периферических тканях и центрального противовоспалительного действия.
Экспериментальное изучение ацеклофенака
Сам по себе ацеклофенак обладает умеренным ингибирующим действием на ЦОГ 1 и 2 типов, однако в условиях местного воспаления полиморфноядерными лейкоцитами и моноцитами ацеклофенак частично метаболизируется в диклофенак и 4-гидроксидиклофенак, благодаря которым и угнетается активность ЦОГ [43].
Ацеклофенак способен препятствовать дегенерации хрящевой ткани. В эксперименте он продемонстрировал хондропротективные свойства, обеспечивая опосредованную интерлейкином-1 супрессию продукции металлопротеиназ, что стимулировало синтез протеогликанов хондроцитами [4]. В культуре клеток хрящевой ткани больных с остеоартрозом применение ацеклофенака сопровождалось повышением синтеза протеогликанов и гиалуроновой кислоты [6]. Ацеклофенак, обеспечивая сохранность хрящевой ткани, существенно не влияет на пролиферацию клеток сухожилий, не вызывая, соответственно, их гиперплазии.
Клиническая эффективность ацеклофенака
Считается, что обезболивающая активность 100 мг ацеклофенака по продолжительности своего действия превышает таковую после приема 650 мг парацетамола [8].
В рамках 6-месячного мультицентрового двойного слепого исследования 170 больных получали ацеклофенак (100 мг 2 раза/сут.) и диклофенак (50 мг 3 раза/сут.) [29]. Уменьшение болей и облегчение движений имели место в обеих группах, однако двигательные нарушения в большей степени купировались у больных, получавших ацеклофенак (17 и 22% соответственно).
Данные клинических исследований (выраженный обезболивающий эффект, хорошая переносимость), а также своеобразие влияния препарата на медиаторы воспаления говорит в пользу того, чтобы рассматривать ацеклофенак в качестве препарата выбора для длительной терапии больных с остеоартрозами, ревматоидным артритом, анкилозирующим спондилитом, некоторыми другими хроническими дегенеративными поражениями суставов [33].
Выраженные противовоспалительный и обезболивающий эффекты ацеклофенака обусловили изучение его эффективности у пациентов с БНС. Одно из первых таких исследований было посвящено сравнению эффективности ацеклофенака (135 больных 100 мг 2 раза/сут.) и теноксикама (138 больных 20 мг однократно в сутки) у больных с анкилозирующим спондилитом [39]. Исследование носило характер мультицентрового двойного слепого и продолжалось 12 недель. Оба препарата продемонстрировали высокую эффективность и сопоставимую переносимость.
Мультицентровое рандомизированное двойное слепое исследование было посвящено сравнению эффективности ацеклофенака (100 мг 2 раза/сут.) и диклофенака резината (75 мг 2 раза/сут.) у больных с острой неспецифической БНС [36]. В исследование были включены 227 больных, курс лечения составил 10 суток. Сроки и качество купирования болевого синдрома оказались сопоставимы в обеих группах, однако применение ацеклофенака характеризовалось значительно меньшим числом побочных эффектов.
Переносимость
Широкое, в особенности долгосрочное, применение неселективных ингибиторов ЦОГ сопряжено с высоким риском желудочных кровотечений. В связи с относительно низким риском гастроинтестинальных осложнений большой интерес вызывает возможность применения селективных ингибиторов ЦОГ-2. В ряде крупных рандомизированных клинических исследований, выполненных двойным слепым методом, было убедительно доказано, что селективные ингибиторы ЦОГ-2 обладают достоверно меньшим риском поражения желудочно-кишечного тракта по сравнению с препаратами неселективного действия. Убедительные результаты были получены в ходе исследований CLASS, VIGOR [7,37]. Ацеклофенак в большей степени ингибирует образование ЦОГ-2, вследствие чего частота серьезных гастроинтестинальных осложнений при его применении значительно ниже, чем у других НПВП (пироксикам, индометацин, теноксикам и кетопрофен) [19].
В предпринятое несколько позже Паневропейское исследование было включено 23407 пациентов с воспалительными и дегенеративными заболеваниями суставов [25]. Значительное улучшение, по мнению как больных, так и лечащих врачей, наступило у 84% больных, получающих ацеклофенак, при этом 90% из них сохранили приверженность к лечению. Результаты исследования позволили рекомендовать ацеклофенак для купирования как острых, так и хронических болевых синдромов.
Применение селективных ингибиторов ЦОГ-2 сопряжено с повышением риска сердечно-сосудистых осложнений, в первую очередь острого инфаркта миокарда и нарастания системного артериального давления [28,44]. Однако указанное свойство препаратов подтверждено не во всех исследованиях. Так, наблюдение более чем за 30 тыс. больными с остеоартритом и ревматоидным артритом, получавшими диклофенак (150 мг/сут.) или эотрикоксиб (60-90 мг/сут.), установило практически идентичный риск тромботических осложнений при их приеме [9]. В ходе цитированного выше исследования [34] зарегистрирована достоверно меньшая частота тромботических осложнений и случаев повышения артериального давления по сравнению с мелоксикамом и рофекоксибом.
Фармакокинетика ацеклофенака
При пероральном применении ацеклофенак быстро и полностью адсорбируется в кишечнике и спустя 1,5-2 ч достигает максимальной концентрации в крови. Препарат не обладает кумулятивной активностью, а его фармакокинетика не зависит от возраста пациентов. Назначается внутрь по 100 мг 2 раза/сут.
При одновременном применении других препаратов с ацеклофенаком возможно повышение концентраций в плазме крови дигоксина, фенитоина, лития и уменьшение эффективности диуретиков и антигипертензивных средств. При приеме ацеклофенака и кортикостероидов или других НПВП повышается риск развития побочных эффектов со стороны желудочно-кишечного тракта. При применении с ацетилсалициловой кислотой возможно снижение концентрации ацеклофенака в плазме крови. При одновременном применении непрямых антикоагулянтов повышается риск развития кровотечений.
Приведенные сведения об эффективности и переносимости ацеклофенака (Аэртал) позволяют рассматривать его в качестве препарата выбора у пациентов с острой болью в спине.
Литература
ИСТОЧНИК РМЖ 26 ЯНВАРЯ 2010 Г, ТОМ 18, № СПЕЦ
Нестероидные противовоспалительные препараты: список и цены
Нестероидные противовоспалительные препараты используются достаточно широко для подавления воспалительных процессов в организме. НПВП доступны в различных формах выпуска: таблетки, капсулы, мази. Они обладают тремя основными свойствами: жаропонижающими, противовоспалительными и болеутоляющими.
Лучший нестероидный противовоспалительный препарат может подобрать только врач, отталкиваясь от индивидуальных особенностей пациента. Самолечение в данном случае может быть чревато развитие серьезных побочных реакций или же передозировки. Предлагаем ознакомиться со списком препаратов. Рейтинг разработан на основании соотношения цена-качество, отзывов пациентов и мнения специалистов.
Как работают НПВП?
Нестероиды ингибируют агрегацию тромбоцитов. Терапевтические свойства объясняются блокадой фермента циклооксигеназы (ЦОГ-2), а также снижением синтеза простагландина. По мнению специалистов они оказывают влияние на симптомы заболевания, но не устраняют причину его возникновения. Поэтому не следует забывать о средствах, с помощью которых должны быть устранены первичные механизмы развития патологии.
Если у пациента обнаружена непереносимость НПВП, тогда они заменяются лекарствами других категорий. Часто в таких случаях применяют комбинацию противовоспалительного и болеутоляющего средства.
Как показывает практика, нецелесообразно заменять одно лекарство другим той же группы, если при приеме обнаруживается недостаточный терапевтический эффект. Удвоение дозы может привести только к клинически незначительному увеличению воздействия.
Классификация НПВП
Нестероидные противовоспалительные средства классифицируются в зависимости от того, являются ли они селективными для ЦОГ-2 или нет. Таким образом, с одной стороны, есть неселективные НПВП, а с другой – селективные ЦОГ-2.
Ацеклофенак в терапии остеоартроза
Проведена оценка эффективности, переносимости, безопасности терапии ацеклофенаком по сравнению с диклофенаком больных гонартрозм. Показано, что оба препарата одинаково эффективны по влиянию на боль и функциональное состояние суставов, но лечение ацеклофен
Is carried out the estimation of effectiveness, transference, safety of aceclofenac therapy in comparison to diclofenac treatment of gonartrosis patients. It is shown that both preparations are equally effective on the influence on the pain and functional state of joints, but aceclofenac treatment is safer.
Остеоартроз (ОА) — заболевание, которое развивается в результате взаимодействия различных механических и биологических факторов, нарушающих существующее в норме равновесие между процессами деградации и синтеза всех компонентов матрикса и прежде всего суставного хряща [1]. В настоящее время ОА рассматривают как органное заболевание, поскольку в патологический процесс вовлекается не только хрящ, но и субхондральная кость, синовиальная оболочка, мениски, связки и периартикулярные мышцы.
Распространенность этого заболевания в популяции коррелирует с возрастом, достигая максимальных значений в возрасте старше 65 лет. Женщины болеют почти в 2 раза чаще мужчин. Развитие заболевания приводит к ухудшению качества жизни пациентов, ограничивает их физические возможности, а зачастую и социальные функции, является причиной инвалидности. По последним данным эпидемиологического исследования в России ОА с преимущественным поражением коленных и/или тазобедренных суставов страдает 13,0% населения [2].
Ведущим клиническим симптомом при ОА является боль, которая служит непосредственной причиной обращения больного к врачу. Ревматические заболевания (РЗ) отличаются по патогенезу и клинической картине, но имеют одно общее проявление — болевой синдром. С учетом патофизиологических механизмов предложено различать три основные группы болей: ноцицептивные, нейропатические и психогенные. Для ОА наиболее характерна ноцицептивная боль, которая возникает при раздражении периферических болевых рецепторов — «ноцицепторов», локализованных практически во всех органах и системах. Нейропатическая боль возникает вследствие повреждения различных отделов (периферической и центральной) соматосенсорной нервной системы и также может наблюдаться при ОА. Ноцицептивные болевые синдромы чаще всего являются острыми (ожог, порез, ушиб, ссадина, перелом, растяжение), однако при ОА они носят хронический характер. Ноцицепторами обильно снабжены ткани суставов: синовиальная мембрана, капсула сустава, связочный аппарат, периартикулярные мышцы, субхондральная кость, которые становятся источниками хронической боли при ОА. Одной из особенностей хронических болевых синдромов является рефлекторное вовлечение мышц, сначала на сегментарном поражению уровне, затем более диффузно, формирующем мышечно-тонический синдром, возникающий вследствие ноцицептивной импульсации, идущей от пораженных тканей. При длительной ноцицептивной импульсации тонически напряженная мышца сама становится источником боли и потенциально готова к формированию миофасциального болевого синдрома. Помимо возбуждения афферентными стимулами, мышечные ноцицепторы активируются эндогенными веществами, формирующимися при ее длительном напряжении и вызывающими ощущение боли, типа брадикинина, серотонина и высоких концентраций ионов калия. Брадикинин и серотонин тоже оказывают влияние на кровеносные сосуды и вызывают изменение локального состояния васкуляризации. Длительное напряжение мышц через механизмы нейрогенного воспаления способствует появлению локусов болезненных мышечных уплотнений, что еще более усиливает афферентный поток ноцицептивных импульсов в структуры ЦНС и как следствие этого, сенситизируется большее количество центральных ноцицептивных нейронов. Этот порочный круг играет важную роль в хронизации боли [29]. Интенсивность ее при ОА может зависеть от многих факторов, и, как показали последние исследования, одним из них является нарастание минеральной плотности субхондральной большеберцовой кости [3, 4].
Ведущее место в лечении ОА занимают нестероидные противовоспалительные препараты (НПВП), относящиеся к классу симптом-модифицирующих препаратов. В ревматологии НПВП рассматриваются как необходимый компонент комплексного лечения, что патогенетически обосновано, так как постоянно присутствующий воспалительный процесс является причиной болевого синдрома и прогрессирования заболевания. Обладая противовоспалительными, анальгетическими и жаропонижающими свойствами, они широко используются для уменьшения боли, воспаления, скованности и улучшения функции суставов, не влияя на исход заболевания, но значительно улучшая качество жизни больных. Как показали данные большого числа клинических исследований, при ревматических заболеваниях (РЗ) НПВП значительно эффективнее, чем высокие дозы парацетамола (4 г/сут), и не уступают опиоидным анальгетикам (таким как трамадол) [5, 6]. Однако даже кратковременный прием НПВП у определенной группы больных может приводить к развитию серьезных нежелательных явлений.
Разнонаправленность биологического действия НПВП объясняет не только их противовоспалительное действие, но и определенный спектр класс-специфических осложнений, возникающих на фоне их приема. Наиболее частые побочные эффекты НПВП — поражение желудочно-кишечного тракта (ЖКТ), негативное влияние на систему кровообращения, снижение агрегации тромбоцитов. Потенциально важными осложнениями являются также нефро- и гепатотоксичность.
Развитие НПВП-индуцированных гастропатий определяется в первую очередь системным воздействием НПВП, связанным с подавлением активности циклооксигеназы-1 (ЦОГ-1), определяющей синтез «цитопротективных» простагландинов (ПГ), что приводит к существенному снижению ее защитного потенциала и способствует повреждению слизистой. Снижение агрегации тромбоцитов, ухудшение капиллярного кровотока в слизистой, блокада NO-синтетазы и ферментных систем митохондрий эпителиоцитов, усиление клеточного апоптоза, влияние на желудочную секрецию и нарушение процессов репарации связаны с блокадой ЦОГ-2 и являются дополнительными факторами, связанными с системным воздействием НПВП [8]. НПВП-гастропатии возникают в хронологической связи с приемом НПВП и проявляются эрозиями и язвами верхних отделов ЖКТ, на фоне которых возможны такие осложнения, как желудочно-кишечное кровотечение и перфорация. Негативное влияние этих препаратов может отмечаться во всех отделах ЖКТ, от полости рта до прямой кишки. Поражения печени, ассоциированные с регулярным приемом НПВП, проявляются бессимптомным повышением трансаминаз у 1–5% больных. Клинически выраженные гепатотоксические реакции встречаются существенно реже — около 1 случая на 10 000 больных. Больным, регулярно принимающим НПВП и имеющим возможные факторы риска поражения печени, требуется регулярный контроль биохимического анализа крови.
Кардиоваскулярные побочные эффекты НПВП особенно выражены у лиц пожилого возраста и у больных, страдающих сопутствующими заболеваниями (ишемическая болезнь сердца, сахарный диабет), а также ревматическими воспалительными заболеваниями (в первую очередь ревматоидный артрит (РА)). НПВП являются независимым фактором риска развития артериальной гипертензии (АГ). Результаты рандомизированных клинических исследований и метаанализов свидетельствуют, что прием неселективных (нНПВП) и селективных НПВП (сНПВП) приводит к повышению АД и имеет существенное значение у больных, исходно имеющих АГ [9]. Особое внимание привлечено к потенциальным кардиоваскулярным осложнениям на фоне приема сНПВП, что связано с возможностью этих препаратов снижать ЦОГ-2-зависимый синтез простациклина (РGl2) клетками сосудистого эндотелия и отсутствием влияния на ЦОГ-1-зависимый синтез тромбоксана (ТхА2) тромбоцитами, что потенциально может приводить к нарушению баланса РGl2/ТхА2 и, следовательно, к активации агрегации и адгезии тромбоцитов и увеличению риска тромбообразования. Необходимо отметить, что НПВП, как класс, способны повышать риск развития кардиоваскулярных осложнений, однако этот фактор существенно уступает по значению другим, таким как курение, дислипидемия, ожирение [8, 27].
Тем не менее, при грамотном назначении НПВП можно снизить риск развития нежелательных явлений. При индивидуальном подборе НПВП необходимо учитывать анальгетический эффект препарата, индивидуальный риск развития нежелательных явлений со стороны ЖКТ и сердечно-сосудистой системы. Опасность ЖКТ-осложнений снижается при назначении ингибиторов протонной помпы (ИПП), а кардиоваскулярный риск — при использовании низких доз ацетилсалициловой кислоты [10]. Необходимо помнить, что основными факторами риска являются пожилой возраст (старше 65 лет), наличие в анамнезе язвенной болезни, длительный прием высоких доз НПВП и одновременное применение двух и более различных НПВП, а также сочетанный прием НПВП и гормональных препаратов. В последних международных рекомендациях по лечению больных ОА говорится о том, что терапию НПВП необходимо проводить в минимальных эффективных дозах и, по возможности, не назначать их длительно [7].
В России имеется широкий спектр НПВП и закономерно возникает вопрос о рациональном выборе препарата. Несомненно, он должен основываться на объективном сравнении достоинств и недостатков различных представителей этой группы препаратов. Доказано, что в эквивалентных дозах и при достаточном времени наблюдения все НПВП (селективные и неселективные) демонстрируют одинаковую эффективность [28].
Основной принцип действия НПВП заключается в подавлении ЦОГ — фермента метаболизма арахидоновой кислоты в простагландины. Особое место среди НПВП занимает ацеклофенак (Аэртал), который обладает многокомпонентным действием на воспаление. Ацеклофенак ингибирует и ЦОГ-1 (синтез физиологических ПГ), и ЦОГ-2 (синтез провоспалительных ПГ), приближаясь к селективным НПВП, и поэтому является более безопасным в отношении ЖКТ. Препарат ингибирует синтез провоспалительного цитокина интерлейкина IL-1-бета, который подавляет пролиферацию хондроцитов и активизирует деградацию хряща. Важной способностью ацеклофенака является подавление синтеза фактора некроза опухоли альфа (ФНО-альфа), оксида азота. Кроме этого, препарат угнетает экспрессию молекул клеточной адгезии (L-селектин), подавляет адгезию нейтрофилов к эндотелию, что обеспечивает выраженный противовоспалительный эффект [14, 15]. В настоящее время особое внимание уделяется влиянию НПВП на метаболизм хрящевой ткани. Условно НПВП можно разделить на три группы: хондронегативные, нейтральные по отношению к хрящевой ткани и хондропротективные. Вопрос о негативном влиянии некоторых препаратов из этой группы на прогрессирование ОА широко обсуждается [11–13]. Так, в исследованиях in vitro было показано, что индометацин и салицилаты ингибируют синтез компонентов матрикса хряща, способствуя прогрессированию заболевания, а индометацин оказывает прямое негативное действие, снижая содержание протеогликанов в гиалиновом хряще и повышая потерю вновь образованных протеогликанов. В то же время некоторые НПВП повышают синтез компонентов матрикса и тормозят апоптоз хондроцитов. Ацеклофенак в эксперименте продемонстрировал способность повышать синтез протеогликанов и гиалуроновой кислоты в культуре клеток хряща больных ОА, а также снижать продукцию металлопротеиназ, вызывающих деструкцию костной и хрящевой ткани [14, 15]. Blot L. и соавт., изучая изменения в метаболизме протеогликанов и гиалуронана под влиянием ацеклофенака, диклофенака и мелоксикама в эксплантах хряща, полученных от больных среднетяжелым и тяжелым гонартрозом, показали, что при лечении диклофенаком метаболический баланс между содержанием протеогликанов и гиалуроновой кислоты в экстрацеллюлярном матриксе гиалинового хряща оставался без изменений. Ацеклофенак и мелоксикам, напротив, обладали дозозависимым эффектом и повышали синтез протеогликанов и гиалуроновой кислоты при среднетяжелом ОА [15].
Клиническая эффективность ацеклофенака доказана в 132 опубликованных клинических исследованиях. Переносимость и эффективность этого препарата изучалась в сравнительных исследованиях с различными анальгетиками и НПВП. Так, Battle-Gualda E. и соавт. в двойном слепом рандомизированном 6-недельном исследовании у 168 больных с ОА коленных суставов показали, что ацеклофенак в дозе 200 мг/сут был эффективнее в отношении купирования болевого синдрома при лучшей переносимости по сравнению с парацетамолом 3 г/сут [16]. В более длительном исследовании (период наблюдения составил 12 недель) у больных с гонартрозом, ацеклофенак 200 мг/сут сравнивали с напроксеном 1 г/сут. Оба препарата обладали равным анальгетическим эффектом, однако у ацеклофенака было отмечено значительно меньшее количество нежелательных явлений со стороны ЖКТ [17]. Результаты метаанализа 13 рандомизированных двойных слепых исследований у пациентов с РЗ показали, что при приеме ацеклофенака в течение длительного времени (3–6 месяцев) побочные реакции развивались в 1,38 раза реже, чем при приеме других НПВП [18]. Эффективность ацеклофенака оценивалась в рандомизированных исследованиях и при других РЗ: при РА ацеклофенак в дозе 200 мг/сут был сопоставим с диклофенаком в дозе 150 мг/сут, кетопрофеном в дозе 150 мг/сут, пироксикамом в дозе 20 мг/сут. Также было отмечено, что положительная динамика быстрее развивалась у больных, получавших ацеклофенак. У больных с анкилозирующим спондилоартритом (АС) в сравнительных исследованиях ацеклофенака 200 мг/сут, теноксикама 20 мг/сут, напроксена 1 г/сут и индометацина 100 мг/сут были получены сходные результаты [19].
Больные РЗ, как правило, вынуждены принимать НПВП длительное время, поэтому очень важна хорошая переносимость препарата. Результаты проспективного, открытого, многоцентрового 12-месячного исследования SAMM (Safety Assessment of Marketed Medicines), в котором оценивалась безопасность ацеклофенака и диклофенака у 10 142 больных, страдающих РА, ОА, АС, подтвердили хорошую переносимость ацеклофенака [20]. Ацеклофенак в дозе 200 мг/сут получали 7890 человек и диклофенак 150 мг/сут — 2252 пациента. Исследователями была проанализирована частота побочных реакций: нежелательные явления возникли у 22,4% больных, получавших ацеклофенак, и у 27,1% — принимавших диклофенак. Наиболее частыми из них были реакции со стороны ЖКТ (диспепсия, боли, диарея, тошнота) — в 10,6% и 15,2% (р 40 мм по ВАШ. По демографическим и клиническим параметрам группы были сопоставимы (табл. 1). Первая группа принимала ацеклофенак (Аэртал) 200 мг/сут, вторая — диклофенак 100 мг/сут. Длительность исследования составила 3 месяца. Оценивались: индекс WOMAC, тест «встань и иди», опросник EQ-5D, общий и биохимический анализы крови.
Результаты исследования и обсуждение
Достоверное уменьшение интенсивности боли и улучшение функции суставов, уменьшение суммарного индекса WOMAC отмечалось через месяц терапии в обеих группах больных и сохранялось весь период наблюдения (табл. 2). Более быстрое снижение скованности отмечалось у больных, принимавших ацеклофенак, когда уже на втором визите были получены статистически значимые показатели, к концу лечения отмечалось достоверное снижение скованности в обеих группах больных. Достоверное улучшение показателей общего состояния здоровья и EQ-5 D, а также уменьшение затрачиваемого времени при выполнении теста «встань и иди» наблюдалось в обеих группах со второго визита.
Через месяц «значительное улучшение» и «улучшение» чаще наблюдалось на фоне приема ацеклофенака (86,3%), чем на диклофенаке (66%), через 3 месяца терапии — у 95,8% и у 76,2% соответственно (р
Е. П. Шарапова*, кандидат медицинских наук
Е. А. Таскина*
Т. А. Раскина**, доктор медицинских наук
И. Б. Виноградова***, кандидат медицинских наук, доцент
О. Н. Иванова****, кандидат медицинских наук
Л. В. Меньшикова*****, доктор медицинских наук, профессор
Л. И. Алексеева*, доктор медицинских наук, профессор
*ФГБУ НИИ ревматологии РАМН, Москва
**ГБОУ ВПО КемГМА Минздравсоцразвития России, Кемерово
***ГУЗ ОКБ, Ульяновск
****ГУЗ ОКБ № 1, Воронеж
*****ГБОУ ДПО ИГМАПО Минздравсоцразвития России, Иркутск




.gif)