Азот газ для чего используют
Использование азота в промышленности
Широкое применение азота в промышленности обусловлено такими характеристиками, как инертность и низкая температура перехода в жидкое состояние, а также распространенностью газа. Применяется азот в различных производственных целях, например, в нефтегазовой, металлургической, горнодобывающей отраслях, пищевой и целлюлозно-бумажной промышленности, а также в других сферах деятельности.
Характеристики азота
Использование азота в промышленности возможно в жидкой и газообразной форме. Получают материал мембранным, криогенным и адсорбционным способами. Последний вариант является наиболее востребованным при получении больших объемов азота, обладающего следующими характеристиками:
Азот практически не растворяется в воде и других жидкостях, не проводит тепловую и электрическую энергию, а его содержание в атмосфере составляет 75%. Благодаря подобным характеристикам газ имеет большое практическое значение, количество вариантов использования материала постоянно растет.
Как используют азот в промышленных отраслях?
Применение азота в промышленности в первую очередь связано с нефтегазовой и металлургической отраслью. При добыче углеводородов с помощью инертного газа удается выровнять давление в скважинах. Азот вытесняет природный газ, создавая оптимальные условия для добычи нефти. При этом газ не поддерживает процессы горения и безопасен в использовании. Кроме нефтедобычи, материал применяется для продувки магистралей перекачки углеводородов, а также их тестирования на предмет обнаружения скрытых дефектов. С помощью азота из емкостей для хранения природного газа удаляется кислород.
Для нефтехимической отрасли использование азота актуально при производстве полимеров и пластмасс. С помощью инертного газа удается наладить изготовление красителей. В металлургии применение газа необходимо при закаливании различных марок стали и обжиге металла. Кроме решения указанных задач, газ применяется в следующих целях:
Использование азота в промышленности охватывает различные отрасли, актуально и востребовано крупными производственными предприятиями и небольшими компаниями. Купить адсорбционные генераторы различной мощности и производительности можно в компании Оксимат. Оборудование поставляется в комплекте с монтажными и пусконаладочными работами, имеет долгосрочную гарантию.
Содержание
История открытия азота
Окончательное имя «азот» дал французский ученый Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier).
Слово «азот» греческого происхождения и означает «безжизненный».
Способы получения азота
Получение N2 в промышленных масштабах основано на производстве его из воздуха путем фракционной перегонки (см. получение азота).
Виды азота
Закись азота (N2O) не может быть получена из газообразного кислорода и N2, она образуется из азотнокислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
Газообразный азот относительно инертный по своим свойствам газ без цвета и запаха плотностью 1,25046 кг/м 3 при 0°C и давлении 101,3 кПа. Удельный объем газообразного азота равен 860,4 дм 3 /кг при давлении около 105 Па и температуре 20°C.
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства и поэтому его концентрацию в зоне плавления стремятся ограничить.
Применение азота
Азот нашел применение во многих отраслях промышленности и ниже приведен небольшой список :
Применение азота в сварке
N2 является инертным по отношению к меди и ее сплавам (не растворяется в меди и не реагирует с ней) даже при высоких температурах. Азот применяют, как в чистом виде, так и в составе защитного газовой смеси с аргоном Ar (70-90%) + N2 (30-10%) для сварки меди и ее сплавов.
Возникает логичный вопрос: «Если он образует карбиды, какой смысл его использовать для сварки нержавеющих сталей, в составе которых есть карбидообразующие элементы?»
Все дело в том, что даже сравнительно небольшое содержание N2 увеличивает тепловую мощность дуги. Именно из-за этого свойства, его чаще всего используют не для сварки, а для плазменной резки.
При сварке полуавтоматом нержавейки добавление небольшого количества азота к смеси аргона с кислородом (95-97,5% Ar, 1% O2, 1,5-3% N2) позволяет добиться равномерной аустенитной структуры в сварных швах. При добавлении азота более 10% начинается обильное выделение дыма, но это не оказывает какого-либо негативного влияния на качество сварного шва нержавеющей стали.
При сварке полуавтоматом малоуглеродистых сталей содержание N2 в газовой смеси более 2% вызывает пористость при сварке в один проход. Концентрация N2 менее 0,5% вызывает пористость в сварном шве при многопроходной сварке.
Применение смеси Ar c высоким содержанием N2 для сварки меди и ее сплавов вызывает большое разбрызгивание металла сварочной ванны.
Вредность и опасность азота
Азот относится к нетоксичным газам, но может действовать как простой асфиксант (удушающий газ). Удушье наступает тогда, когда уровень кислорода в воздухе сокращается на 75% или становится ниже нормальной концентрации.
В больших количествах он очень вреден и опасен для организма человека.
Хранение и транспортировка азота
Выпускают азот по ГОСТ 9293 газообразным и жидким. Для сварки и плазменной резки применяют газообразный 1-го (99,6% N2) и 2-го (99,0% N2) сортов.
Хранят и транспортируют его в сжатом состоянии в стальных баллонах по ГОСТ 949.
Баллоны окрашены в черный цвет и надписью желтыми буквами «АЗОТ» на верхней цилиндрической части.
Характеристики азота
Характеристики N2 указаны в таблицах ниже:
Что такое азот и для чего используется?
Азот – это химический элемент с атомным номером 7. Является газом без запаха, вкуса и цвета.
Таким образом, человек не ощущает присутствия азота в земной атмосфере, между тем как она состоит из этого вещества на 78 процентов. Азот относится к самым распространенным веществам на нашей планете. Часто можно слышать, что без азота не было бы жизни на Земле, и это правда. Ведь белковые соединения, из которых состоит все живое, обязательно содержат в себе азот.
Азот в природе
Азот находится в атмосфере в виде молекул, состоящих из двух атомов. Помимо атмосферы, азот есть в мантии Земли и в гумусном слое почвы. Основной источник азота для промышленного производства – это полезные ископаемые.
Однако в последние десятилетия, когда запасы минералов стали истощаться, возникла острая необходимость выделения азота из воздуха в промышленных масштабах. В настоящее время эта проблема решена, и огромные объемы азота для нужд промышленности добываются из атмосферы.
Роль азота в биологии, круговорот азота
На Земле азот претерпевает ряд трансформаций, в которых участвуют и биотические (связанные с жизнью) и абиотические факторы. Из атмосферы и почвы азот поступает в растения, причем не напрямую, а через микроорганизмы. Азотфиксирующие бактерии удерживают и перерабатывают азот, превращая его в форму, легко усваиваемую растениями. В организме растений азот переходит в состав сложных соединений, в частности – белков.
По пищевой цепи эти вещества попадают в организмы травоядных, а затем – хищников. После гибели всего живого азот вновь попадает в почву, где подвергается разложению (аммонификации и денитрификации). Азот фиксируется в грунте, минералах, воде, попадает в атмосферу, и круг повторяется.
Применение азота
После открытия азота (это произошло в 18-м столетии), были хорошо изучены свойства самого вещества, его соединений, возможности использования в хозяйстве. Поскольку запасы азота на нашей планете огромны, данный элемент стал использоваться крайне активно.

Чистый азот применяется в жидком или газообразном виде. Жидкий азот имеет температуру минус 196 градусов по Цельсию и применяется в следующих областях:
– в медицине. Жидкий азот является хладагентом при процедурах криотерапии, то есть лечения холодом. Мгновенная заморозка применяется для удаления различных новообразований. В жидком азоте хранят образцы тканей и живые клетки (в частности – сперматозоиды и яйцеклетки). Низкая температура позволяет сохранить биоматериал в течение длительного времени, а затем разморозить и использовать.
Возможность хранить в жидком азоте целые живые организмы, а при необходимости размораживать их без всякого вреда высказана писателями-фантастами. Однако в реальности освоить эту технологию пока не удалось;
– в пищевой промышленности жидкий азот используется при розливе жидкостей для создания инертной среды в таре.
Вообще азот применяется в тех областях, где необходима газообразная среда без кислорода, например,
– в пожаротушении. Азот вытесняет кислород, без которого процессы горения не поддерживаются и огонь затухает.
Газообразный азот нашел применение в таких отраслях:
– производство продуктов питания. Азот используется как инертная газовая среда для сохранения свежести продуктов в упаковке;
– в нефтедобывающей промышленности и горном деле. Азотом продувают трубопроводы и резервуары, его нагнетают в шахты для формирования взрывобезопасной газовой среды;
– в самолетостроении азотом накачивают шины шасси.
Все вышесказанное относится к применению чистого азота, но не стоит забывать, что этот элемент является исходным сырьем для производства массы всевозможных соединений:
– аммиак. Чрезвычайно востребованное вещество с содержанием азота. Аммиак идет на производство удобрений, полимеров, соды, азотной кислоты. Сам по себе применяется в медицине, изготовлении холодильной техники;
– красители и т.д.

Азот – не только один из наиболее распространенных химических элементов, но и очень нужный компонент, применяемый во многих отраслях человеческой деятельности.
Азот — «безжизненный» газ, крайне важный для всего живого
Азот — газ, простое химическое вещество, неметалл, элемент 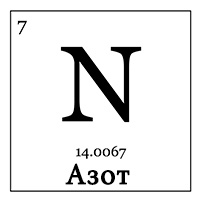
Название «азот» и созвучные ему используются во многих странах: во Франции, Италии, России, Турции, в некоторых восточнославянских и в странах бывшего СССР. По основной версии, название «азот» происходит от греческого слова azoos — «безжизненный», так как не пригоден для дыхания.
Азот в основном встречается как газ — в воздухе его около 78% (по объему). Месторождения полезных ископаемых, а которых он содержится — например, чилийской селитры (нитрат натрия), индийской селитры (нитрат калия) большей частью уже истощены, поэтому в промышленных масштабах реактив добывают химическим синтезом прямо из атмосферы.
Свойства

Элемент крайне важен для жизни всего живого. Он является неотъемлемой частью белков, нуклеиновых кислот, гемоглобина, хлорофилла и многих других биологически важных соединений. Играет основную роль в обмене веществ живых клеток и организмов.
Азот выпускается в виде сжатого при 150 атмосфер газа, поставляется в баллонах черного цвета с крупной и четкой надписью желтого цвета. Жидкий реагент хранят в сосудах Дьюара (термос с двойными стенками, с серебрением изнутри и вакуумом между стенок).
Опасность азота
В обычных условиях азот не вреден для человека и животных, но при повышенном давлении вызывает наркотическое опьянение, а при нехватке кислорода — удушье. С азотом и его воздействием на кровь человека при резком снижении давления связана очень опасная кессонная болезнь.
Это интересно
Вероятно, все хотя бы однажды видели в фильмах или сериалах, 
Азот относится к пниктогенам — химическим элементам той же подгруппы таблицы Менделеева, что и он сам. Кроме азота к пниктогенам относят фосфор, мышьяк, сурьму, висмут и искусственно полученный московий.
Жидкий азот — идеальный материал для тушения пожаров, особенно с ценными объектами. После тушения азотом не остается ни воды, ни пены, ни порошка, а газ просто выветривается.
Применение
— Три четверти всего выпускаемого в мире азота идет на производство аммиака, из которого, в свою очередь, производят широко использующуюся в разных сферах промышленности азотную кислоту.
— В сельском хозяйстве соединения азота используются как удобрения, а сам азот — для лучшей сохранности овощей в овощехранилищах.
— Для производства взрывчатых веществ, детонаторов, топлива для космических аппаратов (гидразина).
— Для изготовления красителей, медикаментов.
— При перекачке горючих веществ по трубам, в шахтах, в электронных приборах.
— Для тушения кокса в металлургии, для создания нейтральной атмосферы в промышленных процессах.
— Для продувки труб и резервуаров; распирания пластов в горнодобыче; прокачки топлива в ракетах.
— Для закачки в самолетные шины, иногда — в автомобильные.
— Для производства особой керамики — нитрида кремния, обладающего повышенной механической, термической, химической стойкостью и многими другими полезными характеристиками.
— Пищевую добавку Е941 используют для создания в упаковках консервирующей среды, исключающей окисление и развитие микроорганизмов. Жидкий азот используют при разливе напитков и масел.
Жидкий азот применяется как:
— Хладагент в криостатах, вакуумных установках и т. п.
— В криогенной терапии в косметологии и медицине, для проведения некоторых видов диагностики, для хранения образцов биоматериалов, спермы, яйцеклеток.
— В криогенной резке.
— Для тушения пожаров. Испаряясь, реагент образует массу газа в 700 раз большую, чем объем жидкости. Этот газ оттесняет кислород от пламени, и оно тухнет.
Для чего нужен азот?
Азот – это химический элемент с атомным номером 7. Является газом без запаха, вкуса и цвета.
Таким образом, человек не ощущает присутствия азота в земной атмосфере, между тем как она состоит из этого вещества на 78 процентов. Азот относится к самым распространенным веществам на нашей планете. Часто можно слышать, что без азота не было бы жизни на Земле, и это правда. Ведь белковые соединения, из которых состоит все живое, обязательно содержат в себе азот.
Азот в природе
Азот находится в атмосфере в виде молекул, состоящих из двух атомов. Помимо атмосферы, азот есть в мантии Земли и в гумусном слое почвы. Основной источник азота для промышленного производства – это полезные ископаемые.
Однако в последние десятилетия, когда запасы минералов стали истощаться, возникла острая необходимость выделения азота из воздуха в промышленных масштабах. В настоящее время эта проблема решена, и огромные объемы азота для нужд промышленности добываются из атмосферы.
Роль азота в биологии, круговорот азота
На Земле азот претерпевает ряд трансформаций, в которых участвуют и биотические (связанные с жизнью) и абиотические факторы. Из атмосферы и почвы азот поступает в растения, причем не напрямую, а через микроорганизмы. Азотфиксирующие бактерии удерживают и перерабатывают азот, превращая его в форму, легко усваиваемую растениями. В организме растений азот переходит в состав сложных соединений, в частности – белков.
По пищевой цепи эти вещества попадают в организмы травоядных, а затем – хищников. После гибели всего живого азот вновь попадает в почву, где подвергается разложению (аммонификации и денитрификации). Азот фиксируется в грунте, минералах, воде, попадает в атмосферу, и круг повторяется.
Азот: что это такое и где он используется?
Азот или Nitrogenium – это инертный двухатомный газ без цвета, вкуса и запаха: его невозможно увидеть, если газ не заморожен и не сжижен. Первооткрыватели азота поначалу называли вещество, как «удушливый», «испорченный или флогистированный воздух», «атмосферный мофетт». Эти и другие названия употреблялись вплоть до выхода новой химической номенклатуры, авторы которой решили остановиться на слове «азот», которое, по их мнению, полностью отображало основное свойство вещества – непригодность для дыхания и жизни.
Мало, кто знает, что азот по важности для человека занимает третье место, после кислорода и водорода. Во-первых, потому что газ является главной составляющей атмосферного воздуха (в пределах 75% всего объема). И во-вторых, азот широко используется во многих сферах деятельности человека, начиная от медицины и заканчивая производством взрывчатых устройств. Не случайно в 1992 году авторитетное издание Science присудило оксиду азота (NO) почетную премию «Молекула года».
Чтобы иметь неограниченный источник его получения и обеспечить непрерывность технологических процессов, используют специальное оборудование – генераторы азота, которые позволяют получать данный газ требуемой чистоты.
Виды азота
По видам азот делиться на следующие:
Свойства этого газа были изучены английским химиком Гемфри Дэви (Humphry Davy) в 1799 году. Интересуясь действием различных газов на организм человека, Дэви обычно испытывал их на себе. При вдыхании закиси азота, он пришел в возбужденное состояние, сопровождаемое смехом. За эти свойства закись азота была названа им – веселящим газом. В дальнейшем было установлено, что при более длительном вдыхании закиси азота наступает потеря сознания. Закись азота – окисел, не дающий кислот, он относится к несолеобразующим окислам.
Закись азота (N2O) не может быть получена из газообразного кислорода и N2, она образуется из азотнокислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
В отличие от кислорода, который взаимодействует почти со всеми элементами, встречающимися в природе, газообразный азот при комнатной температуре соединяется с единственным элементом – литием, образуя при этом нитрид лития:
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства и поэтому его концентрацию в зоне плавления стремятся ограничить.
Свойства азота
Молекула азота очень стабильна, поэтому химреактив в основном инертен, взаимодействует в нормальных условиях только с литием, цезием и комплексами переходных металлов. Для проведения реакций с другими веществами требуются особые условия: очень высокая температура и давление, а иногда и катализатор. Не вступает в реакции с галогенами, серой, углеродом, кремнием, фосфором.
Элемент крайне важен для жизни всего живого. Он является неотъемлемой частью белков, нуклеиновых кислот, гемоглобина, хлорофилла и многих других биологически важных соединений. Играет основную роль в обмене веществ живых клеток и организмов.
Азот выпускается в виде сжатого при 150 атмосфер газа, поставляется в баллонах черного цвета с крупной и четкой надписью желтого цвета. Жидкий реагент хранят в сосудах Дьюара (термос с двойными стенками, с серебрением изнутри и вакуумом между стенок).
Опасность азота
Несмотря на то, что азот N2 является нетоксичным и не имеет отрицательного влияния на окружающую среду, для человека его действие может иметь весьма неприятные последствия. Замещая в атмосфере и вытесняя из организма кислород, данный газ работает как удушающий агент. При уменьшении концентрации кислорода в воздухе ниже 19% человек начинает испытывать следующие симптомы:
Поэтому при работе в азотной среде важно придерживаться основных мер безопасности – часто проветривать помещение и контролировать содержание O2.
Источники получения азота
Физико-химические свойства азота обуславливают его широкое применение во многих отраслях жизнедеятельности человека. Для непрерывного протекания технологических процессов требуется постоянное наличие инертного газа требуемой степени чистоты. С это целью используют три основных источника его получения:
Самостоятельная генерация азота для промышленных нужд – к такому решению приходят многие компании, в технологических процессах которых требуется постоянное применение данного газа. Получение азота посредством работы собственных генераторов является наиболее экономически выгодным способом, так как:
Существует два типа генераторных установок для получения азота:
Каждый из данных способов получения газа имеет свои преимущества, поэтому выбор генераторов азота осуществляется в зависимости от нужд конкретного предприятия.
Применение азота в технологических процессах
Азот широко используется в различных технологических процессах. В промышленности и при выполнении сварочных работ используются, в основном, инертные свойства газа. Жидкий азот также применяется в качестве эффективного хладагента.
Наибольшее распространение этот инертный газ получил в следующих сферах промышленности:
Также этот газ может быть использован при изготовлении электроники и производстве стекла. В газообразном состоянии азот используется в качестве защитного газа при сварке металлов. В процессе соединения металла с помощью азота вытесняется кислород, тем самым снижая разрушительное действие этого окислителя.
Инертные качества этого газа могут применяться в установках пожаротушения. Азот не поддерживает горение, а, попадая в очаг возгорания, уменьшает концентрацию кислорода, что приводит к прекращению процесса окисления вещества.
В медицине жидкий азот используется для удаления различных новообразований на поверхности кожи. В этом агрегатном состоянии вещество может применяться при проведении омолаживающих процедур. Криогенная терапия хорошо воздействует на весь организм, активируя защитные и восстановительные свойства иммунной системы. В химической промышленности азот применяется для производства азотных удобрений и аммиака.
В чем хранится и транспортируется технический азот?
Хранение и перевозка технического азота осуществляется в баллонах из стали (ГОСТ 949-73) черного цвета с желтой надписью. Сжиженный газ транспортируется в специальных цистернах или криогенных резервуарах.
До недавнего времени эксплуатация жидкого азота как инертного вещества считалась абсолютно безопасной. Однако, на сегодня известно несколько случаев взрывов резервуаров и оборудования, работающего со сжиженным N2, что вызвано быстрым испарением жидкой фазы и обогащением ее кислородом. Поэтому при эксплуатации житкоазотных сосудов необходимо руководствоваться такими же требованиями, как и при работе с резервуарами с жидким кислородом.
Во время перевозки газообразного состава необходимо избегать ударов и падений сосудов, а также их перегрева. Поскольку внутреннее давление емкости составляет 15-20 Мпа, при сильном ударе или нагреве более 60°C появляется риск разгерметизации или взрыва.
Азотный баллон, как и любая емкость, работающая под давлением, должен периодически подвергаться переаттестации. При этом к качеству и чистоте резервуара предъявляются, как правило, более высокие требования, чем, например, к сосудам, предназначенным для заправки CO2.
Читайте также:
Жидкий азот – сколько градусов?
Сколько азота в воздухе?
Как сказывается на растениях недостаток азота фосфора калия?



