Бактериофаг что это за лекарство
Что такое бактериофаги
Поделиться:
Инфекционные заболевания были бичом человечества до того момента, как начали появляться антибактериальные препараты. Обычно новую эру связывают с именем Флеминга и пенициллином. Однако на десять лет раньше было сделано открытие, которое, возможно, еще пригодится всем нам в будущем.
Убить убийцу
Говорят, война — это всегда огромный скачок в развитии хирургии. На самом деле не только: военные действия нередко способствовали продвижению онкотерапии и терапии инфекционных болезней.
Читайте также:
Медицина в годы ВОВ
Во время 1-й мировой войны канадский врач Феликс Д’Эррель изучал вспышку дизентерии среди солдат-французов. Это неприятное кишечное заболевание вызывается бактериями рода Shigellа, которых легко можно выделить из стула больных.
Врач заинтересовался случаем одного солдата, который полностью выздоровел, причем раньше, чем появилось улучшение у других, кого начали лечить одновременно с ним. Взяв у него пробы стула, Д’Эррель не обнаружил бактерий — что-то загадочное убило их.
Исследователь отфильтровал свой «материал», пропустив его через фильтр с настолько мелкими порами, что через них не могла бы пройти ни одна бактерия или какие-нибудь частицы испражнений. В полученный раствор врач добавил готовую культуру бактерий, взятых от другого больного, высадил все это в чашку Петри и стал ждать.
Читайте также:
Профилактика и лечение острых кишечных инфекций
Через некоторое время начался рост бактериальной культуры, однако колонии были разорванными — словно что-то неведомое разъедало их изнутри. Взяв мазки из «пустых» областей, Д’Эррель добавил их в «хорошие», здоровые колонии шигелл — и в них тоже образовались пустоты.
Практика, обогнавшая теорию
Поскольку к этому моменту наш соотечественник Дмитрий Ивановский уже открыл вирусы, Д’Эррель предположил, что невидимый глазу убийца бактерий относится именно к ним. Понимая важность своего открытия, исследователь дал вирусам, поражающим бактерии, отдельное имя — бактериофаги.
Увидеть фагов удалось только после изобретения электронного микроскопа, а выяснить, чтó именно происходит при их контакте с бактериями, — и того позже. Поэтому в течение многих лет идея Д’Эрреля отвергалась значительной частью ученых, которым было трудно представить себе вирус, поражающий бактерию, но не причиняющий вреда человеку. К тому же опыты канадца удавалось повторить не всем и не всегда.
Однако врач, не дожидаясь никаких теоретических подтверждений своего открытия, перешел к практике. Он не мог, имея в руках лекарство, видеть умирающих людей — и принялся лечить солдат фаговым раствором. Правда, сперва Д’Эррель убедился в его безвредности традиционным для таких энтузиастов способом: сперва пил бактериофаг, затем впрыскивал себе под кожу.
Естественное против искусственного
Выяснив, что для человека бактериофаг совершенно не опасен, Д’Эррель вылечил многих пациентов, что принесло ему известность. Его исследования даже стали основой для художественного романа «Эрроусмит», позднее экранизированного Голливудом. Фаговые лекарства успешно производились и применялись — но уже в 40-х годах энтузиазм начал угасать.
Причиной этого стало открытие Флемингом пенициллина и появление большого числа антибиотиков. Врачи настороженно относились к идее лечения людей с помощью вирусов, а тут у них появилась альтернатива. Антибиотики — химические вещества, полученные искусственно, — не были живыми и казались медикам более надежными. Фармацевтические компании уловили настроения врачебного сообщества и, прекратив выпуск фагов, принялись множить антибиотики.
Бактериофаги сегодня
В наше время, когда антибиотикорезистентность является глобальной и очень опасной проблемой, бактериофаги снова заинтересовали ученых.
У них есть свои недостатки — например, не просто узкий, а суперузкий спектр действия: каждый фаг «умеет» убивать только один штамм бактерий — даже не вид, а штамм. Из-за этого, кстати, и проваливались регулярно попытки повторить эксперименты Д‘Эрреля: дизентерия в двух разных частях армии, идентичная по симптомам и течению, могла быть вызвана разными «вариантами» шигелл.
Однако эту проблему сегодня может решить постепенное распространение такого диагностического метода, как полимеразная цепная реакция (ПЦР), которая точно определит штамм бактерии.
Бактериофаги не могут проникать через стенку клетки, поэтому они пока бессильны против тех возбудителей, которые паразитируют внутриклеточно. «Пока» — потому что активные исследования в этом направлении, возможно, помогут фагам пробираться в самые потаенные места.
А вот среди плюсов бактериофагов с ходу можно выделить два: во-первых, они совершенно безвредны для человека, поскольку вообще никак не взаимодействуют с его организмом — только с бактериями.
И, во-вторых, бактерий они убивают не всех, а значит, не имеют традиционного недостатка применения антибиотиков — возникновения дисбиоза. Так что сегодня бактериофаги стали перспективной областью — и в каком-то смысле новой надеждой человечества.
Товар по теме: [product strict=»(бактериофаг»](бактериофаг)
Место бактериофагов в терапии инфекционных заболеваний желудочно-кишечного тракта
Место бактериофагов в терапии инфекционных заболеваний желудочно-кишечного тракта
Наиболее дискутабельным остается вопрос о целесообразности использования антимикробных препаратов (АМП) в лечении бактериальных ОКИ у детей. Назначая АМП в этих случаях, врач ожидает: уменьшения выраженности клинических симптомов, сокращения продолжительности заболевания, снижения частоты развития осложнений, прекращения выделения возбудителя, предупреждения дальнейшего распространения инфекции [4, 5].
В то же время доказано, что использование антибиотиков далеко не всегда является эффективным и безопасным при бактериальной диарее. Так, при энтерогеморрагическом эшерихиозе применение АМП приводит к массивному высвобождению шигаподобного токсина, следовательно, увеличивает риск развития гемолитико-уремического синдрома [6].
Назначение АМП при бактериальных диареях в значительном проценте случаев не только не приводит к санации макроорганизма от возбудителя, а, наоборот, способствует продолжительной персистенции бактериального агента в желудочно-кишечном тракте (ЖКТ) вследствие не только подавляющего влияния на аутохтонную микробиоту кишечника, но и прямого иммуносупрессивного действия [7, 8]. По данным отечественных и зарубежных исследователей, затяжное реконвалесцентное бактериовыделение сальмонелл формируется у значительного числа пациентов, получавших антибиотики в острую фазу инфекции, по сравнению с лицами, использующими исключительно
патогенетическую терапию [9, 10].
Экономический ущерб, наносимый возникновением антибиотикорезистентных форм бактерий, исчисляется десятками и сотнями миллионов долларов. Например, в странах Евросоюза он составляет как минимум 1,5 млрд. евро в год [11]. В сложившейся ситуации альтернативу АМП в терапии бактериальных диарей могут составить бактериофаги [12, 13].
Необходимо отметить, что в медицинском сообществе в настоящее время присутствует две полярные точки зрения на роль и место бактериофагов в терапии инфекционных заболеваний. Часть специалистов, ориентируясь на зарубежные протоколы и гадлайны, считают использование бактериофагов архаичным и небезопасным наследием прошлых десятилетий советской медицины; другие – широко применяют препараты фагов в своей клинической практике без каких-либо сомнений и при этом не опираются на исследования чувствительности и эффективности терапии.
Автору пришлось неоднократно беседовать с представителями обеих групп специалистов, и оказалось, что в большинстве случаев мало кто из них мог правильно ответить на вопрос, что представляют собой бактериофаги и каков их механизм действия. Бактериофаги – это вирусы, избирательно поражающие бактериальные клетки. В первую очередь необходимо понимать, что бактериофаги – это древние обитатели планеты и каждый грамм почвы, каждый кубический сантиметр воды и воздуха, продукты питания,
растения, животные содержат миллионы фаговых частиц (от 10 до 100 млн). Фаговые частицы в огромном количестве содержатся на кожных покровах, слизистых оболочках и в открытых полостях организма человека. Бактериофаги – самые вездесущие и наиболее распространенные существа на Земле, их насчитывают 1030–1032. Доказано, что бактериофаги играют важную роль в эволюции бактерий и реализации их патогенных свойств. Фаги способствуют формированию генетического разнообразия бактерий [14–16].
Выделяют вирулентные и умеренные бактериофаги. Вирулентные фаги: заражение бактерий ими всегда заканчивается разрушением бактерий и высвобождением зрелых фаговых частиц, готовых к поражению новых бактериальных клеток, – литический эффект. Умеренные бактериофаги: генетический материал фагов включается в хромосомы бактерий, такие фаги называются профагами и вызывают лизогенный эффект (лизогенную конверсию). Умеренные фаги интегрируются в бактериальную хромосому и размножаются синхронно с клеткой хозяина, не вызывая лизиса долгое время. Умеренные фаги могут переносить хозяйские гены (гены бактериальной клетки) от одной
бактериальной клетки к другой (фаговая трансдукция).
В настоящее время доказано, что множество факторов вирулентности у патогенных и условно-патогенных бактерий закодировано с помощью профаговых генов.
Так у Vibrio cholerae, Clostridium botulinum продукция токсинов обусловлена профагами [15, 16].
Бактериофаги – это высокоэффективные иммунобиологические препараты антимикробного действия, применяются для лечения и профилактики бактериальных инфекций, в том числе инфекций, связанных с оказанием медицинской помощи. Антимикробный эффект бактериофагов обусловлен внедрением фага в бактериальную клетку с последующим его размножением и лизисом инфицированной клетки. Вышедшие во внешнюю среду в результате лизиса бактериофаги повторно инфицируют и лизируют другие бактериальные клетки, действуя до полного уничтожения патогенных бактерий в очаге воспаления [14–17]. В настоящее время описано 13 семейств бактериофагов,
подразделенных более чем на 140 родов, содержащих более 5300 видов.
Бактериофаги широко применялись для лечения разных заболеваний с 1920-х годов как в СССР, так и зарубежных странах. Символично, что в 1930–1932 гг. Моррисон впервые применил массовую фаготерапию во время эпидемии холеры в Индии, затем долгие годы ученые считали, что с помощью бактериофагов можно управлять эпидемическим процессом при холере, однако эти мировоззрения оказались ошибочными [18].
Однако с 1940–1950-х годов производство и применение фагов на Западе практически прекратились. Препараты бактериофагов на сегодняшний день производятся лишь в России, Грузии и Польше. Однако в настоящее время интерес к бактериофагам возрождается во всем мире. Так, в 2006 г. Управление по контролю за продуктами и лекарствами Соединенных Штатов разрешило использование бактериофагов Listeria monocytogenes в качестве антимикробного компонента в сырах, а в 2007 г. – во всех готовых к употреблению продуктах. Препарат выпускается компанией Intralytix Inc. (США) и представляет собой смесь из шести фагов, активных в отношении L. monocytogenes. По инициативе этой же компании в 2008 г. была завершена I фаза клинических исследований препарата бактериофагов, содержащего восемь фагов, специфически лизирующих Pseudomonas aeruginosa, S. aureus и E. coli. Показана безопасность этого препарата при лечении венозных язв [18]. В августе 2009 г. корпорацией Nestlé Nutrition (Швейцария) в Бангладеш были инициированы клинические исследования по изучению безопасности и эффективности применения бактериофага E. coli в терапии ОКИ у детей в возрасте от 6 до 60 мес [19].
В настоящее время бактериофаги используются в качестве АМП при разных бактериальных инфекциях: желудочно-кишечного тракта (ЖКТ), ЛОР-органов, органа зрения, дыхательных путей, урогенитального тракта, генерализованных септических заболеваний, ожоговых ранах, хирургических инфекциях; для профилактики инфекций, связанных с оказанием медицинской помощи [20].
Фаги проникают через эпителиальные барьеры слизистых оболочек с помощью рецепторзависимого транспорта, активно осуществляемого специализированными клетками иммунной системы (М-клетками, бокаловидными) и, возможно, клетками эпителия кишечника и других отделов ЖКТ. Бактериофаг, введенный любым способом, поступает в общий ток крови, в крови не задерживается и адсорбируется тканями, оседая в первую очередь в лимфатических узлах, печени и селезенке. Выводится фаг из организма через кишечник и почки. После перорального приема фаговые частицы обнаруживаются через 1 ч в образцах крови, через 1–1,5 ч – на поверхности ожоговых ран и в бронхиальном содержимом, через 2 ч – в ликворе и моче. После однократного приема больными пациентами фаги выделялись с мочой в течение 5–6 сут с постепенным уменьшением титра. Гематоэнцефалический барьер не является барьером для проникновения фагов в центральную нервную систему. Необходимо отметить, что
скорость транслокации фагов, так же как и бактерий из ЖКТ в кровь, может существенно меняться в разных физиологических состояниях. При воспалительном ответе транслокация бактерий и, вероятно, фагов из кишечника значительно увеличивается [18].
Бактериофаги, используемые в составе лечебно-профилактических препаратов, должны иметь литический цикл развития (т.е. быть вирулентными), вследствие которого происходит гибель бактериальной клетки-мишени. По определенным участкам генов, кодирующим белок капсида бактериофага, можно быстро и с известной долей вероятности определить его принадлежность к семействам литических фагов.
В 1920–1940 гг. в Канаде и США бактериофаги широко использовались для лечения дизентерии, брюшного тифа и сальмонеллеза. Причем большинство исследователей показали их хорошую клиническую эффективность, в первую очередь снижение смертности на 30% и более по сравнению с группой сравнения [18].
Промышленное производство «кишечных» бактериофагов и их широкое использование в СССР были развернуты в 1940-е годы. Учитывая социально-экономические реалии того времени, большинство исследований посвящалось профилактике и лечению дизентерии. Следует отметить, что эффективность бактериофагов при ОКИ с давних пор изучалась и в ФГБУ НИИДИ ФМБА России. Изучение культур, выделенных от дизентерийных больных в бактериологической лаборатории НИИ детских инфекций под руководством профессора В.Н.Черновой, показало, что в 1968–1973 гг. бактериофагом лизировалось 98–99% выделенных культур шигелл Зонне, что подтверждало целесообразность его применения. Следующим этапом поиска рациональных методов лечения дизентерии явилось исследование эффективности новых форм дизентерийного поливалентного таблетированного бактериофага с ацидорезистентным покрытием и нетиповыми основаниями, синтезированного в Горьковском НИИ эпидемиологии и микробиологии (З.Н.Орлова) в 1969–1972 гг., ранее эффективность применения колипротейного и сальмонеллезного бактериофагов в свечах изучалась Б.М.Элинсон, И.Л.Гусарской (1965 г.).
Результаты лечения детей новыми формами бактериофагов были обобщены в кандидатской диссертации З.Н.Орловой «Эффективность лечения дизентерии у детей новой модификацией бактериофага с ацидорезистентным покрытием в сопоставлении с другими методами по клинико-иммунологическим данным» (1971 г.). Бактериофаги высокоспецифичны при лечении бактериальных инфекций, не вызывают развития резистентности микроорганизмов, являются самовоспроизводящимися организмами: ДНК бактериофага встраивается в хромосому бактерии, вследствие чего бактериальная клетка начинает продуцировать сотни бактериофагов, поражающих бактерии до их полного
уничтожения; бактериофаги в состоянии проникнуть глубоко в очаг инфекции. Они являются не только самовоспроизводящимися организмами, но и саморегулирующимися: когда все бактерии поражены бактериофагами, их количество, как и число бактериофагов, начинает уменьшаться. Бактериофаги оказывают стимулирующее действие на гуморальное и клеточное звенья иммунитета. В отсутствие бактерий, необходимых для размножения бактериофагов, последние быстро удаляются из организма [17, 18, 20, 21].
Традиционной формой выпуска бактериофагов является жидкий препарат (кроме таблетированных форм кишечных фагов), поэтому фаги используют для приема через рот, в виде клизм, аппликаций, орошений, введения в полости ран, вагины, носа, а также путем введения в дренированные полости – брюшную, плевральную, мочевого пузыря, почечной лоханки [18, 20].
Препараты бактериофагов при энтеральном и ректальном пути введения безопасны и нетоксичны для человека. Они не имеют противопоказаний к применению, кроме аллергических реакций, и могут быть использованы в сочетании с любыми другими лекарственными средствами. Препараты бактериофагов можно назначать беременным, кормящим матерям и детям, начиная с раннего возраста [17, 18, 20, 21]; они эффективны в монотерапии, но могут быть также использованы и в комбинации с антибиотиками [22]. Необходимо отметить, что в раннем детском возрасте (до 3–4 мес) использовать бактериофаги можно только по строгим показаниям, учитывая значимую частоту аллергических и диарейных побочных реакций у детей данной возрастной группы. Следует отметить, что побочные реакции в результате употребления фагов обычно связаны с массивным распадом бактериальных клеток с выделением эндотоксина под действием бактериофага. Нивелировать данные нежелательные явления можно при помощи включения в комплекс терапии энтеросорбентов. При использовании фагов в сочетании с терапевтическими дозами АМП отсутствует негативное воздействие
этих препаратов на развитие бактериофагов, но отмечается взаимное потенцирование их терапевтического эффекта. Установлено, что воздействие фагов на антибиотикоустойчивые штаммы бактерий может быть более активным по сравнению с воздействием на антибиотикочувствительные штаммы того же вида [18, 23].
Следовательно, показания к использованию бактериофагов при ОКИ можно сформулировать следующим образом:
• в качестве монотерапии – при стертых и легких формах инвазивных ОКИ;
• в сочетании с антибактериальной терапией или последовательно – при среднетяжелых и тяжелых формах ОКИ в период обратного развития симптомов;
• при бактериовыделении (у реконвалесцентных или транзиторных бактерионосителей);
• в комплексе терапии энтероколитов условно-патогенной и стафилококковой этиологии у детей раннего возраста;
• для коррекции нарушений микробиоценоза кишечника.
Дозы бактериофагов в зависимости от возраста приведены в табл. 1, 2. Бактериофаги назначаются 2–3 раза в сутки. Поскольку при приеме жидких препаратов бактериофагов перорально происходит частичная инактивация бактериофагов кислой средой желудка, целесообразно производить препараты бактериофагов в таблетках с кислотоустойчивыми капсулами и суппозиториях. В табл. 3 представлены бактериофаги, используемые в Российской Федерации для терапии и профилактики инфекционных диарей.
При острых кишечных инфекциях «кишечные» бактериофаги назначают в период разгара болезни (при наличии рвоты, фебрильной лихорадки, выраженного диарейного синдрома) наравне с основной этиотропной терапией [29]. В последние 10–15 лет в РФ большинство публикаций и научных исследований посвящено использованию сальмонеллезного бактериофага при реконвалесцентном бактериовыделении сальмонелл. Наши собственные исследования и исследования других авторов
свидетельствуют о высокой чувствительности циркулирующих штаммов сальмонелл к специфическому бактериофагу (82–96%) [24, 25].
Очень актуальным является исследование В.Г.Акимкина, посвященное купированию продолжительной нозокомиальной вспышки сальмонеллеза в Главном военном клиническом госпитале им. Н.Н.Бурденко, с использованием адаптированного сальмонеллезного бактериофага как в виде монотерапии, так и в комплексе с АМП фторхинолонового ряда [13, 26]. Таким образом, практика использования лечебнопрофилактических бактериофагов показала необходимость осуществления бактериологического мониторинга за возможными изменениями фаголизабильности по отношению к выделяемым культурам сальмонелл в стационаре. Доказано, что регулярная передача на производство свежевыделенных штаммов возбудителей ОКИ способствует повышению литической активности и расширению диапазона действия препаратов бактериофагов [26–28].
Применение бактериофагов по эпидемиологическим показаниям при ОКИ
Бактериофаги находят свое применение и с профилактической целью при чрезвычайных ситуациях природного характера (наводнения и т.д.), в очагах бактериальной инфекции, в первую очередь шигеллеза, сальмонеллеза и брюшного тифа, заболеваний, вызванных условно-патогенными возбудителями (протеем, синегнойной палочкой) [20].
В эпидемических очагах (шигеллеза, сальмонеллеза) бактериофаги применяют для фагирования детей, посещающих детские дошкольные учреждения, и работников пищевых предприятий, водопроводных и коммунальных сооружений и др. Фагирование всех общавшихся с источником ОКИ проводят при неблагоприятных санитарных условиях в очаге, а также при оставлении больного на дому. В качестве профилактики препараты фагов принимают ежедневно в виде разовой возрастной дозы: детям в возрасте от 1 года до 3-х лет – по 1 таблетке; от 3–8 лет – по 2 таблетки; взрослым – по 3 таблетки. Продолжительность приема как правило определяется
условиями эпидситуации.
Если необходимо давать жидкий бактериофаг (шигеллезный, сальмонеллезный или интести-бактериофаг), то пересчет следующий: 1 таблетка сухого бактериофага равна 20 мл жидкого фага. До приема жидкого бактериофага желательно выпить щелочной минеральной воды («Боржоми», «Ессентуки» и т.д.). Противопоказаний к применению бактериофага не имеется. Применение бактериофагов с профилактической целью хорошо зарекомендовало себя во время чрезвычайных ситуаций последних лет: наводнения в Крымске (2012 г.), паводка на Дальнем Востоке (2013 г.).
Наука не стоит на месте: создаются и внедряются новые препараты лечебно-профилактических фагов: разработаны бактериофаги против серраций и энтеробактеров, ведутся работы по созданию фаговых препаратов против Acinetobacter spp. и Helicobacter pylori [17]. Исторически сложилось так, что СССР занимал лидирующие позиции в области производства и применения лечебно-профилактических бактериофагов. Так, на филиалах ФГУП НПО «Микроген» Минздрава России в городах Уфа, Пермь и Нижний Новгород бактериофаги производятся с 1940-х годов. Препараты бактериофагов (производства ФГУП НПО «Микроген») постоянно обогащаются новыми фаговыми
клонами, что позволяет им соответствовать современным циркулирующим штаммам. Препараты бактериофагов являются высокостабильными и могут
храниться в течение длительного периода. Необходимо заметить, что только бактериофаги производства ФГУП НПО «Микроген» являются лекарственными средствами.
Успехи фаготерапии в разных отраслях медицины – это не наследие советской медицины, а доказанные научные явления, нашедшее широкое применение в практическом здравоохранении стран мира. Одним из самых перспективных направлений является изучение возможностей функционирования бактериофагов в биопленках, а следовательно, дальнейшие возможности профилактики и лечения инфекций, связанных с оказанием медицинской помощи.
Бактериофаг что это за лекарство
ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ, Москва
Бактериофаги (от слов “бактерия” и греч. phagos – пожирающий; БФ), или фаги, – специфические вирусы бактерий, вызывающие их лизис (разрушение клеток) или изменяющие их свойства. Они впервые были обнаружены микробиологами Ф. Туортом (1915) в Великобритании и Ф. д’Эрелем (1917) во Франции. Однако изучить их морфологию удалось только после изобретения электронного микроскопа.
Биология бактериофагов
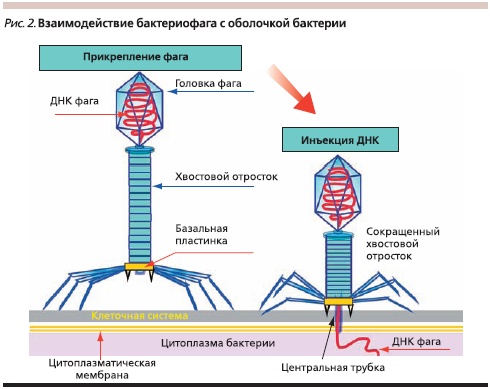
БФ состоят из белка – капсида, защищающего один тип нуклеиновой кислоты (ДНК или РНК, одно или двунитевые). Различают БФ с длинным отростком, имеющие сокращающийся или несокращающийся чехол, а также БФ с короткими отростками, аналогами отростков, без отростков и нитевидные (рис. 1, 2). Размер БФ колеблется от 20 до 800 нм (у нитевидных форм). БФ, имеющие форму сперматозоида, достигают до 200 нм длиной, состоят из хвостового отростка и головки икосаэдрического типа, содержащей нуклеиновую кислоту. Капсид головки и чехол хвостового отростка БФ состоят из полипептидных субъединиц, уложенных по икосаэдрическому (головка) или спиральному (отросток) типу симметрии. Хвостовой отросток имеет внутри полую трубку (стержень), через которую при инфицировании нуклеиновая кислота фага проходит из головки в бактерию. Чехол отростка заканчивается шестиугольной базальной пластинкой с шипами, от которых отходят фибриллы (нити). Базальная пластинка и хвостовые фибриллы участвуют в прикреплении БФ к бактериальной ячейке. Не все БФ имеют базальные пластинки и хвостовые фибриллы. В зависимости от жизненного цикла БФ могут быть вирулентными (литическими) или умеренными.
Вирулентные (литические) БФ для внедрения в бактерию адсорбируются на специфических рецепторах клетки, в т. ч. на липополисахариде, липопротеине, тейхоевых кислотах, протеинах, или даже на пилях. Специфичность рецепторов означает, что БФ может инфицировать только определенные бактерии. Попав в бактерию, БФ репродуцируется, формируя 200–500 фаговых частиц, и вызывает гибель бактерии. Это продуктивный (литический) тип взаимодействия. БФ с сокращающимся чехлом адсорбируются на клеточной стенке с помощью фибрилл хвостового отростка. Чехол хвостового отростка сокращается, и стержень с помощью ферментов (лизоцима) как бы просверливает оболочку клетки. Через канал трубки БФ нуклеиновая кислота инъецируется из головки в бактериальную клетку, а капсид БФ остается снаружи бактерии (рис. 2). Нуклеиновая кислота БФ направляет синтез его ферментов. При этом инактивируются ДНК и РНК хозяина. Нуклеиновая кислота БФ реплицируется и направляет синтез новых белков капсида. Происходят самосборка капсида вокруг фаговой нуклеиновой кислоты и формирование БФ, которые выходят из бактерии в результате ее лизиса, выталкивания или в некоторых случаях почкованием. Из бактерии высвобождается 200–1000 новых БФ, которые инфицируют другие бактериальные клетки.
Умеренные БФ взаимодействуют с бактериями по продуктивному или интегративному типу. Продуктивный тип умеренного фага, как и у вирулентных фагов, заканчивается лизисом бактерий. При интегративном типе ДНК умеренного фага встраивается в хромосому бактерии, реплицируется синхронно с бактериальным геномом, не вызывая ее лизиса (передается при делении бактерии). ДНК фага, встроенная в хромосому бактерии, называется профагом, а культура бактерий – лизогенной, сам процесс – лизогенией (от греч. lysis – разложение, genea – происхождение).
Хромосома умеренного фага лямбда, введенная в бактерию, вызывает либо лизис, либо лизогенизацию (проникшая в бактерию ДНК умеренного фага приобретает форму кольца и интегрирует в строго определенную область хромосомы). Ультрафиолетовое облучение индуцирует литический процесс с выходом фага. При лизогении фаги не образуются в результате “выключения” фаговых генов репрессором, кодируемым одним геном фага.
Профаги могут спонтанно или под действием индуцирующих агентов (ультрафиолетовые лучи, митомицин С и др.) дерепрессироваться, исключаться из хромосомы. Этот процесс заканчивается продукцией фагов (индукцией профага) и лизисом бактерий. Профаг придает бактерии новые свойства, что получило название фаговой конверсии (лат. conversio – превращение). Конвертироваться могут морфологические, культуральные, биохимические, антигенные и другие свойства бактерий. Например, наличие профага в холерном вибрионе обусловливает его способность продуцировать холерный экзотоксин.
БФ применяют для профилактики, лечения инфекций, а также для диагностики (например, для фаготипирования с целью выявления источника инфекции). Кроме того, БФ используют в генной инженерии в качестве векторов, переносящих участки ДНК; возможна также естественная передача генов между бактериями посредством трансдукции.
Фаготипирование – один из методов эпидемиологического маркирования. Применяется для выявления источника инфекции. Выделение бактерий одного фаговара от разных больных указывает на общий источник их заражения. При внутривидовой идентификации бактерий, т. е. при определении фаговара (фаготипа) бактерий с помощью фаготипирования, на чашку Петри с плотной питательной средой, засеянную чистой культурой возбудителя в виде “газона”, наносят капли различных диагностических типоспецифических фагов. Бактерии, чувствительные к фагу, лизируются (образуется стерильное пятно, “бляшка”, или т. н. негативная колония фага).
БФ – уникальное явление; они участвуют в разнообразных процессах:
Получение эффективных лечебно-профилактических БФ связано с тщательным и постоянным поиском штаммов с широким спектром (валентностью) действия на бактерии и высокой степенью их литической активности. Литическая активность и, следовательно, лечебная, а также профилактическая эффективность препаратов БФ зависят от видовой, инфравидовой принадлежности возбудителя, его рецепторных особенностей и факторов его микроокружения. Например, антитела и другие гуморальные белки могут заблокировать участки связывания бактерий с БФ, что исключает возможность парентерального введения последних. Кроме того, возможно быстрое формирование резистентности бактерий к применяемым БФ. Для получения лечебного эффекта при неблагоприятных бактериальных ассоциациях препараты БФ выпускают либо поливалентными, направленными против различных видов и сероваров одного возбудителя, либо комбинированными, содержащими БФ против различных видов возбудителя.
БФ не вызывают побочных реакций, не нарушают нормальную микрофлору. При дисбактериозе, нарушениях функций кишечника, обусловленных развитием местных воспалительных процессов, подавлении резидентной микрофлоры, происходит активация ряда условно-патогенных микроорганизмов и транзиторной микрофлоры. Эти обстоятельства поднимают значимость селективной деконтаминации, проводимой с помощью антибиотиков направленного действия и литических БФ.
БФ, обладая специфичностью действия против определенных возбудителей острых кишечных инфекций, могут также вносить вклад в развитие оральной толерантности. Известно, что организм человека проявляет пероральную (региональную) толерантность к собственной нормальной микрофлоре. Эта толерантность обусловлена блокадой активации сигнальных рецепторов (например, толл-подобных рецепторов – TLR и др.) к компонентам микрофлоры человека и активностью регуляторных T-лимфоцитов (Treg), которых в свою очередь активируют NKT-клетки (natural killer T cells). Компоненты (паттерны) БФ и разрушенных ими бактерий могут активировать определенные сигнальные рецепторы клеток организма, стимулирующие синтез антимикробных пептидов, подавляющих развитие наиболее агрессивных микробов (рис. 3). Срыв оральной толерантности влечет развитие различных нарушений, в т. ч. хронического гастрита, болезни Крона, неспецифического язвенного колита, некротизирующего энтероколита у детей, язвенной болезни желудка и двенадцатиперстной кишки.
Препараты БФ хранят при температуре 2–10 °С в сухом темном месте. БФ чувствительны к ультрафиолетовым лучам; даже их непродолжительное пребывание на свету приводит к утрате литической активности. Для защиты БФ от действия желудочного сока их выпускают в капсулах или таблетках, покрытых кислотоустойчивой оболочкой. Материалом защитного покрытия является нетоксичная целлюлоза, эстерифицированная уксусной и фталевой кислотами, образующая гладкую прозрачную пленку. Для детей из-за проблем проглатывания таблеток используют пектиновое покрытие. Пектин, обволакивая БФ, защищает их от разрушающего действия желудочного сока.
Нормализация микрофлоры, возможное участие БФ в поддержании колонизационной резистентности и оральной толерантности обеспечивают стабилизацию гуморального и клеточного звеньев иммунитета. Изредка применение БФ совпадает с ухудшением качества стула из-за массовой гибели чувствительных к нему бактерий. В этом случае для уменьшения интоксикации целесообразно назначать на ночь энтеросорбент – не ранее 3–4 часов после последнего приема БФ.
Препараты бактериофагов против возбудителей кишечных инфекций
Интести-бактериофаг жидкий содержит стерильные фильтраты фаголизатов шигелл (S. flexneri сероваров 1, 2, 3, 4, 6 и S. sonnei), сальмонелл (S. paratyphiA, S. paratyphiB, S. typhimurium, S. choleraesuis, S. infantis, S. oranienburg, S. enteritidis), энтеропатогенных кишечных палочек наиболее этиологически значимых сероваров (Escherichia coli О111, О55, О26, О125, О119, О128, О18, О44, О25, О20), протея (вульгарис и мирабилис), стафилококков, энтерококков и синегнойной палочки (Pseudomonas aeraginosa). Интести-бактериофаг (Bacteriophagum intestinalis fluidum) представляет собой прозрачную жидкость желтого цвета различной интенсивности.
Препарат предназначен для лечения и профилактики заболеваний желудочно-кишечного тракта, вызванных вышеуказанными бактериями, их сочетанием (в т. ч. бактериальной дизентерии, сальмонеллеза, брюшного тифа, паратифа, дисбактериоза, энтероколита, колита, диспепсии). Его назначают в остром периоде болезни: монотерапия при легких и стертых формах, при бактериовыделении; комбинированная терапия с другими антибактериальными средствами (при среднетяжелом течении) или иммуномодуляторами (при затянувшемся бактериовыделении). Залогом эффективности использования интести-бактериофага является определение фагочувствительности возбудителя и раннее применение препарата, который назначают перорально или ректально при помощи клизмы. Перорально интести-бактериофаг назначают 3–4 раза в сутки натощак за 1,0–1,5 часа до еды в течение 7–10 дней и в разовой дозе: детям до 6 месяцев – 5–10 мл, 6–12 месяцев – 10–15 мл, 1–3 года – 15–20 мл, старше 3 лет – 20 – 40 мл (см. таблицу). Для детей первых месяцев жизни назначенный препарат в первые двое суток разводят кипяченой водой в 2 раза. Если побочные осложнения отсутствуют (срыгивания, высыпания на коже), препарат назначают неразведенным. Перед приемом интести-бактериофага детям старше 3 лет и взрослым назначают раствор питьевой соды (0,5 чайной ложки на 0,5 стакана воды) или щелочную минеральную воду. В отсутствие колитического синдрома препарат назначают ректально 1 раз в день после опорожнения кишечника.
Бактериофаг дизентерийный поливалентный (в таблетках с кислотоустойчивым покрытием и в свечах) содержит стерильные фильтраты фаголизатов шигелл (S. flexneri и S. sonnei). Применяют с 6-месячного возраста для лечения и профилактики бактериальной дизентерии. Для лечения его применяют перорально 3 раза в сутки за час до еды в течение 5–7 дней и в разовой дозе: для детей от 6 месяцев до 3 лет – по 1 таблетке, 3–8 лет – по 1–2 таблетки, старше 8 лет – 2–3 таблетки. При слабовыраженном колитическом синдроме и в период реконвалесценции третий прием БФ внутрь можно заменить его ректальным применением: с 6 месяцев до 3 лет – 20–40 мл, с 3 до 8 лет – 40–60 мл, старше 8 лет – 60–80 мл.
С профилактической целью рекомендуют ежедневный прием препарата в зависимости от возраста: по 10–40 мл или 1–2 таблетки.
Бактериофаг сальмонеллезный групп A, B, C, D, E в таблетках с кислотоустойчивым покрытием, в свечах, жидкий содержит стерильные фильтраты фаголизатов сальмонелл (S. paratyphi A, S. paratyphi B, S. typhimurium, S. heidelberg, S. newport, S. choleraesuis, S. oranienburg, S. infantis, S. dublin, S. enteritidis, S. anatum, S. newlands). Для лечения его применяют перорально 3 раза в день за час до еды в течение 7–10 дней и в разовой дозе: для детей 6–12 месяцев – по 0,5 таблетки; 1–3 лет – по 0,5–1,0; 3–8 лет – по 1,0; старше 8 лет – по 2 таблетке. Третий пероральный прием можно заменить ректальным введением препарата. С профилактической целью БФ назначают детям по 1 таблетке и взрослым по 2 таблетке 2 раза в неделю.
Бактериофаг брюшнотифозный в таблетках с кислотоустойчивым покрытием содержит стерильный фильтрат фаголизата сальмонелл брюшного тифа (S. typhi). Препарат назначают для профилактики брюшного тифа внутрь за час до еды детям от 6 месяцев до 3 лет по 1 таблетке, а старше 3 лет и взрослым – по 2 таблетке 1 раз в 3 дня или каждый день до выздоровления.
Бактериофаг колипротейный жидкий содержит стерильные фильтраты фаголизатов энтеропатогенных (диареегенных) кишечных палочек (Escherichia coli наиболее распространенных серологических групп O20, O26, O33, O44, O55, O111, O119, O26, O124, O125, O127, O151), Proteusvulgarisи Proteusmirabilis. Препарат предназначен для лечения и профилактики заболеваний, вызванных вышеуказанными бактериями, а также дисбактериоза.
Сфера применения других препаратов бактериофагов многообразна; они используются как для местного применения (“раневые” бактериофаги), так и для приема перорально или ректально, в т. ч. в зависимости от формы выпуска:
В заключение следует отметить, что БФ и препараты БФ характеризуются многими положительными сторонами, они:
Информация об авторах:
Быков Анатолий Сергеевич – доктор медицинских наук, профессор кафедры микробиологии,вирусологии и иммунологии ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ.
Тел. 8 (495) 629-75-79, e-mail: bykov@imail.ru;
Быков Сергей Анатольевич – кандидат медицинских наук, ассистент кафедры клиническойиммунологии и аллергологии ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ.
Литература
1. Атлас по медицинской микробиологии, вирусологии и иммунологии / 2-е изд. Под ред. А.С. Быкова, А.А. Воробьева, В.В. Зверева. М., 2008. C. 272.
2. Дарбеева О.С., Жиленков Е.Л. Бактериофаги. Общая и санитарная микробиология с техникой микробиологических исследований: учебное пособие / Под ред. А.С. Лабинской, Л.П. Блинковой, А.С. Ещиной. М., 2004. C. 576.
3. Урсова Н.И., Минухина А.М. Бактериофаги. Клинико-иммунологическая эффективность иммунобиологических препаратов / Под. ред. М.П. Костинова, Н.В. Медуницина. М., 2008. C. 256.
 Читайте также:
Читайте также: