Длительный прием дексаметазона при опухоли мозга
Материалы конгрессов и конференций
X РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ЛУЧЕВАЯ ТЕРАПИЯ В КОМБИНИРОВАННОМ И КОМПЛЕКСНОМ ЛЕЧЕНИИ МЕТАСТАЗОВ
В ГОЛОВНОЙ МОЗГ: ОСНОВНЫЕ ЭТАПЫ, ПЕРСПЕКТИВЫ
З.П. Михина, С.И. Ткачев, О.П. Трофимова, В.С. Данилова, О.П. Извекова,
В.А. Горбунова, М.Б Бычков, Р.Б. Карахан, В.Б. Крат
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Метастатическое поражение головного мозга – серьезное осложнение течения опухолевого процесса, которое отмечается примерно у 50% онкологических больных и чаще всего встречается при раке легкого (34–66%), молочной железы (10–33%), почки, колоректальном раке, меланоме. Пик метастазов приходится на возрастную группу 55-65 лет. В детском возрасте метастазы в мозг возникают чаще при саркоме Юинга, рабдомиосаркоме, нейробластоме и остеогенной саркоме (1, 2).
При подозрении или выявлении метастазов в головной мозг должно проводиться полное общее обследование, и оно особенно показано пациентам с поражением мозга без выявленной первичной опухоли и больным с известным первичным диагнозом рака, у которых была некоторое время ремиссия. Начальная оценка состояния больного с поражением ЦНС должна проводиться с использованием шкалы Карновского или системы ВОЗ. Обе системы позволяют количественно определить функциональное состояние больного, прогнозировать качество и время жизни, определять объем обследования.
Клинический осмотр больного должен включать тщательную пальпацию всех периферических лимфатических узлов, щитовидной железы, молочных желез, выслушивание легких, обследование брюшной и тазовой области, включая яички, ректальное исследование, осмотр всей кожи для выявления меланомы. Следует выяснить жалобы на боли в костях, потому что метастазы в кости и мозг нередко встречаются вместе.
Тщательная неврологическая оценка часто показывает дефициты, которые пациент не сознавал, особенно локальную слабость и умственные изменения. Следует исследовать зрение, которое отражает кортикальную функцию и внутричерепное давление. До 25% больных с метастазами в мозг имеют отек диска зрительного нерва, изолированный паралич VI (отводящего) нерва может быть неправильно истолкован как локальный симптом, хотя он отражает внутричерепную гипертензию.
При подозрении или установления диагноза метастаза в мозг у онкологического больного следует начать терапию с учетом степени тяжести неврологических симптомов. При выраженном внутричерепном давлении с признаками, предполагающими наличие вклинения мозга, или при эпилептическом состоянии показан маннитол 1 г/кг внутривенно и дексаметазон от 32 до 64 мг внутривенно струйно. Поддерживающие дозы маннитола (0.5-2 г/кг) и дексаметазона (4-10 мг в/в) вводятся, разделенные на 4 дозы. При эпилептическом статусе последовательно вводятся противосудорожные препараты: лоразепам от 1 до 4 мг в/в, далее фосфенитоин 20 мг/кг, в/в, фенобарбитал, пропофол, вплоть до общей анестезии, если нет стойкого эффекта.
Дексаметазон – глюкокортикоид, наиболее часто используемый для уменьшения отека мозга. Уменьшение отека с последующим клиническим улучшением обычно наблюдается в пределах 1-2 дней. Стандартный подход у больных с симптомами заключается в подведении высокой начальной дозы, от 16 до 32 мг в/в или в/м с последующим снижением дозы до 4-8 мг в/в или per os. При наступлении устойчивого клинического улучшения следует начать медленное снижение доза дексаметазона до самой низкой эффективной, например, по 2 мг каждые 5-7 дней. Следует не забывать, что длительное использование кортикостероидов связано с высокой частотой побочных эффектов, таких как кандидоз полости рта, повышение кислотности желудка, язвенная болезнь, условно-патогенные инфекционные процессы, отсутствие толерантности к глюкозе или свершившийся диабет, артериальная гипертензия, кушингоидные изменения, нарушения сна, личности, остеопороз, аваскулярный некроз, риск тромбоза глубоких вен. Не рекомендуется использовать кортикостероиды у пациентов с отсутствием или минимальными симптомами (1, 2).
Облучение всего головного мозга в самостоятельном варианте используется у больных с милиарной диссеминацией метастазов, с множественным или ограниченным числом очагов (2-4), но при неблагоприятном прогнозе. Весь мозг облучается при метастазах лимфосарком, мелкоклеточного рака легкого (МРЛ), герминогенных опухолей, при которых хирургическое лечение проводить нецелесообразно, но лучевая терапия обязательно дополняется химиотерапией, к которой опухоли данных локализаций высоко чувствительны.
WBRT проводится с профилактической целью после хирургического удаления одиночных метастазов или при МРЛ, аденокарциноме легкого, лейкозах, учитывая высокий потенциал интракраниального метастазирования при указанных формах первичной опухоли.
Параллельно с лучевой терапией у больных с одиночными метастазами использовался хирургический метод в самостоятельном варианте. При числе метастазов 2-3 хирургическое лечение считалось противопоказанным (3).
После представленных итогов возникли вопросы относительно роли лучевой терапии: необходима ли вообще лучевая терапия после «полной» резекции одиночного метастаза, должна ли послеоперационная лучевая терапия быть локальной или ее следует проводить в виде WBRT.
Ретроспективные исследования, которые изучали роль послеоперационной лучевой терапии при одном метастазе, не сумели ответить на этот вопрос из-за противоречивых результатов. Четко отмечалась меньшая частота рецидива в зоне операции и в других отделах мозга при использовании WBRT, не было единого мнения о пользе для выживаемости, оставалась высокая вероятность развития поздних лучевых повреждений мозга, снижающих качество жизни больных.
Patchell и соавт. опубликовали результаты рандомизированного исследования, определяющего важность включения WBRT. Больные в общем состоянии >70 баллов по шкале Карновского были рандомизированы после полного удаления единичного метастаза в головном мозге. Для увеличения эффекта и снижения возможного нейрокогнитивного ухудшения использовалась классическая лучевая терапия (СОД 50,4 Гр; РОД 1,8 Гр). Анализа данных показал достоверное уменьшение частоты рецидивов (18% против 70%) и причин смерти от неврологической болезни (14% против 44%) у больных с WBRT после хирургического удаления по сравнению с хирургией в самостоятельном варианте. Однако пользы для выживаемости или функциональной независимости больных отмечено не было. Авторы рекомендовали применять WBRT для уменьшения частоты локальных или новых метастазов в головном мозге и снижения вероятности смерти по неврологическим причинам.
WBRT обычно назначается всем пациентам после резекции 2-3 метастазов, даже, когда послеоперационные исследования (КТ и МРТ) не показывают наличие болезни. Высокая вероятность появления новых метастазов в мозге оправдывает применение WBRT после операции, не смотря на потенциальный риск постлучевых изменений. В настоящее время окончательное решение принимается с учетом полноты резекции очагов, чувствительности опухоли к облучению, наличия экстракраниальных метастазов и прогнозирования длительности выживания.
Оценка больших клинических материалов показала, что приблизительно 50% пациентов с метастазами в мозг умирают от неврологических причин (4). Было высказано предположение, что если подводить к метастазам бoльшие дозы, выживаемость может быть увеличена. Были проверены стратегии по увеличению доз облучения с использованием ускоренной гиперфракционной радиотерапии, брахитерапии, фракционированной стереотаксической радиохирургии и стереотаксической радиохирургии (SRS) в виде одной дозы. В последнем десятилетии наиболее активно использовалась SRS с подведением к опухоли всей дозы за один сеанс с минимальной дозой в нормальной ткани мозга.
SRS радиохирургия использует множество мелких, хорошо коллимированых пучков ионизирующего излучения линейного ускорителя или «гамма-ножа» для уничтожения внутричерепных очагов. Анализ 40 нерандомизированных исследований, включавших 2,697 пациентов и 3,922 метастатических очагов, выявил среднюю частоту непосредственного эффекта в 81% случае при использовании SRS.
Активное внедрение в ряде стран SRS для лечения интракраниальных метастазов позволило высказать сомнения в целесообразности использовании WBRT у пациентов с несколькими метастазами.
В настоящее время продолжаются или уже опубликованы предварительные результаты ряда рандомизированных исследований, касающихся более детальной и ясной оценки роли WBRT в сочетании с радиохирургией. Исследование Aoyama и соавт. (5) было проведено в Японии с участием больных с 1-4 метастазами, состоянием ≥70 баллов по шкале Карновского, размерами метастазов по МРТ ≤3 см, получивших радиохирургию в сочетании или без WBRT. Проведено сравнение в группах в зависимости от числа метастазов (1 против 2-4), вида первичной опухоли (легкое против других опухолей), состояния экстракраниальной болезни (есть – нет). WBRT проводилась по схеме 30 Гр за 10 фракций, дозы SRS уменьшались на 30-40% на краях метастазов в группе WBRT+SRS. Первично изучалась выживаемость, вторично – сохранение системных функций (KRS ≥70%), сохранение неврологического статуса (RTOG, стадия ≤2), время, свободное от новых интракраниальных метастазов, поздние неблагоприятные последствия, причины смерти по определению Patchell, частота локального контроля в области поражения.
Начиная с 80 гг., с внедрением новых диагностических методов (КТ, МРТ), основное внимание уделялось совершенствованию методов диагностики внутримозговых метастазов, определению прогностических групп, разработке методов лечения с учетом прогноза. На основе изучения прогностических факторов 1176 больных исследователи RTOG, используя статистический метод, названный рекурсивным парциальным анализом (RPA), выделили три подгруппы (классы). Рекурсивный класс I включал пациентов до 65 лет, в общем состоянии по шкале Карновского ≥70%, излеченной или контролируемой основной опухолью и отсутствием внечерепных метастазов. Эта группа составляла меньше 20% от общей численности пациентов с метастазами в мозг. Класс III включал пациентов в общем состоянии по шкале Карновского 90% пациентов с метастазами в мозг до лучевой терапии всего черепа имелиcь нарушения познавательной функции, которые в значительной степени зависели от объема опухоли, но не от числа метастазов, и исходный уровень этой функции был значительным прогностическим признаком выживаемости, помимо обычных используемых показателей прогноза.
Поздние изменения мозга после WBRT имеют особый интерес, поскольку они включают возможность появления деменции. Важно, что деменции, частота которой с течение первого года после WBRT составляла 11%, была выявлена только у пациентов, леченных большими ежедневными фракциями (больше 3 Гр). В то же время приведены веские доводы в пользу того, что лечение крупными фракциями позволяет быстрее получить эффект с улучшением неврологических симптомов и уменьшить время приема поддерживающих лекарств. Кроме того, больные с неблагоприятным прогнозом имеют небольшую выживаемость, и у них не успевает развиться такое серьезное осложнение как деменция. Однако выживаемость у части больных растет, и при хорошем прогнозе больные могут дожить до поздних повреждений, что заставляет изучать факторы, определяющие позднюю нейротоксичность.
Таблица 2.
Лучевые осложнения после облучения черепа.
| Фаза | Признаки | Время появления | Вероятная причина | Лечение |
|---|---|---|---|---|
| Острая | Усталость, головная боль, тошнота, алопеция, эритема кожи черепа, обострение локального неврологического дефицита | Первые 2 недели лучевой терапии | Отек | Кортикостероиды |
| Ранняя отсроченная | Усталость, сонливость, головная боль → познавательная дисфункция → замедленная обработка информации → снижение внимания → неспособность обучения; нарушение памяти → исполнительная дисфункция → нарушение моторной ловкости | 1-6 мес. после лучевой терапии | Демиелинизация | Кортикостероиды, возможно спонтанное улучшение |
| Поздние нарушения | Деменция, изменение личности, лейкоэнцефалопатия, судороги, повышение черепно-мозгового давления, атаксия, дизартрия, несдержанность, оптическая невропатия, индуцированные опухоли | От 6 мес. до нескольких лет после лучевой терапии | Ангиопатия, демиелинизация, некроз | Кортикостероиды, антикоагулянты, вит. Е |
В заключение следует отметить, что решение клинической проблемы должно основываться на оценке прогностических показателей. Это позволяет разделить больных на благоприятные, промежуточные, и неблагоприятные категории и предложить методы лечения (резекцию, облучение, радиохирургию, химиотерапию), которые разработаны в конкретном учреждении и доступны больным.
В странах с большим опытом применения стереотаксической радиохирургии до конца не определено место метода в лечении метастазов: должна ли радиохирургия использоваться в сочетании с WBRT для предупреждения рецидивов и новых метастазов или во время рецидива после WBRT, или использоваться самостоятельно, резервируя WBRT для облучения обширных мозговых рецидивов. В России только набирается опыт лечения с использованием гамма-ножа, нет пока исследований по обоснованному сочетанию радиохирургии с различными методами лечения. В связи с этим общее облучение мозга проводится практически всем больным (после операции, самостоятельно), и при показаниях добавляется локальное облучение отдельных очагов на линейных ускорителях. Дальнейшие исследования должны обязательно включать оценку реакций на облучение всего мозга с изучением познавательной функции путем анкетирования больных с различными первичными новообразованиями, имеющими шанс прожить более 3 мес.
1. Evaluation and management of brain metastases. /Mehta M., Tremont-Lukats I.W Educational Lection of the 38th ASCO Annual Meeting 18-21 May, 2002, Orlando, FL, USA — 2002. — P.375—82.
2. Treatment of brain metastases. / Patchell R.A. Educational Lection of the 38th ASCO Annual Meeting 18-21 May, 2002, Orlando, FL, USA — 2002. — P. 383—91.
3. Management of cerebral metastases: the role of surgery/ Lang F.F., Wildrick D.M., Sawaya R. — Cancer Control. — 1998, Mar. — Vol. 5. — No. 2. — P.124—9.
4. Focal management of single or multiple brain metastasis without whole-brain radiotherapy. / Kleinberg L.R Educational Lection of the 42nd ASCO Annual Meeting, 2006 — P. 93—9.
5. Interim report of the JROSG99-1 multi-institutional randomized trial, comparing radiosurgery alone vs. radiosurgery plus whole brain irradiation for 1-4 brain metastases. /Aoyama H, Shirato H, Nakagawa K, et al. J Clin Oncol.—2004—22 (suppl; abstr 1506)14s.
6. Phase II trial of radiosurgery for one to three newly diagnosed brain metastases from renal cell carcinoma, melanoma, and sarcoma. / Manon R, O’Neill A, Knisely J, et al. An Eastern Cooperative Oncology Group study (E 6397). J Clin Oncol.— 2005. —23. — P. 8870-8876.
7. Clinical practice guideline on the optimal radiotherapeutic management of brain metastases/ Tsao M.N., Lloyd N.S., Wong R.K.S. and the Supportive Care Guidelines Group of Cancer Care Ontario’s Program in Evidence-based Care. — BMC Cancer. — 2005. — Vol. 5 — P.34.
8. Neurocognitive sequelae оf whole-brain radiotherapy in patients with brain metastase. /Jeffrey S. Educational Lection of the 42nd ASCO Annual Meeting, 2006 — P.100—4.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕКАРСТВЕННОМУ ЛЕЧЕНИЮ ПЕРВИЧНЫХ ОПУХОЛЕЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Коллектив авторов: Кобяков Г. Л., Бекяшев А.Х., Голанов А.В., Коновалов А.Н., Насхлеташвили Д.Р., Потапов А.А., Рзаев Д.А., Рыжова М.В., Смолин А.В., Трунин Ю.Ю., Улитин А.Ю.
DOI: 10.18 027/2224–5057–2018–8–3s2–83–99
Ключевые слова: опухоли центральной нервной системы, коделеция 1p/19q, IDH-1 мутация, метилирование MGMT, первичная лимфома ЦНС, эпендимома, герминома ЦНС, медуллобластома
Цитирование: Кобяков Г. Л., Бекяшев А. Х., Голанов А. В., Коновалов А. Н., Насхлеташвили Д. Р., Потапов А. А. и соавт. Практические рекомендации по лекарственному лечению первичных опухолей центральной нервной системы // Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 83–99
ISSN 2587-6813 (электронное издание)
Злокачественные опухоли. Том 8, #3, 2018, спецвыпуск 2
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
TNM классификация в отношении первичных опухолей центральной нервной системы не применяется. Основным классификационным критерием, определяющим тактику лечения, является морфологическая классификация; рекомендуется использование классификации ВОЗ опухолей ЦНС 2016 г. (см. раздел 2.2. «Морфологический диагноз»).
2. ДИАГНОСТИКА
2.1. Обследование
сбор анамнеза, оценка неврологического и соматического статуса, а также функционального статуса по шкале Карновского;
МРТ головного и/или спинного мозга:
МРТ головного мозга в трёх проекциях в стандартных режимах (Т1, Т2, FLAIR, Т1 + контраст);
в случаях, когда МРТ не может быть выполнена (например, при наличии кардиостимуляторов или ферромагнитных имплантов), выполняется КТ с контрастным усилением и без него;
анализы: клинический, биохимический крови, общий анализ мочи, анализ свёртывающей системы крови, ВИЧ, гепатиты;
при показаниях (опухоль пинеальной области) — анализ крови на опухолевые маркёры АФП, β-ХГЧ, ЛДГ;
УЗИ вен нижних конечностей;
консультация офтальмолога (оценка глазодвигательных, зрительных нарушений, а также признаков внутричерепной гипертензии на глазном дне);
в процессе лечения регулярно должен проводиться контроль эффективности: МРТ с контрастным усилением и без него в трёх проекциях (или в одной проекции с режимом SPGR с последующей реконструкцией) и в стандартных режимах (Т1, Т2, FLAIR, Т1 + контраст). Частота выполнения зависит от гистологического диагноза и этапа лечения (см. Алгоритмы лечения). Оценка динамики опухоли проводится согласно критериям RANO.
функциональная МРТ двигательных и речевых зон; и МР-трактография; МР-ангиография, МР-спектроскопия, МР-перфузия;
при подозрении на опухоль с риском диссеминации по оболочкам головного и спинного мозга (медуллобластома, пинеобластома, первичные герминативно-клеточные опухоли ЦНС и пр.) выполняется МРТ всего спинного мозга с контрастным усилением;
ПЭТ/КТ головного мозга с аминокислотами (метионином, тирозином);
КТ головного мозга выполняется также в дополнение к МРТ в случаях костных опухолей, при показаниях — КТ-перфузия, КТ-ангиография;
консультация нейрохирурга (в специализированном нейрохирургическом центре или отделении), при необходимости — в федеральном нейрохирургическом центре;
консилиум с участием нейрохирурга, рентгенолога, радиолога, онколога.
2.2. Морфологический диагноз
Во всех случаях следует стремиться к гистологической верификации опухоли; диагноз формулируется в соответствии с классификацией ВОЗ опухолей ЦНС 2016 г. В дополнение к основному диагнозу указывается степень злокачественности опухоли G (от I до IV ст.).
У пациентов с глиальными опухолями определяются также мутация генов IDH‑1,2, метилирование гена MGMT, коделеция 1p/19q. При отсутствии технической возможности определения данных мутаций, используется аббревиатура «NOS».
Морфологическая верификация может не проводиться, если получение диагностического материала сопряжено с высоким риском осложнений, например, при диффузных опухолях ствола головного мозга.
3. ЛЕЧЕНИЕ
Стандартными методами лечения первичных опухолей ЦНС являются хирургический, лучевой и лекарственный.
3.1. Хирургическое лечение
Хирургическое удаление производится для максимально возможного уменьшения объёма опухоли с целью разрешения внутричерепной гипертензии, уменьшения неврологического дефицита и получения достаточного количества морфологического материала. В послеоперационном периоде после удаления опухоли обязательно выполнение КТ с контрастированием и без него, а также выполнение МРТ с контрастным усилением и без него в течение 24–72 часов.
СТБ или навигационная биопсия должны быть использованы в случаях, когда хирургическое удаление невозможно или нецелесообразно, а также при подозрении на первичную лимфому ЦНС.
В исключительных случаях, например, у пациентов пожилого возраста, пациентов с грубой неврологической симптоматикой, при расположении опухоли в жизненно важных структурах (в том числе в стволе мозга) ХТ и/или ЛТ могут применяться на основании данных нейровизуализации и клинической картины по решению консилиума.
3.2. Лучевая терапия
Дистанционные методы ЛТ являются основным компонентом лечения большинства пациентов с опухолями ЦНС.
Лучевое лечение используется у первичных больных после хирургического удаления/биопсии опухоли, а также при возникновении рецидива/продолженного роста опухоли. ЛТ может проводиться как на область опухоли (на остаточную опухоль или на ложе опухоли), так и на пути возможного метастазирования (например — краниоспинальное облучение в лечении эпендимомы). Золотым стандартом лучевого лечения является применение стереотаксической техники облучения.
3.2.1. Режимы фракционирования
Режим стандартного фракционирования: 1 сеанс в день РОД 1,8–2,2 Гр до СОД 24–70 Гр; используется у пациентов с крупными и/или диффузно-растущими опухолям и различной гистологической природы (в основном — глиомы G I–IV), а также при облучении путей возможного метастазирования опухоли (краниоспинальное облучение).
Радиохирургическое лечение — одномоментное подведение высокой дозы (12 Гр и более) с использованием стереотаксической техники. Используется у пациентов с небольшими опухолями (до 3 см в максимальном измерении), имеющими чёткие границы (пилоидные астроцитомы, эпендимомы, менингиомы, невриномы, аденомы гипофиза, краниофарингиомы и пр.).
Режим гипофрационирования (РОД ≥ 2,5 Гр, СОД ≥ 15 Гр) используется у пациентов с опухолями, имеющими чёткие границы, либо с минимальной зоной возможной инфильтрации тканей (до 3–5 мм), а также у пациентов с образованиями более 3 см и/или с опухолями, располагающимися вблизи критических структур мозга.
При лечении злокачественных опухолей (G III–IV) ЛТ следует начинать в сроки от 2 до 6 нед. после операции, в ряде случаев в комбинации с ХТ (см. раздел «Химиотерапия»).
После ЛТ возможно возникновение постлучевых повреждений вещества головного мозга, в том числе лучевого некроза. Для дифференциации постлучевых осложнений и рецидива опухоли целесообразно использование дополнительного МРТ с контрастированием, ПЭТ головного мозга с метионином (тирозином), МР-спектроскопии, КТ-перфузии и др. В лечении лучевого некроза может использоваться бевацизумаб.
3.3. Лекарственная противоопухолевая терапия в комплексном лечении первичных опухолей ЦНС
Показания и выбор схемы противоопухолевой лекарственной терапии зависят от гистологического диагноза. Основные режимы ХТ первичных опухолей ЦНС приведены в табл. 1, 2, 3. В настоящем разделе представлены алгоритмы выбора тактики лечения в зависимости от нозологической группы.
3.3.1. Злокачественные глиомы
Подход к лечению зависит от степени злокачественности опухоли. Выделяют злокачественные (G III–IV) глиомы (анапластическая астроцитома, анапластическая олигодендроглиома, анапластическая олигоастроцитома, глиобластома, в том числе глиосаркома) и низкой степени злокачественности (G I–II), включающие в себя астроцитому, олигодендроглиому, олигоастроцитому, а также редкие типы опухолей — плеоморфную ксантоастроцитому, субэпендимарную гигантоклеточную астроцитому, пилоидную астроцитому.
МРТ признаками злокачественной глиомы являются гипоинтенсивная в Т1 режиме, гиперинтенсивная в режимах Т2 и FLAIR, сливающаяся с зоной перифокального отёка опухоль. Клинические признаки: короткий анамнез, быстрое нарастание симптомов, относительно редко наблюдается судорожный синдром. Если по данным МРТ нельзя исключить лимфому ЦНС, пациенту необходимо сначала выполнить СТБ.
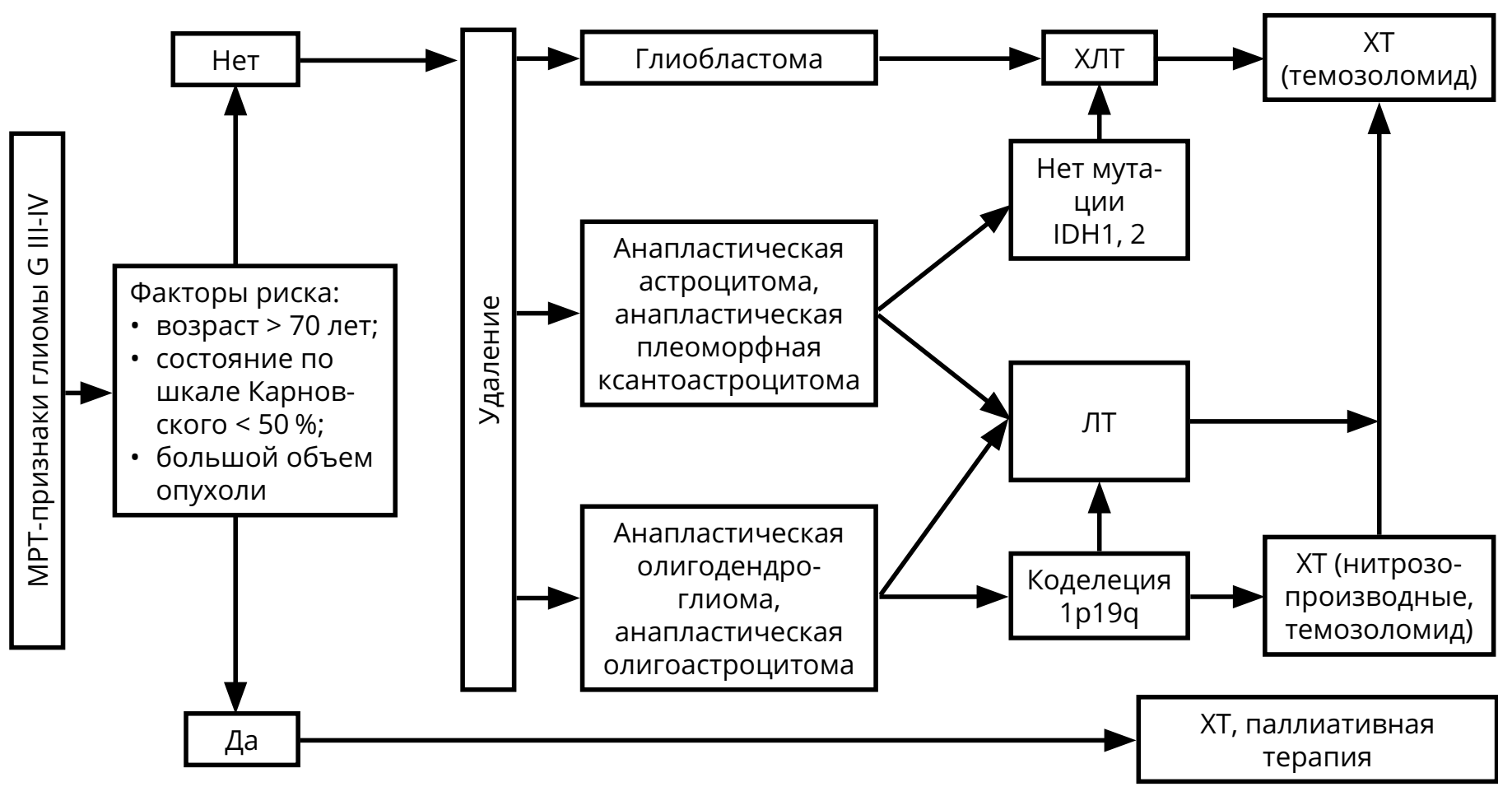
После хирургического вмешательства с верификацией диагноза астроцитарной глиомы G III–IV показано продолжение лечения в виде ЛТ и ХТ (рис. 1). Молекулярно-генетические факторы, определяющие прогноз — IDH-1,2 мутации, метилирование гена MGMT, коделеция 1p/19q (все — благоприятные).
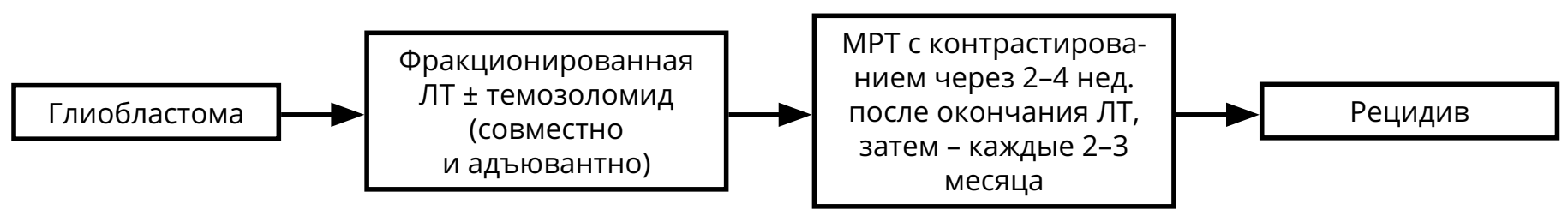
Для пациентов с глиобластомой режимом выбора послеоперационного лечения является ХЛТ с ежедневным приёмом темозоломида (75 мг/м 2 ) (в течение всего курса ЛТ — 30 фракций по 2 Гр на фракцию), с последующими 6–10 курсами темозоломида 5/23 (см. раздел 4).
Проведение ЛТ (30 фракций по 2 Гр на фракцию) показано для пациентов с анапластической астроцитомой, анапластической олигодендроглиомой, анапластической олигоастроцитомой.
При первом контроле после комбинированной ХЛТ глиомы (в течение 1 мес. после окончания ЛТ) можно наблюдать феномен псевдопрогрессии: увеличение контрастируемой части опухоли при отсутствии нарастания неврологических симптомов на фоне стабильных доз ГКС. В таком случае рекомендован МРТ-контроль через 1–3 мес. (то есть через 2–3 мес. после завершения ЛТ) с целью окончательной оценки динамики болезни.
ХТ (режим PCV или монотерапия ломустином или темозоломидом) должна быть назначена после ЛТ больным анапластической астроцитомой, анапластической олигодендроглиомой, анапластической олигоастроцитомой (см. раздел 4).
При коделеции 1p/19q у больных анапластической олигоастроцитомой и анапластической олигодендроглиомой в послеоперационном периоде могут быть назначены как ЛТ, так и ХТ (режим PCV или монотерапия темозоломидом 5/23). В случае полного ответа на химиотерапию ЛТ может быть отложена до рецидива заболевания.
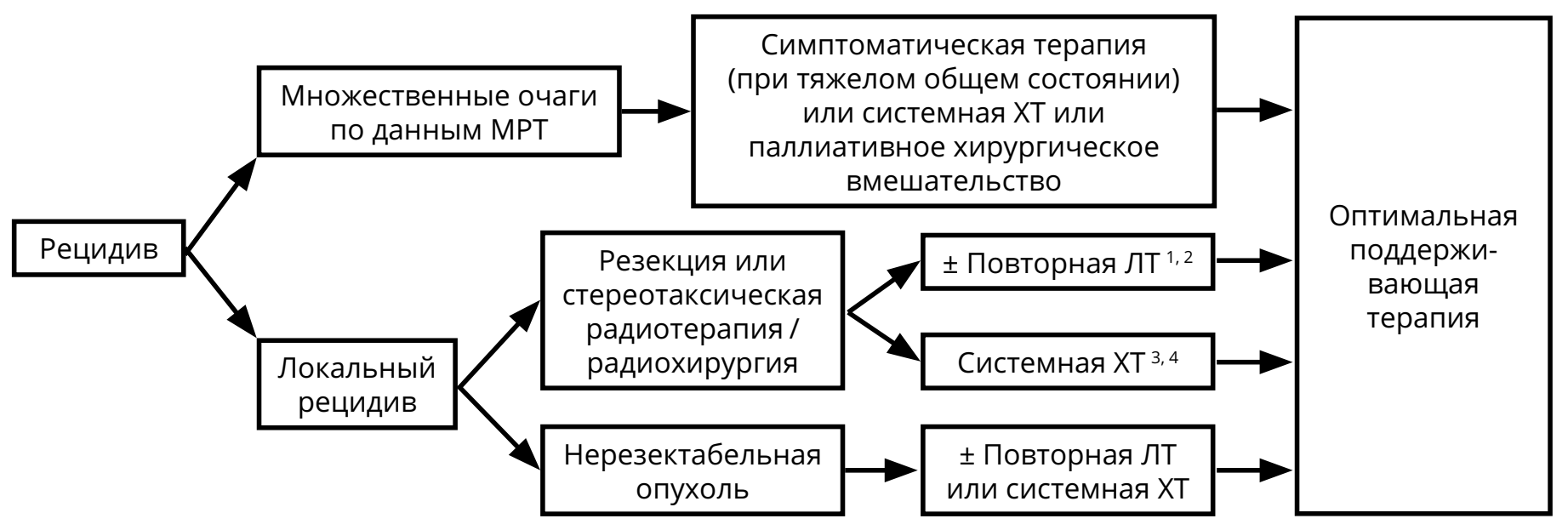
Методами лечения рецидивов глиом являются повторное хирургическое вмешательство, системная ХТ, повторная ЛТ и паллиативная терапия. Показания к назначению любого из этих методов лечения должны обсуждаться мультидисциплинарно. В некоторых случаях может быть предложена повторная ЛТ (если с момента предшествующей ЛТ прошло не менее 8 мес.). При небольших локальных рецидивах могут рассматриваться радиохирургические методики или гипофракционированная ЛТ.
2 Необходима МР-спектроскопия, МР-КТ перфузия, ПЭТ (с метионином) для исключения лучевого некроза, особенно, если интервал от первой ЛТ 18 мес.
3 При анапластической олигодендроглиоме и анапластической олигоастроцитоме предпочтительна ХТ.
4 Ответ после двух последовательных неэффективных режимов ХТ маловероятен.
В качестве ХТ рецидивов анапластических астроцитарных и олигодендроглиальных опухолей G III показано назначение темозоломида (если ранее не использовался или, если использовался, но был достаточно длительный — не менее 6 мес. — контроль болезни). Нитрозопроизводные могут также быть назначены, если они не использовались ранее. При олигодендроглиоме и анапластических олигоастроцитомах стратегия зависит от использованной ранее схемы лечения. В случае применения радиотерапии назначается ХТ PCV; если использовались радиотерапия и химиотерапия PCV, то предпочтение отдаётся ХТ темозоломидом. В случае первичной ХТ с использованием режима PCV, прежде всего, должна обсуждаться радиотерапия. Если радиотерапия не проводилась, то пациентам пожилого возраста, с обширным опухолевым поражением может быть предложена II линия ХТ (например, темозоломид после PCV).
3.3.2. Глиомы низкой степени злокачественности (G I–II)
3.3.2.1. Астроцитома, олигодендроглиома, олигоастроцитома G II
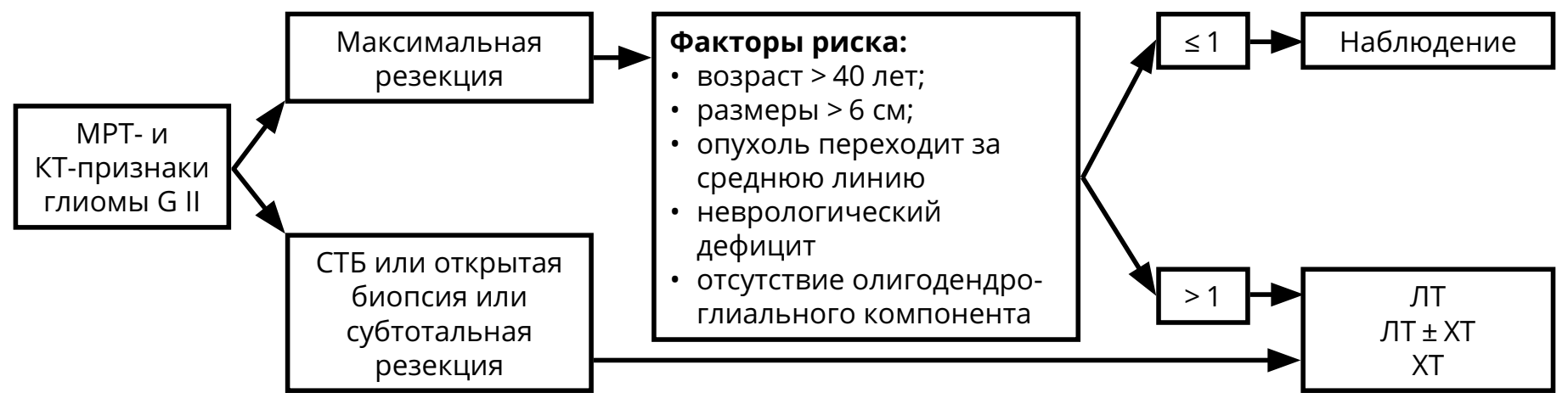
Предоперационный диагноз глиомы G II основан на МРТ-признаках (гиподенсивная в Т1 режиме, гиперденсивная в режимах Т2 и FLAIR, не накапливает контраст) и клинических проявлениях (длительный анамнез, часто — судорожный синдром, медленное нарастание симптомов). Для олигоденроглиомы и олигоастроцитомы характерно наличие кальцинатов на КТ. Послеоперационное лечение (ЛТ, ХТ) зависит от радикальности удаления и/или факторов риска (рис. 4). Коделеция 1p/19q и IDH-1,2‑мутации — прогностически благоприятные факторы.
В случае полной резекции опухоли и при наличии не более одного фактора риска показано наблюдение: МРТ 1 раз в 3–6 мес. или при нарастании симптомов (см. раздел 6 «Наблюдение»). При неполном удалении/биопсии опухоли или при наличии более одного фактора риска показано назначение ЛТ и/или ХТ.
Пациентам пожилого возраста (старше 70 лет) с обширными опухолями ЛТ может не проводиться (назначается монотерапия темозоломидом 5/23). Вопрос о назначение ЛТ и ХТ ослабленным пациентам (с низким индексом Карновского и/или с признаками внутричерепной гипертензии), большой распространённостью опухоли, решается индивидуально.
После окончания курса ЛТ должны быть назначены контрольные МРТ (через 2–4 нед. после окончания ЛТ, а затем каждые 2–3 месяца в течение 2–3 лет).
3.3.2.2. Плеоморфная ксантоастроцитома G II
Плеоморфная ксантоастроцитома на МРТ — как правило, кистозная, хорошо отграниченная от окружающего мозгового вещества опухоль, сóлидная часть которой интенсивно накапливает контраст и расположена асимметрично относительно кисты. Показано удаление опухоли. Адъювантная терапия не требуется. Следует указать, что в классификацию 2016 г. внесено понятие «анапластическая плеоморфная ксантоастроцитома G III». Лечение этой опухоли осуществляется по принципам лечения злокачественных глиом. Дополнительно определяется BRAF мутация (в случаях выявления может быть назначена терапия вемурафенибом или дабрафенибом).
3.3.2.3. Субэпендимарная гигантоклеточная астроцитома
Чаще всего является одним из проявлений туберозного склероза (болезни Бурневилля). На МРТ представлена солидной опухолью, расположенной чаще всего в проекции одного или обоих отверстий Монро, гиподенсивной в Т1‑режиме и интенсивно накапливающей контраст. На КТ характерно наличие симметричных кальцинатов в проекции зрительных бугров. Стандартом лечения этих опухолей является оптимальное (тотальное) удаление. Больным с диффузным поражением показано лечение эверолимусом.
3.3.2.4. Пилоидная астроцитома G I
Обычно встречается в детском возрасте и у молодых взрослых. Оптимальным методом лечения является хирургическое удаление (при условии операбельности опухоли). Обязательным является выполнение МРТ в послеоперационном периоде для оценки радикальности операции. В случае радикального удаления опухоли больному показано наблюдение. В случае остаточной опухоли показана ЛТ.
3.3.2.5. Глиоматоз головного мозга
Глиоматоз мозга — это диффузное поражение глиомой структур головного мозга (более 3‑х анатомических областей больших полушарий, обычно с переходом через мозолистое тело и с перивентрикулярным распространением). Показана верификация диагноза путём СТБ, так как от гистологического диагноза может зависеть выбор лечебной тактики (например, при олигодендроглиальных опухолях, как обычно, показано определение коделеции 1p/19q, при её выявлении — назначение ХТ на основе нитрозопроизводных). Могут рассматриваться три подхода: наблюдение (если у больного нет клинических симптомов заболевания), ХТ (PCV/ломустин/темозоломид) и ЛТ головного мозга в зависимости от клинической ситуации, данных нейровизуализации, морфологии, ИГХ и молекулярно-генетических маркёров и мнения специалистов.
3.3.2.6. Глиомы ствола головного мозга
При узловых формах опухолей ствола мозга, экзофитном характере роста, т.е. при МР-признаках полной или частичной отграниченности от структур ствола (например, при пилоидной астроцитоме) показано удаление опухоли (или открытая биопсия). Далее, в зависимости от гистологического диагноза, возраста и радикальности удаления назначаются ЛТ и/или ХТ. При диффузном характере роста опухолей ствола (например, при диффузной глиоме моста — «диффузной понтинной глиоме») показано использование ЛТ и ХТ без обязательной верификации. При ювенильных глиомах четверохолмной пластинки после разрешения гидроцефалии осуществляется регулярное клиническое и МРТ-наблюдение (в случае прогрессирования опухоли рассматривается вопрос об удалении с последующей ЛТ).
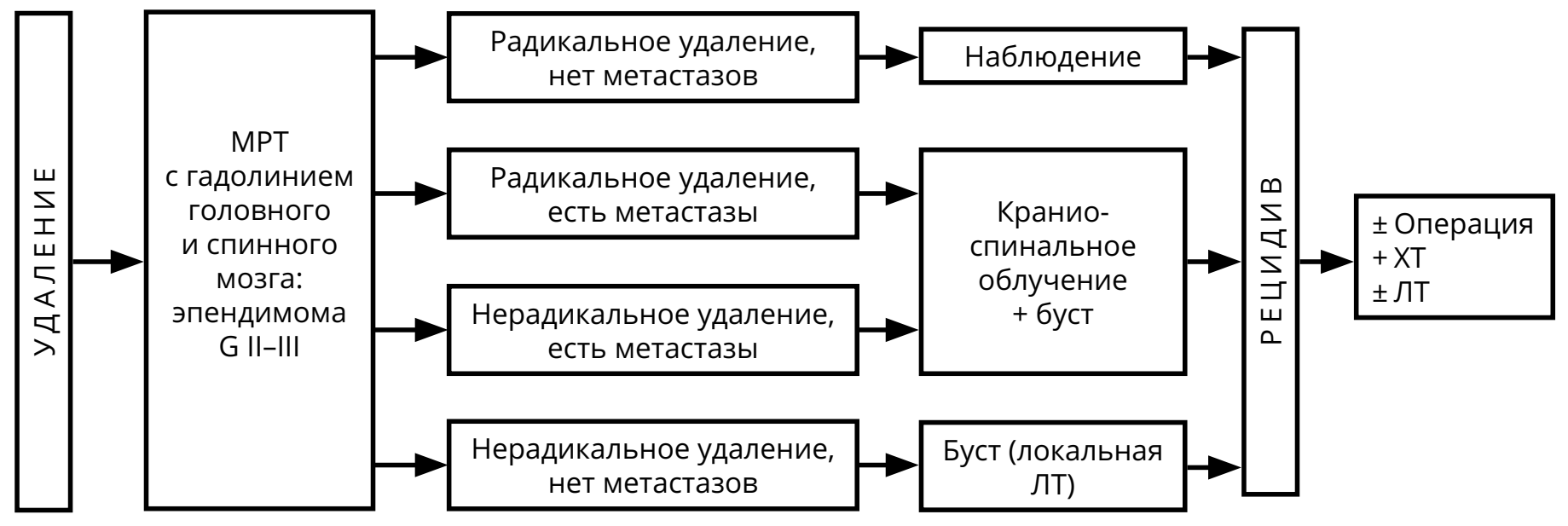
3.3.3. Эпендимомы
Редкие опухоли, возникающие из эпендимы головного мозга (чаще располагаются в пределах желудочковой системы, реже — экстравентрикулярно) или спинного мозга, примерно одинаково часто встречаются у детей и у взрослых. Приблизительно в половине случаев на КТ и МРТ выявляются признаки мелких кальцинатов. Хорошо накапливают контрастное вещество, чаще — негомогенно. По классификации ВОЗ 2016 г. выделяют эпендимому (G II) и анапластическую эпендимому (G III).
Ведущую роль в лечении эпендимомы играет хирургическое удаление опухоли. Поэтому при выполнении операции следует стремиться к максимальной резекции опухоли. При установлении гистологического диагноза эпендимомы или анапластической эпендимомы показано проведение МРТ головного и спинного мозга с контрастированием (с целью определения радикальности операции и выявления возможных спинальных метастазов) и исследование спинномозговой жидкости на опухолевые клетки.
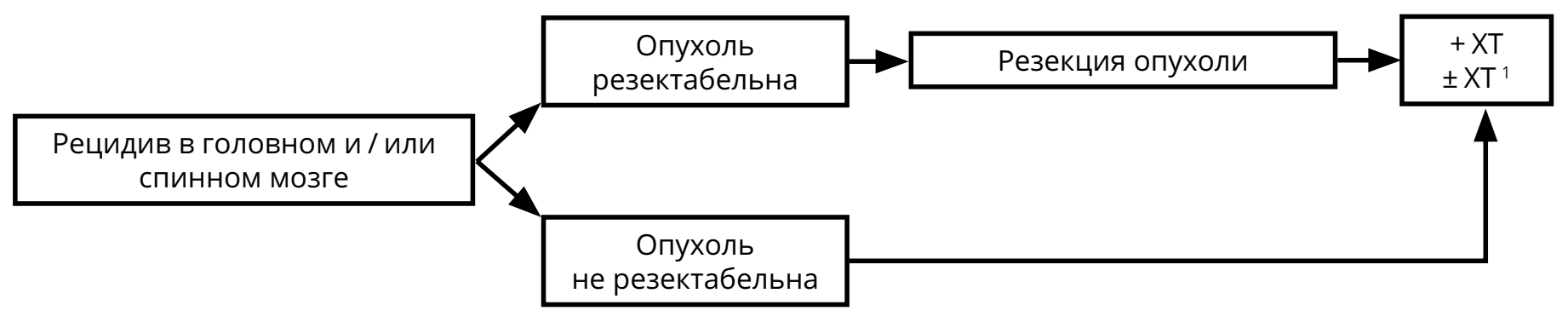
В случае выполнения максимальной резекции эпендимомы рекомендовано наблюдение (при отсутствии признаков метастазирования в виде наличия клеток опухоли в ликворе или спинальных метастазов на МРТ спинного мозга с контрастом). При невозможности радикальной операции или наличии резидуальной опухоли после хирургического вмешательства, адъювантным методом лечения является ЛТ, объём которой определяется радикальностью операции и выявленной распространённостью опухоли (рис. 5). ХТ может использоваться в случаях рецидива эпендимомы (рис. 6). Режимы ХТ при эпендимомах указаны в разделе 4.
1 Объём ЛТ зависит от объёма предшествующей ЛТ, распространённости опухоли и времени, прошедшего с момента предшествовашей ЛТ.
Контрольные обследования (МРТ с контрастированием и клиническое обследование) осуществляются не реже 1 раза в 3 мес. на протяжении первого года наблюдения, затем при отсутствии данных за прогрессирование — не реже 1 раза в 6 мес. В случае прогрессирования в виде солитарного очага рассматривается вопрос о повторной операции или, при небольших размерах рецидива, о радиохирургическом лечении.
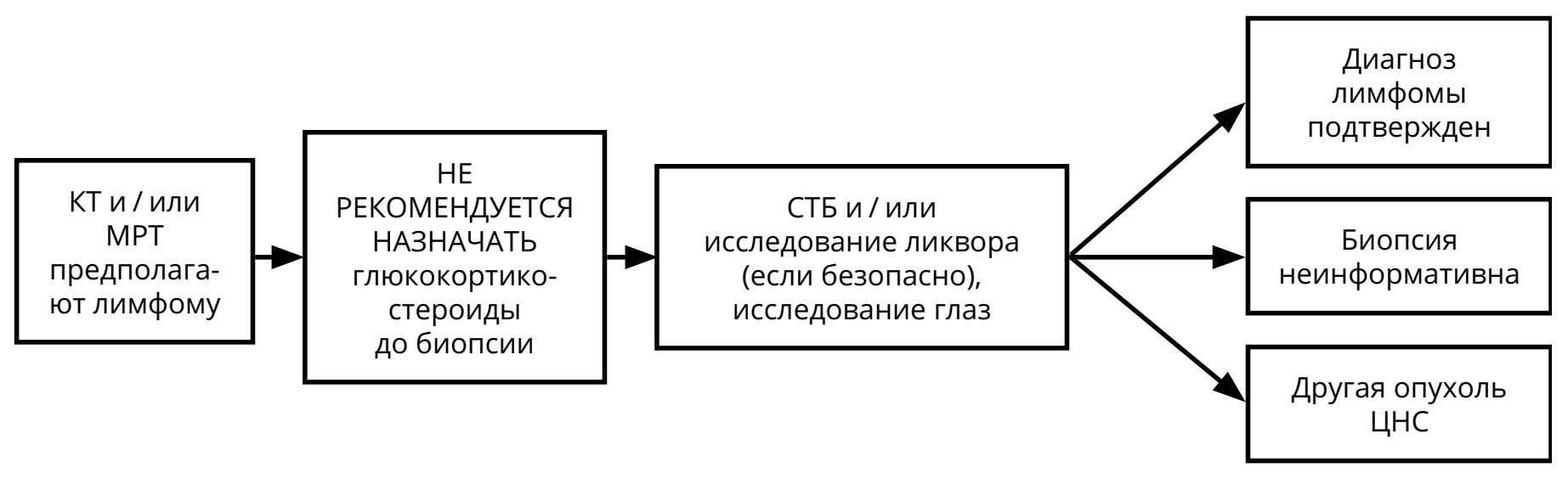
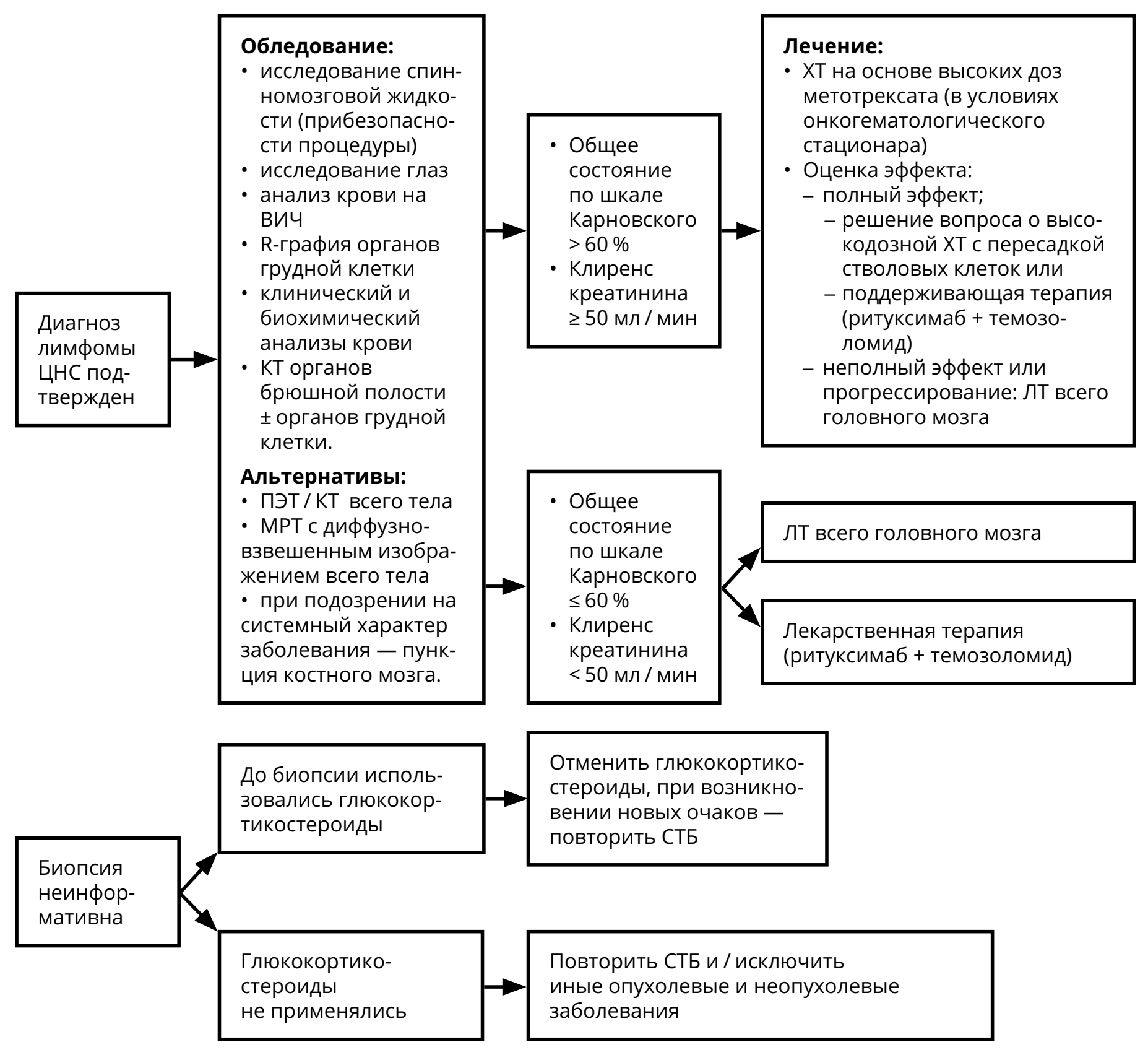
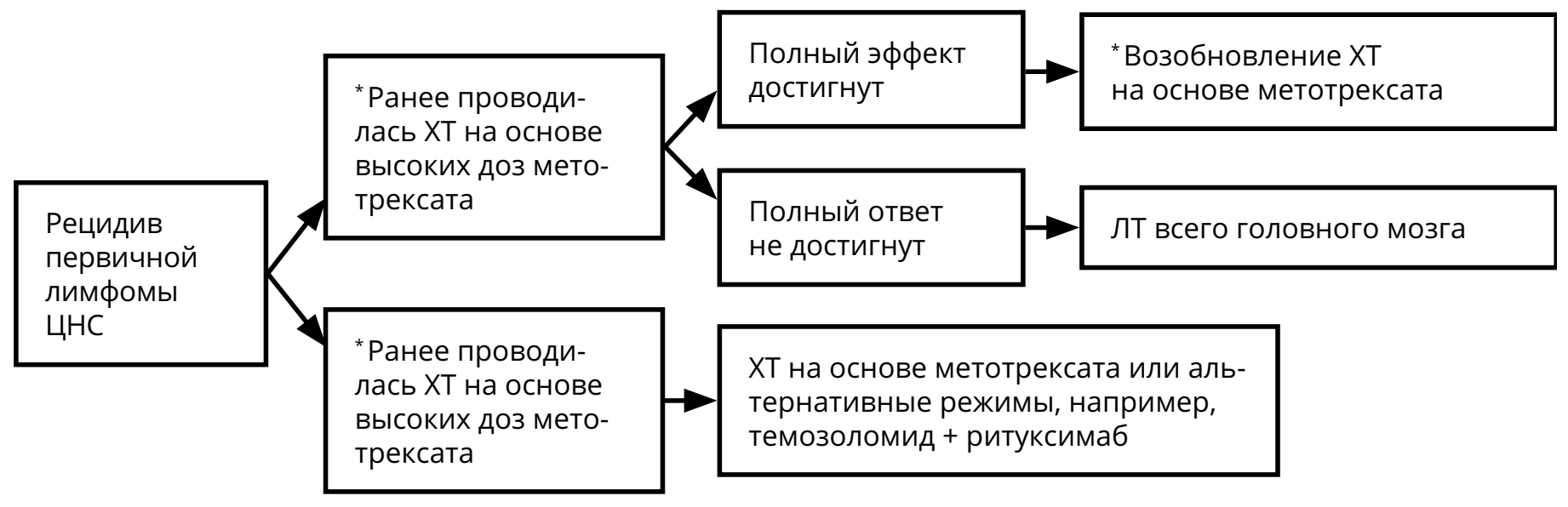
3.3.4. Первичная лимфома ЦНС
Относительно редкая опухоль ЦНС (5–7 % от всех первичных опухолей ЦНС), относящаяся, согласно онкогематологическим классификациям, к редким формам неходжкинских экстранодальных лимфом. Морфологически более, чем в 90 % случаев представлена диффузной B-клеточной лимфомой. Различают лимфомы ЦНС у иммунокомпетентных пациентов и ВИЧ-ассоциированные лимфомы. У 15–20 % больных с первичными лимфомами ЦНС выявляется поражение опухолью стекловидного тела глаза.
При рецидивах лимфомы ЦНС решение о методе лечения принимается исходя из нескольких параметров: времени с момента первичной верификации, продолжительности ремиссии, общего состояния больного, распространённости опухоли на момент рецидива (рис. 9).
3.3.5. Первичные герминогенные (герминативно-клеточные) опухоли ЦНС
Редкая группа первичных опухолей ЦНС (0,9 % от всех первичных опухолей ЦНС), встречается в основном в детском и молодом возрасте (медиана возраста на момент установления диагноза — примерно 17 лет), преобладает у лиц мужского пола (в соотношении м/ж 7:1). Гистологически все разновидности этих опухолей идентичны аналогичным семиномным и несеминомным опухолям яичка и яичника. Самой частой локализацией первичных герминативно-клеточных опухолей ЦНС является пинеальная область, что обусловливает две типичные группы симптомов: окклюзионно-гидроцефальный синдром и глазодвигательные нарушения. Поскольку негерминогенные герминативно-клеточные опухоли ЦНС характеризуются повышением в плазме крови опухолевых маркёров (АФП и/или β-ХГЧ), при подозрении на данные опухоли обязательно выполнение анализов крови на данные маркёры. Более того, при выявлении клинически значимого повышения одного или обоих маркёров (ХГЧ — более 5 × ВГН, АФП — более 2 × ВГН) лечение начинают без гистологической верификации опухоли с ХТ. По клиническому течению, формирующему подходы к лечению, разделяют герминому (устоялся также термин «чистая герминома» ЦНС) и негерминогенные герминативно-клеточные опухоли. При нормальных уровнях маркёров показана верификация диагноза. В соответствии с Морфологической классификацией ВОЗ опухолей ЦНС 2016 г. выделяют следующие морфологические типы первичных герминативно-клеточных опухолей ЦНС:
опухоль желточного мешка;
тератома со злокачественной трансформацией;
смешанные герминативно-клеточные опухоли.
Помимо маркёров, для полноценной диагностики данной группы опухолей необходимо выполнение МРТ с контрастированием всего головного и спинного мозга. Как и при первичной лимфоме ЦНС, при первичной герминоме ЦНС хирургическое удаление не улучшает прогноз, поэтому СТБ, эндоскопическая или открытая биопсия опухоли предпочтительнее удаления.
3.3.5.1. Первичная («чистая») герминома ЦНС
Современный подход к лечению заключается в ХТ в режиме EP (цисплатин +этопозид) (см. раздел 4) с последующим облучением желудочковой системы головного мозга СОД 24 Гр (при отсутствии данных за метастазирование по оболочкам спинного мозга). Поражение хиазмально-селярной области требует выполнения анализов крови на гормоны гипофиза на всех этапах лечения с участием эндокринолога (лучше — нейроэндокринолога). Краткий алгоритм лечения больных с первичной герминомой ЦНС:
МРТ головного и спинного мозга с контрастированием;
кровь на опухолевые маркёры (АФП, β-ХГЧ) — должны быть в пределах нормы;
обследование у невролога, офтальмолога, эндокринолога;
СТБ или прямая биопсия для верификации диагноза (при необходимости — решение вопроса о ликворошунтирующей операции);
ХТ по схеме EP (цисплатин + этопозид) — каждые 21 день;
после 2 курсов — контрольная МРТ головного и спинного мозга с контрастированием;
после 4 курсов — повторный контроль: МРТ головного и спинного мозга с контрастированием; при полном или «почти полном» эффекте — ЛТ в объёме облучения всей желудочковой системы (до уровня С2 шейного позвонка): РОД 1,8–2,0 Гр, СОД 24 Гр; в случае подозрения на остаточную опухоль (вероятнее всего — зрелую тератому) до ЛТ решается вопрос об удалении;
контрольная МРТ головного и спинного мозга каждые 3 мес. в течение первого года наблюдения, затем — каждые 6 мес. в течение 2‑го и 3‑го годов наблюдения, затем — 1 раз в год или при выявлении неврологических симптомов. Эффективность такого лечения достигает 90 % для 5‑летней и 10‑летней безрецидивной выживаемости, поэтому у фертильных пациентов мужского пола до начала лечения целесообразно решение вопроса о криоконсервации спермы.
3.3.5.2. Первичные негерминогенные герминативно-клеточные опухоли ЦНС
Ещё более редкая, чем первичная герминома ЦНС, группа опухолей, неоднородная по спектру морфологических форм (эмбриональная карцинома, опухоль желточного мешка, хориокарцинома, тератома (незрелая, тератома со злокачественной трансформацией)), с менее благоприятным по сравнению с «чистой» герминомой прогнозом.
Краткий алгоритм лечения больных с первичными негерминогенными герминативно-клеточными опухолями ЦНС:
МРТ головного и спинного мозга с контрастированием;
кровь на опухолевые маркёры (АФП, β-ХГЧ) — как правило, повышены;
обследование у невролога, офтальмолога, эндокринолога;
ХТ по схеме «цисплатин + ифосфамид + этопозид» каждые 21 день;
после 2 курсов — контрольная МРТ головного и спинного мозга с контрастированием, контроль опухолевых маркёров;
после 4 курсов — повторный контроль: МРТ головного и спинного мозга с контрастированием, контроль опухолевых маркёров; при полном или почти полном ответе– ЛТ в объёме краниоспинального облучения: РОД 1,8–2,0 Гр, СОД 36 Гр; в случае подозрения на остаточную опухоль (вероятнее всего — одну из разновидностей тератомы) — до ЛТ необходимо обсудить вопрос об удалении;
контрольная МРТ головного и спинного мозга каждые 3 мес. (+ контроль опухолевых маркёров) в течение первых 2 лет наблюдения, затем — каждые 6 мес. в течение 3‑го и 4‑го годов наблюдения, затем — 1 раз в год или при выявлении неврологических симптомов.
5‑летняя безрецидивная выживаемость при таком режиме лечения составляет 60–70 %.
До начала ХТ — решение вопроса о криоконсервации спермы.
3.4. Режимы лекарственной терапии первичных опухолей ЦНС
Рекомендуемые режимы лекарственной терапии различных вариантов первичных опухолей ЦНС представлены в табл. 1, 2, 3.
| PCV: ломустин 90 мг/м 2 внутрь в 1‑й день +винкристин 1,5 мг/м 2 в/в в 1‑й и 8‑й дни + прокарбазин 70 мг/м 2 внутрь в дни 8–21‑й дни, каждые 6 нед. |
|---|
| Метотрексат 3–8 г/м 2 в/в в 1‑й день (+ кальция фолинат 0,5 мг/кг в/в каждые 6 часов, начиная через 24 часа после введения метотрексата и под контролем снижения его концентрации в крови) + дексаметазон 8 мг/сут. в 1–3‑й дни, каждые 3 нед.; проводится только в стационарных условиях онкогематологического отделения или отделения химиотерапии |
|---|