Кто такие фаги в биологии
Кто такие фаги в биологии
Содержание
История
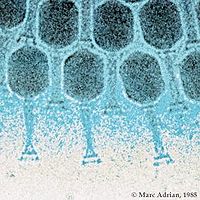
Предположение, что бактериофаги имеют корпускулярную природу, было выдвинуто еще Ф. д’Эрелем. Однако, только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представление о морфологии и основные особенности фагов основывались на результатах изучения фагов Т-группы — Т1, Т2. Т7, которые размножаются на Е. coli штамма В. Однако, с каждым годом появлялись новые данные касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
Жизненный цикл вирулентных бактериофагов
Применение
В медицине
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие.
Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
В биологии
Бактериофаги M13, T4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.
Ссылки
Полезное
Смотреть что такое «Фаг» в других словарях:
фаг — фаг/ … Морфемно-орфографический словарь
ФАГ — фенилаланингидроксилаза белок Источник: http://obi.img.ras.ru/humbio/proteins/000c1bb0.htm ФАГ фронтовая артиллерийская группа воен. Словарь: С. Фадеев. Словарь сокращений современного русского языка. С. Пб.: Политехника, 1997. 527 с. ФАГ фильтр… … Словарь сокращений и аббревиатур
. фаг(о). — фаг(о). составная часть сложных слов, означающая поедание, поглощение, напр. бактериофаг, фагоциты. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) … Словарь микробиологии
фаг — а, м. ( … Словарь иностранных слов русского языка
фаг — сущ., кол во синонимов: 2 • бактериофаг (3) • вирус (48) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
ФАГ — см. Бактериофаги. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989 … Экологический словарь
ФАГ — то же, что бактериофаг … Ветеринарный энциклопедический словарь
Что такое бактериофаги простыми словами
В 1928 году британский бактериолог Александр Флеминг вернулся из отпуска в Шотландии в свою лабораторию в Лондоне и обнаружил, как в одной из чашек Петри бурно разрослась колония плесневых грибов (Penicillium notatum). С выделением пенициллина началась эра антибиотиков.
С тех пор антибиотики спасли миллионы жизней по всей планете. Флеминг также обнаружил, что бактерии обладали устойчивостью к антибиотикам, если действовали малым количеством пенициллина, либо если антибиотик употреблялся слишком короткое время.
Алмрот Райт предсказал устойчивость к антибиотикам еще до того, когда это было обнаружено экспериментально. Бактериальная резистентность — явление естественное по своей природе, а потому неизбежное.
Вот уже более десятка лет Всемирная организация здравоохранения, Центр по контролю заболеваний в США, многие крупные эксперты в России открыто признают, что мы вступили в так называемую пост антибиотиковую эру.
В 2016 году в США зафиксирован случай заражения человека одной из разновидностей энтеробактерий. Штамп оказался устойчивым к воздействию тетрациклина, колистина, ко всем до единого из 26 видов антибиотиков, представленных на рынке. Женщину так и не удалось спасти.
Ученые по всему миру продолжают изучать явление резистентности в надежде минимизировать угрозы. Однако одной из самых подходящих альтернатив можно назвать препараты (комбинированные или моно) на основе бактериофагов.
Бактериофаги являются важнейшим компонентом нашей продукции и помогают при профилактике бактериальных заболеваний и борьбе с ними. Название звучит непривычно и немного непонятно. На самом деле, с бактериофагами люди знакомы уже более ста лет.
Бактериофаг в переводе с греческого означает «пожиратель бактерий». Не самое доброе «существо», но в действительности никто никого не пожирает. Бактериофаги — это природные агенты, которые естественным образом ограничивают размножение бактерий. Они способны избирательно устранять только те бактерии, которым они соответствуют, при этом не повреждая нормофлору или человеческие клетки.
Они являются самым распространенным биологическим объектом на Земле.
Бактериальные вирусы были открыты дважды: в 1915 году Фредериком Уильямом Туортом и в 1917 году Феликсом Д’Эреллем, который и предложил термин «бактериофаг».
Второе открытие было сделано во время исследования вспышки дизентерии среди французских солдат во время Первой мировой войны. При изучении лизиса (разрушения клетки под действием собственных или чужеродных ферментов) бактериальных культур.
Ученый обратил внимание, что какое-то существо, невидимое в обычный микроскоп, разрушает выращенные им культуры бактерий. Микробиологу удалось настроить его размножение: бактерии, зараженные им, погибали, а количество агента увеличивалось.
В 1919 году ученый успешно вылечил бактериофагами первых пациентов. Он описал случай успешного лечения дизентерии с использованием фагов, доказав, что они обеспечивают выздоровление больного организма. Были проведены и первые опыты по применению фагов при раневых инфекциях, холере, тифе и даже бубонной чуме. Успех выглядел вполне убедительно.
После открытия бактериофаги начали использовать для борьбы с бактериальными патогенами. Однако в Западной Европе и США от такой терапии вскоре отказались из-за сомнительных результатов. Это было неудивительно, принимая во внимание тогдашний уровень понимания биологии бактериофагов и отсутствие стандартизации. А открытие в 1928 году пенициллина и последовавшая за этим событием «эра антибиотиков» надолго отодвинули интерес к профилактическому и медицинскому использованию бактериофагов.
Хотя в государствах Восточной Европы, таких как СССР, применение бактериофагов в терапии продолжилось, чему способствовало основание в 1934 году Института Бактериофага в Тбилиси Георгием Элиавой совместно с Феликсом Д’Эреллем.
В мире интерес к фаговой терапии возобновился только в 1980-е годы, когда эффективность лечения антибиотиками значительно снизилась, а бактерии стали более устойчивы к лекарствам. Сейчас исследования в этой области активно ведутся по всему миру.
Кто такие фаги в биологии
Содержание
История
Предположение, что бактериофаги имеют корпускулярную природу, было выдвинуто еще Ф. д’Эрелем. Однако, только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представление о морфологии и основные особенности фагов основывались на результатах изучения фагов Т-группы — Т1, Т2. Т7, которые размножаются на Е. coli штамма В. Однако, с каждым годом появлялись новые данные касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
Жизненный цикл вирулентных бактериофагов
Применение
В медицине
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие.
Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
В биологии
Бактериофаги M13, T4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.
Ссылки
Полезное
Смотреть что такое «Фаги» в других словарях:
фаги — вирусы, поражающие бактерии (бактериофаги) или водоросли (альгофаги). (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) фаги См. Бактериофаги (Источник: «Словарь терминов микробиологии») … Словарь микробиологии
ФАГИ — ФАГИ, то же, что бактериофаги … Современная энциклопедия
ФАГИ — то же, что бактериофаги … Большой Энциклопедический словарь
Фаги — ФАГИ, то же, что бактериофаги. … Иллюстрированный энциклопедический словарь
фаги — ов; мн. (ед. фаг, а; м.). [от греч. phagos пожиратель]. Спец. Вирусы, вызывающие разрушение микроорганизмов. ◁ Фаговый, ая, ое. Ф ая терапия. * * * фаги то же, что бактериофаги. * * * ФАГИ ФАГИ, то же, что бактериофаги (см. БАКТЕРИОФАГИ) … Энциклопедический словарь
фаги — bacteriophage, phage, bacterial virus бактериофаги, фаги. Вирусы бактерий; Б. чрезвычайно разнообразны по своей химической и генетической структуре размеры геномов могут варьировать в пределах 2 порядков; впервые Б. описаны Ф.Туортом в 1915, а… … Молекулярная биология и генетика. Толковый словарь.
фаги — bakteriofagai statusas T sritis ekologija ir aplinkotyra apibrėžtis Virusai, parazituojantys bakterijose ir kituose mikroorganizmuose. Į bakterijos ląstelę patenka tik viruso genetinė medžiaga (nukleorūgštis), keičianti ląstelės šeimininkės… … Ekologijos terminų aiškinamasis žodynas
Фаги — вирусы, вызывающие разрушение (лизис) микроорганизмов; см. Бактериофаги … Большая советская энциклопедия
Фаги — мн. Вирусы, вызывающие разрушение микроорганизмов. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
ФАГИ — то же, что бактериофаги … Естествознание. Энциклопедический словарь
Бактериофаги: 100 лет на службе человечеству
Валентин Власов, Вера Морозова, Игорь Бабкин, Нина Тикунова
«Наука из первых рук» №4(70), 2016

Об авторах
Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, директор Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Лауреат Государственной премии РФ (1999). Автор и соавтор более 300 научных работ и 20 патентов.
Вера Витальевна Морозова — кандидат биологических наук, старший научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор более 30 научных работ и 6 патентов.
Игорь Викторович Бабкин — кандидат биологических наук, ведущий научный сотрудник лаборатории молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 58 научных работ и 2 патентов.
Нина Викторовна Тикунова — доктор биологических наук, заведующая лабораторией молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 120 научных работ и 21 патента.
В середине прошлого века биологическая наука сделала революционный шаг вперед, установив молекулярные основы функционирования живых систем. Огромную роль в успешных исследованиях, которые привели к определению химической природы наследственных молекул, расшифровке генетического кода и созданию технологий манипуляций генами, сыграли бактериофаги, открытые еще в начале прошлого столетия. На сегодняшний день эти бактериальные вирусы освоили много полезных для человека «профессий»: их используют не только как безопасные антибактериальные препараты, но и как дезинфектанты и даже в качестве основы для создания электронных наноустройств.
Когда в 1930-х гг. группа ученых занялась проблемами функционирования живых систем, то в поиске простейших моделей они обратили внимание на бактериофаги — вирусы бактерий. Ведь среди биологических объектов нет ничего проще, чем бактериофаги, к тому же их можно легко и быстро выращивать и анализировать, а вирусные генетические программы невелики.
Фаг — это минимального размера природная структура, содержащая плотно упакованную генетическую программу (ДНК или РНК), в которой нет ничего лишнего. Эта программа заключена в белковую оболочку, снабженную минимальным набором устройств для ее доставки внутрь бактериальной клетки. Бактериофаги не могут размножаться сами по себе, и в этом смысле их нельзя считать полноценными живыми объектами. Их гены начинают работать только в бактерии, используя имеющиеся в бактериальной клетке биосинтетические системы и запасы молекул, необходимых для синтеза. Однако генетические программы этих вирусов принципиально не отличаются от программ более сложных организмов, поэтому эксперименты с бактериофагами позволили установить основополагающие принципы устройства и работы генома.
В дальнейшем эти знания и разработанные в ходе исследований методы стали фундаментом для развития биологической и медицинской науки, а также широкого спектра биотехнологических приложений.
Бактериофаги — наши друзья, когда речь идет о бактериях, патогенных для человека. Однако есть и другие, дружественные нам бактерии, которые используются в современных биотехнологических производствах, а также в традиционных производствах пищевой промышленности, таких как сыроварение и т. п. В этих случаях фаги могут приносить большой вред, поскольку в больших популяциях микроорганизмов, находящихся в стадии интенсивного роста, создаются благоприятные условия для размножения фагов, что приводит к лизису производственных бактериальных культур. При производстве сыра проблема не столь серьезна, так как при этом обычно применяют закваски, состоящие из многих культур, часть которых выдержит фаговую атаку и продолжит процесс молочнокислого брожения. Серьезные неприятности возникают, если весь процесс основан на применении одного конкретного бактериального штамма, как, например, при производстве антибиотиков или терапевтических белков.
Борцы с патогенами
Первые попытки использовать бактериофаги для лечения инфекционных заболеваний были предприняты практически сразу после их открытия, однако недостаток знаний и несовершенные биотехнологии того времени не позволили достичь полного успеха. Тем не менее дальнейшая клиническая практика показала принципиальную возможность успешного применения бактериофагов при инфекционных заболеваниях желудочно-кишечного тракта, мочеполовой системы, при острых гнойно-септических состояниях больных, для лечения хирургических инфекций и т. д.
По сравнению с антибиотиками бактериофаги имеют ряд преимуществ: они не вызывают побочных эффектов, к тому же строго специфичны для определенных видов бактерий, поэтому при их использовании не нарушается нормальный микробиом человека. Однако такая высокая избирательность создает и проблемы: чтобы успешно лечить пациента, нужно точно знать инфекционный агент и подбирать бактериофаг индивидуально.
Фаги можно использовать и профилактически. Так, Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г. Н. Габричевского разработал профилактический продукт «ФУДФАГ» на основе коктейля из бактериофагов, снижающий риск заражения острыми кишечными инфекциями. Клинические исследования показали, что недельный прием препарата позволяет избавиться от гемолизирующей кишечной палочки и других патогенных и условно-патогенных бактерий, вызывающих дисбактериоз кишечника.
Бактериофагами лечат инфекционные болезни не только людей, но и домашних и сельскохозяйственных животных: мастит у коров, колибактериоз и эшерихиоз у телят и свиней, сальмонеллез у кур. Особенно удобно применять фаговые препараты в случае аквакультуры — для лечения промышленно выращиваемых рыб и креветок, так как в воде они долго сохраняются. Бактериофаги помогают защитить и растения, хотя применение фаговых технологий в этом случае затруднено из-за воздействия природных факторов, таких как солнечный свет и дождь, губительных для вирусов.
Фаги могут сыграть большую роль в поддержании микробиологической безопасности продуктов питания, так как применение антибиотиков и химических агентов в пищевой отрасли не решает эту проблему, одновременно снижая уровень экологической чистоты продукции. О серьезности самой проблемы говорят статистические данные: например, в США и России ежегодно регистрируется до 40 тыс. заболевших сальмонеллезом, из которых 1% умирает. Распространение этой инфекции в значительной степени связано с выращиванием, переработкой и потреблением различных видов птицы, и попытки применить для борьбы с ней бактериофаги дали многообещающие результаты.
Так, американская компания Intralytix производит фаговые препараты для борьбы с листериозом, сальмонеллезом и бактериальным загрязнением кишечной палочкой. Они разрешены к применению как добавки, предотвращающие размножение бактерий на продуктах питания — их распыляют на продукты из мяса и домашней птицы, а также на овощи и фрукты. Эксперименты показали, что коктейль из бактериофагов может быть успешно применен и при транспортировке и реализации живой прудовой рыбы для снижения бактериального загрязнения не только воды, но и самой рыбы.
Очевидным применением бактериофагов является дезинфекция, то есть уничтожение бактерий в тех местах, где их не должно быть: в больницах, на пищевых производствах и т. п. Для этой цели британская компания Fixed-Phage разработала метод фиксации фаговых препаратов на поверхностях, обеспечивающий сохранение биологической активности фагов до трех лет.
Бактериофаги — «дрозофилы» молекулярной биологии

Эксперимент американских исследователей А. Херши и М. Чейза с использованием бактериофагов, меченных изотопами серы и фосфора, доказали роль ДНК как основного носителя генетической информации
В 1946 г. на 11-м симпозиуме в знаменитой американской лаборатории в Колд Спринг Харборе, была провозглашена теория «один ген — один фермент». Бактериолог А. Херши и «бывший» физик, молекулярный биолог М. Дельбрюк доложили об обмене генетическими признаками между различными фагами при одновременном заражении ими клеток кишечной палочки. Это открытие, сделанное в то время, когда физический носитель гена еще не был известен, свидетельствовало, что явление «рекомбинации» — перемешивания генетических признаков, свойственно не только высшим организмам, но и вирусам. Обнаружение этого феномена в дальнейшем дало возможность детально исследовать молекулярные механизмы репликации. Позднее эксперименты с бактериофагами позволили установить принципы устройства и работы генетических программ.
В 1952 г. А. Херши и М. Чейз экспериментально доказали, что наследственная информация бактериофага Т2 закодирована не в белках, как считали многие ученые, а в молекулах ДНК (Hershey & Chase, 1952). Исследователи проследили за процессом воспроизводства в двух группах бактериофагов, одна из которых несла меченные радиоактивной меткой белки, а другая — молекулы ДНК. После инфицирования бактерий такими фагами оказалось, что в зараженную клетку передается только вирусная ДНК, что и послужило доказательством ее роли в хранении и передаче наследственной информации.

В качестве объектов для своих исследований М. Дельбрюк и его сотрудники использовали мутантные бактериофаги так называемой Т-серии, поражающие кишечную палочку
В том же году американские генетики Д. Ледерберг и Н. Циндлер в эксперименте с участием двух штаммов сальмонелл и бактериофага Р22 установили, что бактериофаг способен в процессе размножения включать в себя фрагменты ДНК бактерии-хозяина и передавать их другим бактериям при заражении (Zinder & Lederberg, 1952). Это явление переноса генов от бактерии-донора к реципиенту было названо «трансдукцией». Результаты эксперимента стали очередным подтверждением роли ДНК в передаче наследственной информации.
В 1969 г. А. Херши, М. Дельбрюк и их коллега С. Луриа стали Нобелевскими лауреатами «за открытия, касающиеся механизма репликации и генетической структуры вирусов».
В 1972 г. Р. Берд с коллегами при изучении процесса репликации (копировании клеточной информации) ДНК кишечной палочки использовали бактериофаги в качестве зондов, способных встраиваться в геном бактериальной клетки, и обнаружили, что процесс репликации идет в двух направлениях вдоль хромосомы (Стент, 1974).
Семь дней творения
Современные методы синтетической биологии позволяют не только вносить различные модификации в фаговые геномы, но и создавать полностью искусственные активные фаги. Технологически это несложно, нужно только синтезировать фаговый геном и ввести его в бактериальную клетку, а там он уже сам запустит все процессы, необходимые для синтеза белков и сборки новых фаговых частиц. В современных лабораториях на эту работу уйдет всего несколько дней.
Генетические модификации применяют, чтобы изменить специфичность фагов и повысить эффективность их терапевтического действия. Для этого наиболее агрессивные фаги снабжают узнающими структурами, связывающими их с целевыми бактериями. Также в вирусные геномы дополнительно встраивают гены, кодирующие токсические для бактерий белки, нарушающие метаболизм, — такие фаги более смертоносны для бактерий.
Бактерии имеют несколько механизмов защиты от антибиотиков и бактериофагов, один из которых — разрушение вирусных геномов ферментами рестрикции, действующими на определенные нуклеотидные последовательности. Для увеличения терапевтической активности фагов можно за счет вырожденности генетического кода так «переформатировать» последовательности их генов, чтобы минимизировать число нуклеотидных последовательностей, «чувствительных» к ферментам, одновременно сохранив их кодирующие свойства.
Универсальный способ защиты бактерий от всех внешних воздействий — так называемые биофильмы, пленки из ДНК, полисахаридов и белков, которые бактерии создают совместными усилиями и куда не проникают ни антибиотики, ни терапевтические белки. Такие биопленки — головная боль врачей, так как они способствуют разрушению зубной эмали, образуются на поверхности имплантов, катетеров, искусственных суставов, а также в дыхательных путях, на поверхности кожи и т. п. Для борьбы с биофильмами были сконструированы особые бактериофаги, содержащие ген, кодирующий специальный литический фермент, разрушающий бактериальные полимеры.
Ферменты «от бактериофага»
Большое число ферментов, сегодня широко использующихся в молекулярной биологии и генетической инженерии, были открыты в результате исследований бактериофагов.

Традиционная схема клонирования (встраивания чужеродной ДНК) с использованием в качестве «вектора» плазмиды (внехромосомного генетического элемента, присущего многим штаммам бактерий) начинается с разрезания плазмидной ДНК и вырезания нужного участка хромосомной ДНК с помощью фермента рестриктазы. Затем фрагмент клонируемой ДНК встраивается в плазмиду, которая вводится в бактерию, благодаря чему она становится способной производить чужеродный белок, закодированный во встроенном фрагменте
Одним из таких примеров являются ферменты рестриктазы — группа бактериальных нуклеаз, расщепляющих ДНК. Еще в начале 1950-х гг. было обнаружено, что бактериофаги, выделенные из клеток одного штамма бактерий, зачастую плохо размножаются в близкородственном штамме. Обнаружение этого феномена означало, что у бактерий есть система подавления размножения вирусов (Luria & Human, 1952). В результате была открыта ферментативная система рестрикции-модификации, с помощью которой бактерии разрушали попавшую в клетку чужеродную ДНК. Выделение рестриктаз (эндонуклеаз рестрикции) дало в руки молекулярных биологов бесценный инструмент, позволивший манипулировать ДНК: встраивать одни последовательности в другие или вырезать необходимые фрагменты цепи, что в итоге привело к разработке технологии создания рекомбинантной ДНК.
Еще один широко используемый в молекулярной биологии фермент — ДНК-лигаза бактериофага Т4, которая «сшивает» «липкие» и «тупые» концы двуцепочечных молекул ДНК и РНК. А недавно появились генно-модифицированные варианты этого фермента с большей активностью.
От бактериофагов ведут свое происхождение и большинство используемых в лабораторной практике РНК-лигаз, которые «сшивают» одноцепочечные молекулы РНК и ДНК. В природе они в основном служат для починки сломанных молекул РНК. Исследователи наиболее часто используют РНК-лигазу бактериофага Т4, с помощью которой можно «пришить» одноцепочечные полинуклеотиды к РНК-молекулам, чтобы пометить их. Такой прием применяется для анализа структуры РНК, поиска мест связывания РНК с белками, олигонуклеотидного синтеза и т. д. Недавно среди рутинно используемых ферментов появились термостабильные РНК-лигазы, выделенные из бактериофагов rm378 и TS2126 (Nordberg Karlsson, et al., 2010; Hjorleifsdottir, 2014).
Из бактериофагов получены и некоторые из еще одной группы чрезвычайно важных ферментов — полимераз. Например, очень «точная» ДНК-полимераза бактериофага Т7, которая нашла применение в различных областях молекулярной биологии, таких как сайт-направленный мутагенез, но в основном ее используют для определения первичной структуры ДНК.
Химически модифицированная ДНК-полимераза фага Т7 была предложена как идеальный инструмент для секвенирования ДНК еще в 1987 г. (Tabor & Richardson, 1987). Модификация этой полимеразы увеличила эффективность ее работы в несколько раз: скорость полимеризации ДНК при этом достигает более 300 нуклеотидов в секунду, поэтому ее можно использовать для амплификации больших фрагментов ДНК. Этот фермент стал предшественником секвеназы — генно-инженерного фермента, оптимизированного для секвенирования ДНК в реакции Сэнгера. Секвеназа отличается высокой эффективностью и способностью включать в последовательность ДНК нуклеотидные аналоги, используемые для улучшения результатов секвенирования.
Происхождение от бактериофагов ведут и используемые в молекулярной биологии основные РНК-полимеразы (ДНК-зависимые РНК-полимеразы) — ферменты, которые катализируют процесс транскрипции (считывание РНК-копий с матрицы ДНК). К ним относятся SP6-, T7- и Т3-РНК-полимеразы, названные в честь соответствующих бактериофагов SP6, Т7 и Т3. Все эти ферменты используются для синтеза «в пробирке» антисмысловых РНК-транскриптов, меченых РНК-зондов и т. д.
Первым полностью секвенированным ДНК-геномом стал геном фага φ174 длиной свыше 5 тыс. нуклеотидов (Sanger et al., 1977). Эту расшифровку осуществила группа английского биохимика Ф. Сэнгера, создателя известного одноименного метода секвенирования ДНК.
Полинуклеотидкиназы катализируют перенос фосфатной группы от молекулы АТФ к 5′-концу молекулы нуклеиновой кислоты, обмен 5′-фосфатных групп или фосфорилирование 3′-концов мононуклеотидов. В лабораторной практике наибольшее распространение получила полинуклеотидкиназа бактериофага Т4. Она обычно используется в экспериментах для мечения ДНК радиоактивным изотопом фосфора. Полинуклеотидкиназа также используется для поиска сайтов рестрикции, ДНК и РНК дактилоскопии, синтеза субстратов для ДНК или РНК-лигаз.
В молекулярно-биологических экспериментах также находят широкое применение такие ферменты бактериофагов, как полинуклеотидкиназа фага Т4, обычно используемая для мечения ДНК радиоактивным изотопом фосфора, ДНК и РНК дактилоскопии и др., а также ферменты, расщепляющие ДНК, которые используются для получения одноцепочечных ДНК-матриц для секвенирования и анализа нуклеотидного полиморфизма.
Разобравшись с механизмом работы систем CRISPR-Cas, исследователи попробовали снабдить подобным «оружием» и самих фагов, для чего в их геном ввели комплекс генов, кодирующий нуклеазу и адресующие последовательности РНК, комплементарные специфическим участкам генома бактерий. «Мишенью» могут выступать гены, ответственные за множественную лекарственную устойчивость. Эксперименты увенчались полным успехом — такие фаги с большой эффективностью поражали бактерии, на которые были «настроены».
Фаговые антибиотики
В терапевтических целях фаги необязательно использовать напрямую. За миллионы лет эволюции бактериофаги разработали арсенал специфических белков — инструментов для распознавания целевых микроорганизмов и манипуляций с биополимерами жертвы, на основе которых можно создавать противобактериальные препараты. Наиболее перспективными белками такого типа являются ферменты эндолизины, которые фаги используют для разрушения клеточной стенки при выходе из бактерии. Сами по себе эти вещества являются мощными антибактериальными средствами, нетоксичными для человека. Эффективность и направленность их действия можно повысить, изменив в них адресующие структуры — белки, специфически связывающиеся с определенными бактериями.
Большинство бактерий делятся по устройству клеточной стенки на грамположительные, мембрана которых покрыта очень толстым слоем пептидогликанов, и грамотрицательные, у которых слой пептидогликана расположен между двумя мембранами. Использование природных эндолизинов особенно эффективно в случае грамположительных бактерий (стафилококков, стрептококков и др.), поскольку пептидогликановый слой у них расположен снаружи. Грамотрицательные бактерии (синегнойная палочка, сальмонеллы, кишечная палочка и др.) являются менее доступной мишенью, поскольку ферменту, чтобы добраться до внутреннего пептидогликанового слоя, необходимо проникнуть сквозь внешнюю бактериальную мембрану.
Для преодоления этой проблемы были созданы так называемые артилизины — модифицированные варианты природных эндолизинов, содержащие поликатионные или амфипатические пептиды, которые дестабилизируют внешнюю мембрану и обеспечивают доставку эндолизина непосредственно к пептидогликановому слою. Артилизины обладают высокой бактерицидной активностью и уже показали свою эффективность при лечении отитов у собак (Briers et al., 2014).
Примером модифицированного эндолизина, избирательно действующего на определенные бактерии, является препарат P128 канадской компании GangaGen Inc. Он представляет собой биологически активный фрагмент эндолизина, соединенный с лизостафином — адресующей белковой молекулой, которая связывается с поверхностью клеток стафилококков. Полученный химерный белок обладает высокой активностью против разных штаммов стафилококка, в том числе обладающих множественной лекарственной устойчивостью.
«Счетчики» бактерий
Бактериофаги служат не только разносторонним терапевтическим и «дезинфицирующим» средством, но и удобным и точным аналитическим инструментом микробиолога. К примеру, благодаря своей высокой специфичности они являются природными аналитическими реагентами для выявления бактерий определенного вида и штамма.
В простейшем варианте такого исследования в чашку Петри с питательной средой, засеянную бактериальной культурой, добавляют по капле различные диагностические бактериофаги. Если бактерия окажется чувствительной к фагу, то на этом месте бактериального «газона» образуется «бляшка» — прозрачный участок с убитыми и лизированными бактериальными клетками.
Анализируя размножение фагов в присутствии целевых бактерий, можно количественно определить численность последних. Так как количество фаговых частиц в растворе возрастет пропорционально числу содержавшихся в нем бактериальных клеток, то для оценки численности бактерий достаточно определить титр бактериофага.
Специфичность и чувствительность такой аналитической реакции достаточно высока, а сами процедуры просты в исполнении и не требуют сложного оборудования. Важно, что диагностические системы, основанные на бактериофагах, сигнализируют о наличии именно живого патогена, тогда как другие методы, такие как ПЦР и иммуноаналитические, свидетельствуют лишь о наличии биополимеров, принадлежащих этой бактерии. Такого типа диагностические методы особенно удобны для использования в экологических исследованиях, а также в пищевой индустрии и сельском хозяйстве.
Сейчас для выявления и количественного определения разных штаммов микроорганизмов применяют специальные референсные виды фагов. Очень быстрые, работающие практически в режиме реального времени аналитические системы могут быть созданы на основе генетически модифицированных бактериофагов, которые при попадании в бактериальную клетку запускают в ней синтез репортерных флуоресцирующих (или способных к люминесценции) белков, таких как люцифераза. При добавлении к подобной среде необходимых субстратов в ней будет появляться люминесцентный сигнал, величина которого соответствует содержанию бактерий в образце. Такие «меченные светом» фаги были разработаны для детекции опасных патогенов — возбудителей чумы, сибирской язвы, туберкулеза, а также инфекций растений.
Вероятно, с помощью модифицированных фагов удастся решить и давнюю задачу глобальной важности — разработать дешевые и быстрые методы детекции возбудителей туберкулеза на ранней стадии заболевания. Задача эта очень сложна, поскольку микобактерии, вызывающие туберкулез, отличаются крайне медленным ростом при культивировании в лабораторных условиях. Поэтому диагностика заболевания традиционными методами может затягиваться на срок до нескольких недель.
Фаговая технология позволяет упростить эту задачу. Суть ее в том, что к образцам анализируемой крови добавляют бактериофаг D29, способный поражать широкий спектр микобактерий. Затем бактериофаги отделяют, и образец перемешивают с быстрорастущей непатогенной культурой микобактерий, также чувствительной к этому бактериофагу. Если в крови первоначально имелись микобактерии, которые были инфицированы фагами, то в новой культуре будет также наблюдаться наработка бактериофага. Таким образом можно выявить единичные клетки микобактерий, а сам процесс диагностики с 2–3 недель сокращается до 2–5 дней (Swift & Rees, 2016).
Фаговый дисплей
В наши дни бактериофаги широко применяются также в качестве простых систем для наработки белков с заданными свойствами. Речь идет о разработанной в 1980-х гг. крайне эффективной молекулярно-селекционной методике — фаговом дисплее. Этот термин был предложен американцем Дж. Смитом, который доказал, что на основе бактериофагов кишечной палочки можно создать жизнеспособный модифицированный вирус, несущий на своей поверхности чужеродный белок. Для этого в фаговый геном внедряется соответствующий ген, который сливается с геном, кодирующим один из поверхностных вирусных белков. Такие модифицированные бактериофаги можно выделить из смеси с фагами дикого типа благодаря способности «чужого» белка связываться со специфичными антителами (Smith, 1985).
Из экспериментов Смита последовало два важных вывода: во-первых, используя технологию рекомбинантных ДНК, можно создавать огромные по разнообразию популяции численностью 10 6 –10 14 фаговых частиц, каждая из которых несет на своей поверхности разные варианты белков. Такие популяции назвали комбинаторные фаговые библиотеки. Во-вторых, выделив из популяции конкретный фаг (например, обладающий способностью связываться с определенным белком или органической молекулой), можно этот фаг размножить в бактериальных клетках и получить неограниченное число потомков с заданными свойствами.
Принципиальная схема процедуры биопеннинга — отбора высокоспецифичных рекомбинантных антител к конкретной мишени-антигену из комбинаторной библиотеки фагового дисплея на основе нитчатых бактериофагов. По: (Тикунова, Морозова, 2009)
С помощью фагового дисплея сегодня производят белки, которые могут избирательно связываться с терапевтическими мишенями, например, экспонированные на поверхности фага М13, способные узнавать и взаимодействовать с опухолевыми клетками. Роль этих белков в фаговой частице заключается в «упаковке» нуклеиновой кислоты, поэтому они хорошо подходят для создания препаратов генотерапии, только в этом случае они формируют частицу уже с терапевтической нуклеиновой кислотой.
На сегодня можно выделить два основных направления применения фагового дисплея. Технология на основе пептидов используется для исследования рецепторов и картирования сайтов связывания антител, создания иммуногенов и нановакцин, а также картирования сайтов связывания субстратов у белков-ферментов. Технология на основе белков и белковых доменов — для отбора антител с заданными свойствами, изучения белок-лигандных взаимодействий, скрининга экспрессируемых фрагментов комплементарной ДНК и направленных модификаций белков.
С помощью фагового дисплея можно вносить узнающие группировки во все виды поверхностных вирусных белков, а также в основной белок, формирующий тело бактериофага. Вводя в поверхностные белки пептиды с заданными свойствами, можно получить целый спектр ценных биотехнологических продуктов. Например, если этот пептид будет имитировать белок опасного вируса или бактерии, узнаваемый иммунной системой, то такой модифицированный бактериофаг представляет собой вакцину, которую можно просто, быстро и безопасно наработать.
Если же концевой поверхностный белок бактериофага «адресовать» на раковые клетки, а к другому поверхностному белку присоединить репортерные группы (например, флуоресцирующие или магнитные), то получится средство для обнаружения опухолей. А если к частице присоединить еще и цитотоксический препарат (а современная биоорганическая химия позволяет легко это сделать), то получится лекарство, направленно действующее на раковые клетки.
Одним из важных применений метода фагового дисплея белков является создание фаговых библиотек рекомбинантных антител, где антигенсвязывающие фрагменты иммуноглобулинов расположены на поверхности фаговых частиц fd или М13. Особый интерес представляют библиотеки антител человека, поскольку такие антитела могут быть использованы в терапии без ограничения. В последние годы только на фармацевтическом рынке США продается около полутора десятка терапевтических антител, сконструированных с использованием этого метода.
«Промышленные» фаги
Методология фагового дисплея нашла себе и совершенно неожиданное применение. Ведь бактериофаги в первую очередь являются наноразмерными частицами определенной структуры, на поверхности которых располагаются белки, которые с помощью фагового дисплея можно «снабдить» свойствами специфически связываться с нужными молекулами. Такие наночастицы открывают широчайшие возможности для создания материалов с заданной архитектурой и «умных» молекулярных наноустройств, при этом технологии их производства будут экологически чистыми.
Так как вирус представляет собой достаточно жесткую конструкцию с определенным соотношением размерностей, это обстоятельство позволяет использовать его для получения пористых наноструктур с известной площадью поверхности и нужным распределением пор в структуре. Как известно, именно площадь поверхности катализатора является критическим параметром, определяющим его эффективность. А существующие на сегодня технологии формирования на поверхности бактериофагов тончайшего слоя металлов и их оксидов позволяют получать катализаторы с чрезвычайно развитой регулярной поверхностью заданной размерности. (Lee et al., 2012).
Исследователь из Массачусетского технологического института А. Бельхер использовала бактериофаг M13 как шаблон для роста наночастиц и нанопроводов родия и никеля на поверхности оксида церия. Полученные наночастицы катализатора способствуют конвертации этанола в водород, таким образом, этот катализатор может оказаться весьма полезным для модернизации существующих и создания новых водородных топливных ячеек. Катализатор, выращенный на шаблоне вируса, отличается от аналогичного по составу «обычного» катализатора более высокой стабильностью, он менее подвержен старению и дезактивации поверхности (Nam et al., 2012).
Нитчатый бактериофаг М13, размножающийся в обычной кишечной палочке (а), может нести на своей поверхности рекомбинантные чужеродные белки, такие как антитела (б) либо пептиды (в). Он также может служить шаблоном для создания наноустройств и наноматериалов, таких как нанокристаллический катализатор с известной площадью поверхности и нужным распределением пор (г)
Путем покрытия нитчатых фагов золотом и двуокисью индия были получены электрохромные материалы — пористые нанопленки, меняющие цвет при изменении электрического поля, способные реагировать на изменение электрического поля в полтора раза быстрее известных аналогов. Подобного рода материалы перспективны для создания энергосберегающих ультратонких экранных устройств (Nam et al., 2012).
В Массачусетском технологическом институте бактериофаги стали основой для производства очень мощных и чрезвычайно компактных электрических батарей. Для этого использовали живые, генетически модифицированные фаги М13, неопасные для человека и способные присоединять к поверхности ионы различных металлов. В результате самосборки этих вирусов были получены структуры заданной конфигурации, которые при покрытии металлом сформировали достаточно длинные нанопровода, ставшие основой анода и катода. При самоформировании материала анода использовался вирус, способный присоединять золото и оксид кобальта, для катода — способный присоединять фосфат железа и серебро. Последний фаг также обладал способностью за счет молекулярного опознания «подхватывать» концы углеродной нанотрубки, что необходимо для обеспечения эффективного переноса электронов.
На основе комплексов бактериофага М13, двуокиси титана и одностенных углеродных нанотрубок были также созданы материалы для солнечных батарей (Dang et al., 2011).
Разработаны методы, позволяющие располагать нитчатые бактериофаги один за другим («хвост к хвосту»). Получающиеся в результате мультифаговые структуры представляют собой упорядоченные наноматрицы, которые могут быть использованы для создания транзисторных и диодных устройств.
Последние годы ознаменовались широкими исследованиями бактериофагов, которые находят себе все новые применения не только в терапии, но и в био- и нанотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Литература
1. Бактериофаги: биология и применение / Ред.: Э. Каттер, А. Сулаквелидзе. М.: Научный мир. 2012.
2. Стент Г., Кэлиндар Р. Молекулярная генетика. М.: Мир. 1974. 614 с.
3. Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acta Naturae. 2009. № 3. C. 6–15.
4. Mc Grath S., van Sinderen D. Bacteriophage: Genetics and Molecular Biology. Horizon Scientific Press, 2007.