Кто такой брюс бетлер
Бётлер Брюс Алан
Брюс Алан ( Bruce Alan Beutler ; род. в 1957 г., Чикаго, США), американский иммунолог и генетик, лауреат Нобелевской премии по физиологии и медицине (2011).
Родился в семье потомственных врачей. Родители отца, Кет Бётлер (урожденная Италиенер) и Альфред Давид Бётлер, с принятием нюрнбергских законов в 1935 г. были вынуждены бежать из Германии и поселились в Милуоки (штат Висконсин). Одним из их четверых детей был Эрнест Бётлер (1928–2008) — впоследствии известный гематолог и генетик, член Национальной академии наук США и Американской академии искусств и наук; Брюс Алан Бётлер — его сын. Родители матери, журналистки Брондел Мэй Флейшер, иммигрировали в США из Украины. После кончины Эрнеста Бётлера его вдова выделила средства на создание исследовательского центра его имени в медицинском центре «Рамбам» в Хайфе.
Брюс Бётлер в 1976 г. получил степень бакалавра в Калифорнийском университете в Сан-Диего, в 1981 г. — степень доктора медицины в Чикагском университете. В 1981–83 гг. проходил практику в Юго-Западном медицинском центре Техасского университета в Далласе. В 1983–85 гг. был стипендиатом Рокфеллеровского университета в Нью-Йорке, в 1985 г. стал там же старшим преподавателем. В 1986 г. вернулся в Техасский университет в Далласе, где получил должность старшего преподавателя на кафедре внутренних болезней. С 1986 г. был также научным ассистентом в Медицинском институте Говарда Хьюза, с 1996 г. — профессор.
В 2000 г. Бётлер переехал в Калифорнию и занял должность профессора кафедры иммунологии в Исследовательском институте Скриппса в Сан-Диего; в 2007 г. возглавил в этом институте кафедру генетики. В 2011 г. вернулся в Техасский университет в Далласе, где стал директором Центра генетики иммунной защиты.
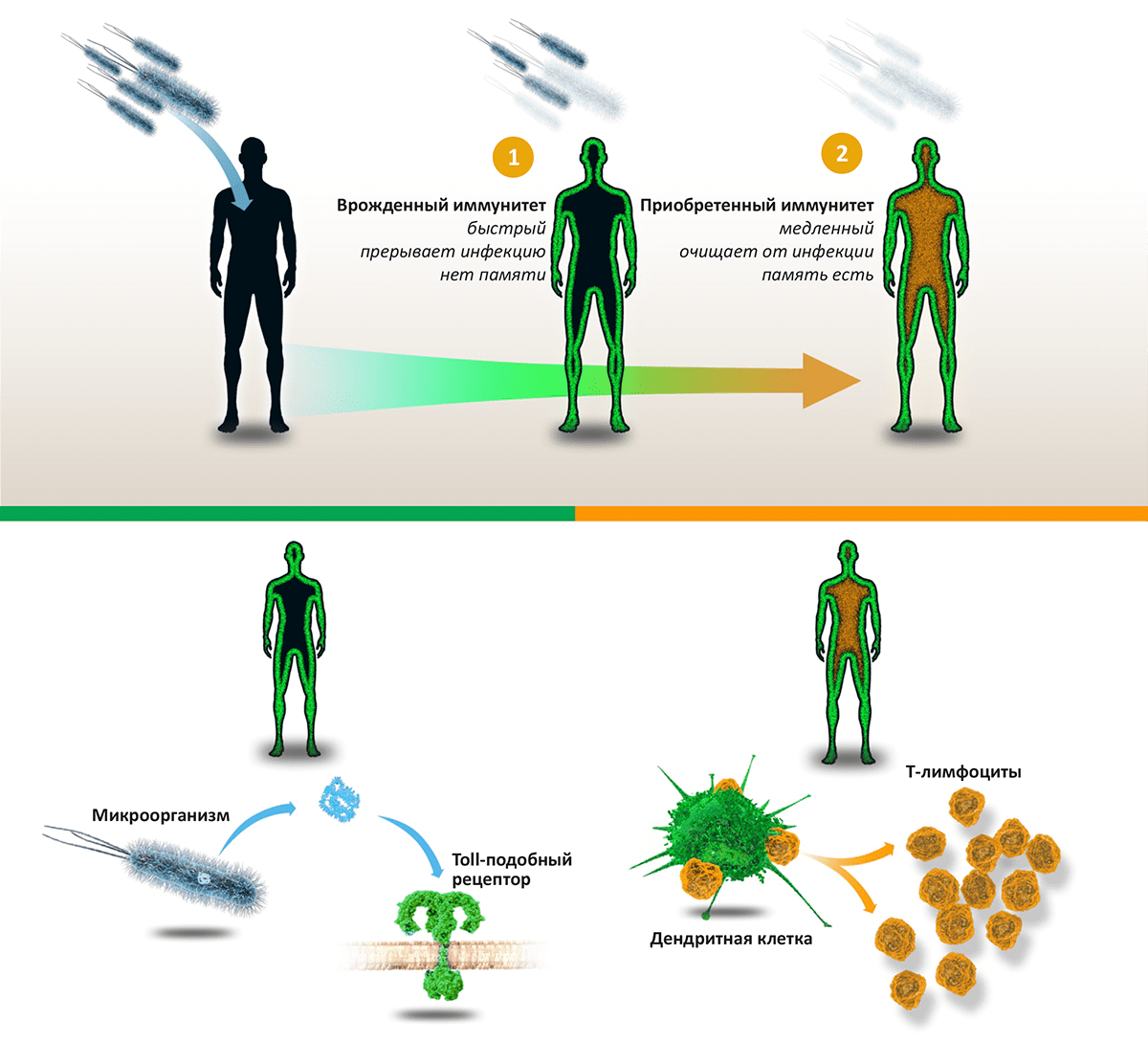
Исследования Бётлера и его коллег продемонстрировали, что проникновение в тело человека патогенных микроорганизмов — бактерий, вирусов или грибов — активирует две линии иммунной реакции: врожденный иммунитет (останавливает инфекцию) и приобретенный иммунитет (выводит инфекцию из организма). Компоненты микроорганизмов, такие как липополисахарид, связываются с толл-подобными рецепторами (toll-like receptor, TLR), находящимися на поверхности многих клеток организма, что запускает процесс активации врожденного иммунитета. Работы Бётлера позволили понять механизмы, активирующие врожденный иммунитет, а также открыли новые перспективы в лечении различных инфекций, рака и воспалительных заболеваний.
Бётлер — член Национальной академии наук США. Удостоен многих наград, в том числе премии Роберта Коха за заслуги в области биомедицинских исследований (2004), премии Шарля-Леопольда Майера Французской академии наук (2006), итальянской премии Бальцана (2007), присуждаемой в Гонконге премии Шао (2011) и др.
В 2011 г. Бётлеру (совместно с французским ученым люксембургского происхождения Жюлем Хоффманом) была вручена Нобелевская премия по физиологии и медицине «за исследование активации врожденного иммунитета».
Брюс Бётлер
[править] Научная карьера
Родился 29 декабря 1957 года в Чикаго одним из четверых детей в еврейской семье учёного Эрнеста Бётлера, родители которого с принятием Нюрнбергских расовых законов в 1935 году были вынуждены бежать из Германии и осели в Милуоки. Бабушка по отцовской линии, Кёт Бётлер (урождённая Италиенер), была частным врачом детей Магды Геббельс; её муж, Альфред Давид Бётлер, тоже врач. Родители матери Брюса, журналиста Брондел Мэй Флейшер, иммигрировали из Украины.
В 1976 году получил степень бакалавра искусств в Калифорнийском университете в Сан-Диего.
В 1981 году получил степень доктора медицины в Чикагском университете.
В 1981−1983 годах проходил медицинскую практику в Юго-западном медицинском центре Техасского университета в Далласе.
В 1983−1985 годах — стипендиат Рокфеллеровского университета в Нью-Йорке.
В 1984−1986 годах — врач-ассистент Рокфеллеровского университета в Нью-Йорке.
В 1985 году стал старшим преподавателем Рокфеллеровского университета в Нью-Йорке.
В 1986 году вернулся в университет Далласа, где получил должность старшего преподавателя на факультете медицины внутренних органов.
В 1996 году стал профессором.
В 1986−1991 годах — научный ассистент в Медицинском институте Говарда Хьюза.
В 1991 году получил должность младшего исследователя в Медицинском институте Говарда Хьюза.
С 2000 года — профессор и (с 2007 года) заведующий кафедрой генетики в Исследовательским институтом Скриппс в Ла-Хойе, штат Калифорния.
В 2011 году вместе с Ральфом Стайнманом и Жюлем Офманом стал лауреатом Нобелевской премии по физиологии и медицине «за исследование активации врождённого иммунитета».
В том же 2011 году вернулся в Техасский университет в Далласе, где стал директором Центра генетики иммунной защиты.
Кроме того, в 2004 году — лауреат премии Роберта Коха, в 2006 году — премии Вильяма Коли и премии Гран-При Шарля Леопольда Майера, в 2007 году — премии Бальцана, в 2009 году — премии медицинского центра Олбани и Ежегодной премии Института Уилла Роджерса в области исследований, в 2011 году — премии Шао.
Член Американского общества по клиническим исследованиям, Американской ассоциации врачей, Американской ассоциации иммунологов и Международного общества генома млекопитающих.
Его работы продемонстрировали, что проникновение в тело человека патогенных микроорганизмов — бактерий, вирусов или грибов — активирует две линии иммунной реакции: врожденный иммунитет (останавливает инфекцию) и приобретённый иммунитет (выводит инфекцию из организма). Компоненты микроорганизмов, такие как липополисахарид, связываются с толл-подобными рецепторами (toll-like receptor, TLR), расположенным на поверхности многих клеток организма, что запускает процесс активации врождённого иммунитета.
Кто такой брюс бетлер
Американский иммунолог и цитолог Брюс Алан Бойтлер родился 29 декабря 1957 года в Чикаго. В 1959 года семья Бётлеров переехала в южную Калифорнию, где Брюс прожил до 1977 года. Среднее образование получил в частной Политехнической школе Пасадены. В 18 лет получил степень бакалавра в Калифорнийском университете. Через год, в 1977 году, Бойтлер вернулся в Чикаго. В этом же году поступил в Чикагский университет на факультет медицине. В 1981 году получил степень доктора медицины.
С 1981 по 1983 Бойтлер занимался исследовательской деятельностью в Далласа в медицинском центре Техасского университета. После того два года усовершенствовал свои практические знания в лаборатории Энтони Керрами Рокфеллеровского университета. В 1985 году стал старшим преподавателем этого же университета.
В 1986 году Брюс Бойтлер вернулся в Даллас, где на протяжении 14 лет работал в терапевтическом отделение медицинского центра Техасского университета. В 1990 он получил звание адъюнкт-профессора, а спустя 6 лет и звание профессора. В 2000 году Брюс переехал в Научно-исследовательский институт Scripps в Ла-Хойе на должность профессора иммунологии. В 2007 он стал председателем Отдела Генетики в Scripps.
В 2011 году Брюс Бойтлер был удостоен Нобелевской премии по медицине и физиологии за “ работы по изучению активации врожденного иммунитета”.
Также награжден Премией Коха (2004), Премией Коули (2006), Премией Бальцана (2007, совместно с Жюлем Хоффманом), Премией Шоу (2011, совместно с Жюлем Хоффманом и Русланом Меджитовым).
Иммунологическая Нобелевская премия (2011)
Иммунологическая Нобелевская премия (2011)
Человеческая кровь содержит большинство клеточных и неклеточных факторов, определяющих иммунитет к бактериальным инфекциям
Автор
Редакторы
Иммунная система позволяет нам существовать в мире, полном патогенных микроорганизмов — вирусов, бактерий, грибов. Нобелевская премия по физиологии и медицине 2011 года вручена за открытия в области активации врожденного иммунитета (половину премии разделили Брюс Бётлер и Жюль Хоффман) и за изучение роли дендритных клеток в приобретенном иммунитете (вторая половина премии присуждена Ральфу Стайнману, к сожалению, скончавшемуся 30 сентября). Эти достижения не только дали понимание того, как слаженная работа врожденного и адаптивного иммунитета защищает организм, но и открыли новые перспективы в лечении инфекций, рака и воспалительных заболеваний.
Две линии иммунной обороны
Мы обитаем в мире, буквально кишащем патогенными микроорганизмами (бактериями, грибами, вирусами и паразитами), однако наши организмы оснащены совершенной системой защиты, позволяющей (в норме) не замечать опасного соседства. «Первая линия» иммунной обороны — врожденный иммунитет — уничтожает вторгшиеся в организм патогены на основе технологии «свой—чужой», распознавая черты, всегда присутствующие у «захватчиков», но отсутствующие в собственном организме. Если же инфекции удается прорваться, вступает в работу «вторая линия» — приобретенный, или адаптивный, иммунитет. Основанный на согласованной работе B- и T-лимфоцитов, он действует посредством специфических к конкретной инфекции антител и клеток-«убийц», уничтожающих зараженные клетки и саму инфекцию. В отличие от врожденного иммунитета, способность к распознаванию патогенов которого закодирована генетически, приобретенный иммунитет обучается распознавать новые «образы» врага и сохраняет память о нем, мгновенно «вспоминая», встретившись вновь.
Однако, обеспечивая необходимую защиту, иммунные механизмы скрывают и опасность: если «активационный барьер» слишком низок, иммунитет может активироваться собственными молекулами, что приводит к развитию аутоиммунных и воспалительных заболеваний.
Организация иммунной системы изучалась в течение XX века постепенно; в частности, нобелевскими премиями отмечены изучение строения антител и определение механизма распознавания Т-клетками инородных веществ. Однако только с работами Бётлера, Хоффмана и Стайнмана стали понятны механизмы, активирующие врожденный иммунитет и связывающие его с иммунитетом приобретенным.
Открытие сенсоров врожденного иммунитета
Пионерское открытие Жюля Хоффмана было сделано в 1996 году, когда он с коллегами исследовал, как дрозофила сопротивляется инфекциям [1]. Они работали на линиях мух, мутантных по нескольким генам, включая ген Toll, участвующий в эмбриональном развитии (за открытие роли этого гена также вручена Нобелевская премия в 1995 году). Хоффман с коллегами открыли, что мухи с мутантным геном Toll погибали при заражении бактериями или грибами, в то время как «дикий тип» чувствовал себя вполне сносно. В результате их работ был сделан вывод, что продукт этого гена — Toll-рецептор — «чувствует» патогенные микроорганизмы и запускает механизмы врожденного иммунитета.
Брюс Бётлер с коллегами, со своей стороны, искали рецепторы, которые могли бы активироваться элементом клеточной стенки бактерий липополисахаридом (ЛПС), который при попадании в кровь вызывает септический шок (чрезмерная активация иммунной системы, грозящая смертью). В 1998 году они обнаружили, что мыши, не реагирующие на введение ЛПС, имели мутации в гене, гомологичном Toll у дрозофил. Продукт этого гена — Toll-подобный рецептор — и оказался искомым сенсором липополисахарида [2]. Связывание ЛПС (обозначающее присутствие бактерий) активирует иммунитет и запускает воспаление, а чрезмерная концентрация ЛПС приводит к септическому шоку. Это открытие показало, что и членистоногие, и млекопитающие используют схожие стратегии противостояния бактериальным инвазиям.
Открытия Хоффмана и Бётлера фактически положили начало новой «горячей» области биологии: впоследствии было открыто более 10 Toll-подобных рецепторов, каждый распознающий свой «образ», характерный для разных групп микроорганизмов. Мутации в генах этих рецепторов увеличивают вероятность инфекционных заболеваний, а также хронических воспалительных болезней.
Рисунок 1. Схема работы иммунитета. Проникновение в тело человека патогенных микроорганизмов — бактерий, вирусов или грибов — активирует «две линии» иммунной реакции: врожденный иммунитет (останавливает инфекцию) и приобретенный иммунитет (выводит инфекцию из организма). Врожденный иммунитет: компоненты микроорганизмов, такие как липополисахарид, связываются с Toll-подобными рецепторами, находящимися на поверхности многих клеток организма. Это запускает врожденный иммунитет, активирующий воспалительную реакцию и уничтожающий «захватчиков». Приобретенный иммунитет: Дендритные клетки активируют T-лимфоциты, лежащие в основе каскада иммунных реакций, приводящих к синтезу антител и уничтожению патогенов и зараженных клеток.
Новый игрок в команде адаптивного иммунитета
Еще в 1973 году Ральф Стайнман открыл новый тип клеток иммунитета с длинными отростками, названный им дендритными клетками. Его предположение было — что эти клетки активируют T-лимфоциты, играющие ключевую роль в приобретенном иммунитете и иммунной памяти. Это предположение блестяще подтвердилось в клеточных экспериментах, где добавление дендритных клеток к популяции Т-лимфоцитов способствовало формированию иммунитета [3–5].
Дальнейшие работы Стайнмана и других исследователей были направлены на то, чтобы понять, как приобретенный иммунитет определяет, — надо ли реагировать на то или иное вещество, или можно этого не делать. Обнаружилось, что дендритные клетки воспринимают сигналы от системы врожденного иммунитета, и это управляет их способностью активировать T-клетки. Это позволяет нашему иммунитету прицельно бороться с патогенными микроорганизмами, «не обращая внимания» на молекулы нашего собственного тела.
Фундаментальные науки — медицине
Достижения нобелевских лауреатов 2011 года пролили свет на подробности работы систем врожденного и приобретенного иммунитета. Это знание легло в основу создания новых стратегий лечения многих болезней, — например, новых вакцин против инфекций и попыток «натравить» собственную иммунную систему на раковые опухоли. В дополнение к этому, стало понятно, почему организм иногда начинает атаковать свои собственные ткани, что приводит к воспалительным и аутоиммунным заболеваниям.
Горькая ирония
Как известно, Нобелевская премия не вручается посмертно. Однако этот год стал исключением: 30 сентября после продолжительной борьбы с раковой опухолью скончался Ральф Стайнман, — буквально за несколько дней до объявления лауреатов премии. Нобелевский комитет не знал об этом, и обнародовал свое решение 3 октября. Несмотря на этот печальный казус, решение менять не будут. Работы Стайнмана легли в основу терапии дендритными клетками — перспективного способа лечения воспалительных и онкологических заболеваний. К сожалению, самому ему оказалось суждено стать жертвой такого заболевания [6], [7].
И снова мимо.
Сегодня интернет пестрит сообщениями, что опять — в который уже раз! — Нобелевский комитет обошел своим решением российских ученых. Речь идет о российском эмигранте Руслане Меджитове [8], который, вместе со своим (ныне уже покойным) учителем Чарльзом Дженуэем показал, что и у людей существуют Toll-подобные рецепторы [9]. Если бы Дженуэй был жив, то, скорее всего, именно он был бы третьим лауреатом премии (вместо Стайнмана), а сама премия была бы конкретно за врожденный иммунитет.
Нобелевская премия по физиологии и медицине 2011 года
В этом году лауреатами Нобелевской премии по физиологии и медицине стали сразу трое учёных: Брюс Бетлер (Bruce Beutler), Жюль Хоффманн (Jules Hoffmann) и Ральф Cтейнман (Ralph Steinman). Всем им премия была присуждена за исследования систем врожденного и приобретенного иммунитета, благодаря которым живые организмы могут бороться за свое место под солнцем в мире, полном опасных бактерий, вирусов и других патогенов. Планировалось, что половину денежной награды общим размером в 10 млн. шведских крон (1,4 млн. долларов США) разделят между собой Брюс Бётлер и Жюль Хоффманн, а вторую половину (5 млн. шведских крон) торжественно вручат Ральфу Стейнману за его вклад в изучение дендритных клеток и их роли в регуляции адаптивного иммунного ответа. Однако, к сожалению, 30 сентября была обнародована новость о кончине 68-летнего учёного от рака поджелудочной железы. Исследователь не дожил до радостной новости всего нескольких дней. Ральф Стейнман родился в Монреале (Канада) в 1943 году, здесь же активно изучал биологию и химию. С 1988 года он являлся профессором иммунологии в Университете Рокфеллера в Нью-Йорке (США), а также директором Центра иммунологии и иммунных болезней этого учебного заведения. Согласно правилам, Нобелевская премия не присуждается посмертно, но в этот раз для Стеймана было сделано исключение, и он сохранил за собой звание лауреата.
Жителям России особенно приятно будет узнать (а тем, кто уже знает – вспомнить), что первая Нобелевская премия в области физиологии и медицины за исследования иммунитета была присуждена русско-французскому биологу Илье Ильичу Мечникову в 1908 году. Он лично настоял на том, чтобы награда была отнесена в копилку российских, а не французских достижений. Но, к величайшему сожалению, повторить успеха Мечникова нашим учёным-медикам с тех пор ни разу не удалось, Нобелевская премия по физиологии в России всего одна. В 1882 году Илья Ильич обнаружил явление фагоцитоза и разработал на основе его изучения сравнительную патологию воспаления, а в дальнейшем и фагоцитарную теорию иммунитета, за что и был премирован совместно с Паулем Эрлихом.
Брюс Бетлер и Жюль Хоффманн удостоились награды за исследования врождённого иммунитета. Он представляет собой самую древнюю форму иммунитета: защитную реакцию организма на внешнее вторжение по типовым антигенам, то есть веществам, характерным для опасных организмов. Врождённая защита присутствует у всех животных и растений, а у некоторых групп организмов (например, насекомых) является основной. На её вооружении есть клеточный компонент (фагоциты, гранулоциты) и гуморальный (лизоцим, интерфероны, система комплемента, медиаторы воспаления). Полем битвы между патогенами и защитниками организма становятся очаги воспаления. Бетлер и Хоффманн исследовали, как включается эта система и как она после этого функционирует. Учёные, в частности, доказали, что опасные для организма бактерии распознаются иммунной системой благодаря находящимся на поверхности бактериальных клеток сложным молекулам – липополисахаридам.
Работы Хоффмана, Бётлера и Стейнмана в совокупности с исследованиями других ученых позволили ещё лучше понять, каковы механизмы работы иммунной системы. Новые знания, как ожидается, помогут разработать более эффективные стратегии вакцинации, дадут возможность изучить природу аутоиммунных заболеваний и научиться активировать дендритные клетки в целях борьбы с раком.