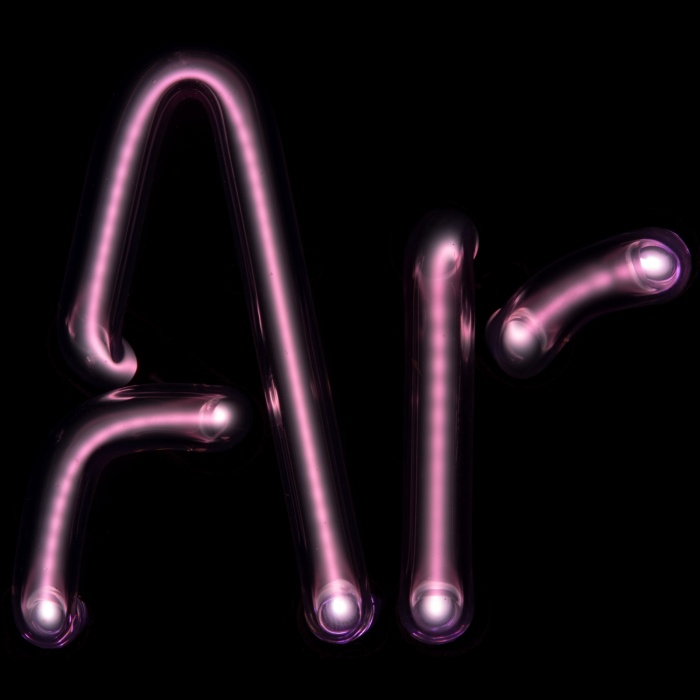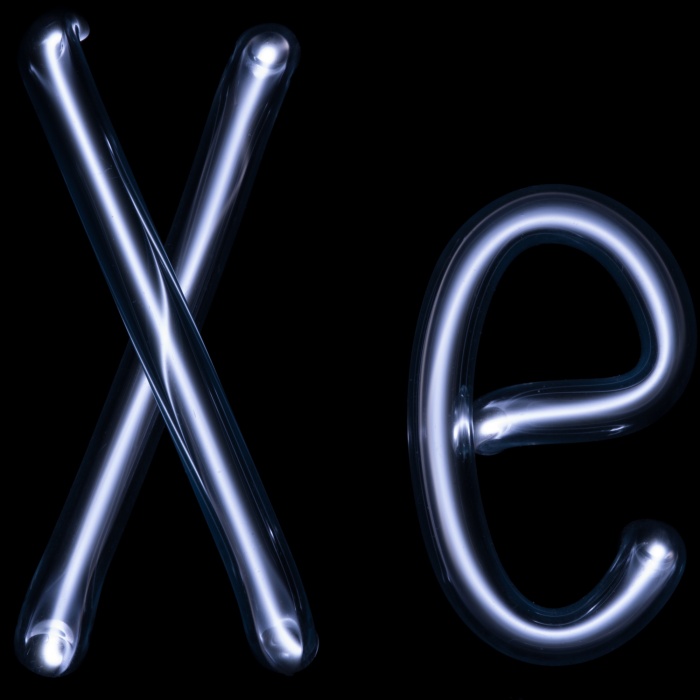С чем реагируют инертные газы
Почему гелий меняет наш голос, а также что такое инертные газы
Инертные газы:
На уроках химии мы слышали об инертных газах. Их еще называют благородными, такое красивое название было дано не с проста, ведь все инертные газы, а именно гелий, неон, аргон, криптон, ксенон, а также радиоактивные радон и оганесон обладают очень низкой химической активностью, их соединения с другими веществами существуют лишь в специальных, экстремальных условиях, а значит, эти газы не горят и не поддерживают горение, более того, не имея цвета, запаха и вкуса они не токсичны для человека, их вообще как будто нет, настоящее благородство!)
Но это не совсем так, инертные газы хоть и не отравляют человека, но наркотически действуют на него, однако это не относится к гелию и неону, поскольку их наркотический эффект проявляется при очень повышенном давлении, впрочем, поэтому наркоманы и не дышат шариками с гелием.
Интересным фактом является то, что инертные газы переходят в жидкое состояние при экстремально низких температурах, при этом почти сразу после переходя в твердое состояние. Таким образом разница между температурой кипения и плавления у веществ состовляющих инертные газы 2-5, максимум 10 градусов.
Гелий и его свойства:
Вообще гелий удивителен. Во Вселенной он второй по распространенности после водорода, но на Земле существует в совсем малых количествах, однако не беспокойтесь, на надувание шариков всем хватит). Из за практически самого малого размера атомов гелия, они почти не сталкиваются друг с другом, когда гелий находится в газообразном состоянии, что делает гелий идеальным газом (идеальный газ это такая теоретическая модель, можете посмотреть о ней в Википедии подробнее).
Еще одна занимательная вещь, что гелий, как и все инертные газы светится при пропускании через него электрического тока. Причем при изменении давления внутри газа, можно менять его цвет. Это связанно с тем, что с увеличением давления, электроны начинают чаще сталкиваться с атомами гелия и общая энергия вещества увеличивается, приводя к изменению цвета. Так гелий может светиться желтым, розовым, оранжевым и зеленым цветами.
Почему гелий изменяет голос?
Но мы то все знаем гелий как веселый газ, смешно изменяющий наш голос. Почему так происходит? Тут нужно разобраться, что вообще такое звук, издаваемый нами при выдохе.
По простому звук есть колебание молекул или других мельчайших частиц среды, улавливаемое нашим ухом. Такой средой является воздух. Когда мы издаем какие либо звуки, наши голосовые связки вибрируют, создавая колебания среды, то есть воздуха. Чем чаще колеблятся связки, тем выше высота звука. Если мы вдохнем вместо воздуха гелий, он станет средой для распространения звука. Но из за гораздо меньшей плотности гелия, он создает меньшее давление на голосовые связки, чем воздух, позволяя им вибрировать быстрее и издавать более тонкий звук.
Так, для понижения голоса можно вдохнуть плотный газ, например фторид серы, он в 5 раз тяжелее воздуха и сильно понижает частоту колебаний голосовых связок.
Благородные, или инертные газы: свойства и применение
Инертные газы — группа элементов в таблице Менделеева, 
На нашей планете благородные газы преимущественно содержатся в воздухе, но они есть в небольших количествах в воде, горных породах, природных газах и нефти.
Много гелия в космическом пространстве, это второй по распространенности элемент после водорода. В Солнце его почти 10%. Судя по имеющимся данным, благородных газов много в атмосферах крупных планет Солнечной системы.
Все газы, кроме гелия и радона, добывают из сжиженного воздуха фракционным разделением. Гелий получают как сопутствующий продукт при добыче природного газа.
Свойства

Гелий и неон вступают в реакции только при определенных, как правило, очень сложных условиях; для ксенона, криптона и радона удалось создать достаточно «мягкие» условия, при которых они реагируют, например, со фтором. В настоящее время химики получили несколько сотен соединений ксенона, криптона, радона: оксиды, кислоты, соли. Большая часть соединений ксенона и криптона получают из их фторидов. Скажем, чтобы получить ксенонат калия, сначала растворяют фторид ксенона в воде. К полученной кислоте добавляют гидроокись калия и тогда уже получают искомую соль ксенона. Аналогично получают ксенонаты бария и натрия.
Инертные газы не ядовиты, но способны вытеснять кислород из воздуха, понижая его концентрацию до смертельно низкого уровня.
Смеси тяжелых благородных газов с кислородом оказывают на человека наркотическое воздействие, поэтому при работе с ними следует использовать средства защиты и строго следить за составом воздуха в помещении.
Хранят газы в баллонах, вдали от источников пламени и горючих материалов, в хорошо проветриваемых помещениях. При транспортировке баллоны следует хорошо укрепить, чтобы они не бились друг о друга.
Инертные газы

Инертные газы (благородные газы) – элементы, образующие 18 группу ПС (в короткопериодном варианте – главную подгруппу 8 группы): гелий He (атомный номер 2), неон Ne (Z = 10), аргон Ar (Z = 18) криптон Kr (Z = 36), ксенон Xe (Z = 54) и радон Rn (Z = 86). Инертные газы постоянно присутствуют в воздухе (в 1 м 3 воздуха их содержится около 9,4 литров, главным образом Ar). Состав же воздуха ученые анализировали уже со второй половины 18 века. Однако обнаружить инертные газы долгое время не удавалось. Из-за своей химической пассивности они никак не проявляли себя в обычных реакциях и ускользали из поля зрения исследователей. Только после открытия спектрального анализа были открыты сначала гелий и аргон, а затем и другие инертные газы. В начале 20 века человечество с удивлением узнало, что воздух, такой привычный и, казалось, изученный, содержит 6 неизвестных ранее элементов. 
Инертные газы находятся в растворенном виде в воде, содержатся в некоторых горных породах. Гелий иногда входит в состав подземных газов. Такие газы являются его единственным промышленным источником. Неон, аргон, криптон и ксенон добывают из воздуха в процессе его разделения на азот и кислород.
Источником Rn служат препараты урана, радия и других радиоактивных элементов. Хотя и все инертные газы, кроме радона, стабильны, их происхождение во многом связано с радиоактивностью. Так, ядра гелия, иначе называемые ɑ-частицами, постоянно образуются в результате радиоактивного распада урана или тория. Аргон-40, преобладающий в природной смеси изотопов аргона, возникает при радиоактивном распаде изотопа калия-40. Наконец, происхождение большей части земных запасов Xe обусловлено, вероятно, самопроизвольным делением ядер урана.
Все инертные газы не имеют ни цвета, ни запаха. Внешние электронные оболочки их атомов содержат максимально возможное для соответствующих внешних оболочек число электронов: 2 у гелия и по 8 у остальных. Такие оболочки обладают высокой устойчивостью. С этим связана, во-первых, химическая пассивность инертных газов по отношению к другим элементам. А во-вторых, неспособность их атомов вступать в связь друг с другом, вследствие чего молекулы их одноатомны. Инертные газы, особенно легкие, трудно перевести в жидкое состояние. Попробуем разобраться. Почему это так. Молекулы других газов либо представляют собой постоянные диполи, как, например, HCl, либо легко становятся диполями (Cl2). У постоянных диполей «центры тяжестей» положительного и отрицательного зарядов постоянно не совпадают между собой. Образование же диполя в молекулах типа Cl2 связано со смещением в них «центров тяжести» зарядов друг относительно друга под воздействием внешних сил, в частности под действием электрических полей соседних молекул. Таким образом, и в молекулах HCl, и в молекулах Cl2 между разноименным полюсами диполей существуют силы электростатического притяжения. При определенных пониженных температурах этих сил оказывается достаточно, чтобы удержать молекулы друг возле друга. У атомов инертных газов расположение электронов вокруг ядер строго сферическое. Поэтому соседние атомы не могут вызвать смещение «центров тяжести» электрических зарядов в их атомах и привести к образованию «наведенного» диполя, как в молекулах хлора. Таким образом, ни постоянных, ни наведенных диполей в атомах инертных газов нет. А раз так, то и силы притяжения между ними при нормальных условиях практически отсутствуют. Однако ввиду постоянных колебаний атомов, «центры» зарядов могут на мгновение сместиться в разные стороны атома. Возникающие при образовании этого мгновенного диполя силы электростатического притяжения очень малы, однако при очень низких температурах их хватает для того, чтобы сконденсировать эти газы.
Долгое время попытки получить обычные химические соединения инертных газов, оканчивались неудачами. Положить конец представлениям об абсолютной химической недеятельности инертных газов удалось канадскому ученому Н. Бартлетту, который в 1962 году сообщил о синтезе соединения ксенона с гексафторидом платины PtF6. Полученное соединение ксенона имело состав Xe[PtF6]. В последующие годы было синтезировано большое количество и других соединений радона, ксенона и криптона.
Давайте рассмотрим поподробнее химические свойства инертных газов.
Ксенон
Из-за своей малой распространенности ксенон гораздо дороже более легких благородных газов. Для получения 1 м 3 ксенона необходимо переработать 10 млн м 3 воздуха. Таким образом, ксенон является редчайшим газом земной атмосферы.
При взаимодействии ксенона со льдом под давлением получен его гексагидрат Xe∙6H2O. Под давлением при кристаллизации фенола выделено другое клатратное соединения с фенолом Xe∙6C6H5OH. Получены и охарактеризованы триокисд ксенона XeO3 в виде бесцветных кристаллов и тетраокстд XeO4 в виде газа как чрезвычайно взрывчатые вещества. При 0°C происходит диспропорционирование:
2XeO3 = XeO4 + Xe + O2
При взаимодействии с водой тетраоксида ксенона, где ксенон в степени окисления +8, образуется сильная перксеноновая кислота H4XeO6, которую не смогли выделить в индивидуальном состоянии, но получили соли – перксенаты щелочных металлов. Только соли калия, рубидия и цезия оказались растворимы в воде.
Газообразный ксенон вступает в реакцию с гексафторидом платины PtF6 с образованием гексафторплатината ксенона Xe[PtF6]. При нагревании в вакууме он взгоняется без разложения, а в воде гидролизуется с выделением ксенона:
2Xe[PtF6] + 6H2O = 2Xe + O2 + 2PtO2 + 12HF
XeF4 + 2Hg = Xe + 2HgF2
XeF4 + 2Pt = Xe + 2PtF4
В результате гидролиза XeF4 образуется неустойчивый XeO3, разлагающийся на воздухе со взрывом.
Получены также XeF2 и XeFб, последний из которых распадается со взрывом. Он чрезвычайно активен, легко реагирует с фторидами щелочных металлов:
XeF6 + RbF = Rb[XeF7]
Радон
Радон образует клатраты, которые хотя и имеют постоянный состав, но химических связей с участием радона в них нет. Известны гидраты Rn∙6H2O, аддукты со спиртами, например Rn∙2C2H5OH и др. С фтором радон при высоких температурах образует соединения состава RnFn, где n = 4, 6, 2.
Криптон
KrF2 + 2HCl = Kr + Cl2 + 2HF
2KrF2 + 2H2O = 2Kr + O2 + 4HF
Получить соединения более легких инертных газов не удалось. Теоретические расчеты показали, что соединения аргона, может быть, и будут синтезированы, а вот у гелия и неона их получить нельзя.
Благородные (инертные) газы.
Благородные газы (инертные либо редкие газы) — группа химических элементов с похожими свойствами: при нормальных условиях они являются одноатомными газами. Это химические элементы, которые образуют главную подгруппу 8-й группы периодической системы Менделеева.
Среди всех благородных газов лишь у Rn нет стабильных изотопов и только он является радиоактивным химическим элементом.
Редкими (инертными) газами являются:
В последнее время к этой группе также причисляют унуноктий (Uuo) (118).
Все инертные газы собой завершают соответствующий период в Периодической системе и имеют полностью завершенный, устойчивый внешний электронный уровень.
У инертных газов электронная конфигурация ns 2 np 6 (у гелия 1s 2 ) и они образуют VIIIА группу. С возрастанием порядкового номера увеличиваются радиусы атомов и их способность к поляризуемости, что приводит к увеличению межмолекулярных взаимодействий, к увеличению Тпл и Ткип, к улучшению растворимости газов в воде и других растворителях. Для инертных газов существуют такие известные группы соединений: молекулярные ионы, соединения включения, валентные соединения.
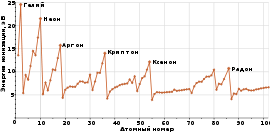
Цвета и спектры инертных газов.
Цвета и спектры благородных газов. В первой строке таблицы изображены благородные газы в колбах, через которые пропущен ток, во второй — сам газ в трубке, в третьей — в трубках, которые изображают обозначение элемента в периодической таблице Менделеева.
Гелий
Неон
Аргон
Криптон
Ксенон
Распространенность инертных (редких) газов в природе.
Из-за того, что инертные газы обладают химической инертностью, их довольно долго не получалось обнаружить, и их открытие состоялось лишь во 2-й половине XIX века.
Гелий – является вторым (после водорода) по распространенности элементом во Вселенной, в земной коре содержание гелия составляет лишь 1 · 10-6 масс. %. Гелий является продуктом радиоактивного распада и содержится в пустотах горных пород и в природном газе.
Все благородные газы являются составляющими воздуха. В 1 м 3 воздуха находится 9,3 л аргона, 18 мл неона, 5 мл гелия, 1 мл криптона и 0,09 мл ксенона. Солнце приблизительно на 10% состоит из гелия, образующийся из водорода по реакции ядерного синтеза:
В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Промышленное использование инертных газов основано на их низкой химической активности или специфических физические свойствах.
Некоторые характеристики элементов VIIIА подгруппы (инертных газов).
Элемент
Радиус атома, нм
Первый потенциал ионизации, эВ
Tпл., K
Tкип., K
Относительная поляризуемость атома, усл. ед.
Энергия возбужденного электрона, эВ
Инертные газы
Содержание
Химические свойства
Физические свойства
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Биологическое действие
Вдыхание радиоактивного радона может вызвать рак.
Применение
Инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. В частности, жидкий гелий, который кипит при 4,2 К (−268,95 °C; −452,11 °F), используется для магнитной сверхпроводимости, которая используется для магнитно-резонансной томографии и ядерного магнитного резонанса. Жидкий неон хотя и не достигает таких низких температур как жидкий гелий, также находит применение в криогенике, потому что у него охлаждающие свойства более чем в 40 раз выше, чем у жидкого гелия и более чем в три раза выше, чем у жидкого водорода.
Гелий используется как компонент дыхательного газа (дыхательной смеси) вместо азота, благодаря пониженной растворимости в жидкостях, особенно в липидах. Газы поглощаются кровью и биологическими тканями, когда они находятся под давлением, как например в подводном плавании, что является причиной эффекта, известного как азотное отравление. Благодаря меньшей растворимости, маленький гелий задерживается клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Пониженная растворимость гелия даёт другие выгоды в условии, известном как декомпрессионная болезнь. Уменьшение остатка растворённого газа в теле означает, что меньшее количество газовых пузырьков образуется во время всплытия. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму [6] для подводного плавания, а также в больших количествах используется для обработки жидкой стали.
После крушения дирижабля Гинденбург в 1937, гелий заменил водород в качестве поднимающего газа в дирижаблях и воздушных шарах благодаря лёгкости и невоспламеняемости, несмотря на 8,6 % уменьшение плавучести (buoyancy).