Сальметерол или формотерол что лучше
Тройная терапия двумя длительно действующими бронходилататорами и ингаляционным глюкокортикостероидом при ХОБЛ
Пациентам с тяжелым и очень тяжелым течением хронической обструктивной болезнилегких (ХОБЛ) и высоким риском обострений,не отвечающим на лечение двумя длительно действующими бронходилататорами или бронходилататором в комбинации сингаляционным глюкокортикостероидом (ИГКС), рекомендуется тройная терапия длительно действующим антихолинергическим препаратом (ДДАХ), длительно действующим b2-агонистом (ДДБА) и ИГКС. В рандомизированных клинических исследованиях тройная терапия вызывала достоверное снижение частоты средне-тяжелых и тяжелых обострений ХОБЛ, уменьшение степени бронхиальной обструкции и улучшение качества жизни по сравнению со всеми другими схемами терапии. Приведены результаты нескольких крупных контролируемых исследований (TRILOGY, TRINITY, TRIBUTE), в которых были установлены эффективность и безопасность фиксированного комбинированного препарата, содержащего экстра мелкодисперсный беклометазона дипропионат, формотерола фумарат и гликопиррония бромид у больных ХОБЛ тяжелого и очень тяжелого течения.
Хроническая обструктивная болезнь легких (ХОБЛ) остается одной из ведущих причин заболеваемости и смертности во всем мире [1], причем в ближайшие десятилетия ожидается дальнейший рост распространенности этого заболевания за счет продолжающегося воздействия факторов риска и постарения населения [2]. По данным программы Burden of Obstructive Lung Diseases (BOLD) и других крупных эпидемиологических исследований, расчетное число случаев ХОБЛ в мире в 2010 году составило 384 млн, а распространенность – 11,7% [3]. Ежегодно от ХОБЛ умирают около 3 млн человек [4], а по прогнозу ВОЗ к 2030 году этот показатель может увеличиться до 4,5 млн человек [5]. В странах Европейского Союза и США прямые затраты системы здравоохранения, связанные с ХОБЛ, достигают 39 млрд евро и 32 млрд долларов, соответственно [6,7]. Основной причиной экономического бремени ХОБЛ являются обострения заболевания, доля которых в структуре общих затрат достигает 40-75% [8,9].
Обострения ХОБЛ
Обострение ХОБЛ характеризуется острым ухудшением респираторных симптомов, которое выходит за рамки их обычных колебаний и приводит к изменению проводимой терапии [10,11]. Выделяют легкие (могут быть купированы самим пациентом с помощью короткодействующих бронходилататоров), средне-тяжелые (необходимо лечение короткодействующими бронходилататорами и антибиотиками и/или пероральными глюкокортикостероидами) и тяжелые (требуется госпитализация или обращение за неот ложной помощью) обострения. Следует отметить, что существующие критерии диагностики обострения ХОБЛ неспецифичны, поэтому некоторые авторы, помимо нарастания одышки (на 5 и более по визуальной аналоговой шкале от 0 до 10), предлагают учитывать дополнительные признаки, такие как снижение сатурации кислородом по крайней мере на 4% по сравнению с исходной, повышение числа нейтрофилов (≥9000 в мм3) или эозинофилов (≥2%) в крови и концентрации С-реактивного белка (≥3 мг/л) при отсутствии признаков пневмонии или отека легких на рентгенограммах грудной клетки [12]. Частота и тяжесть обострений увеличиваются по мере прогрессирования ХОБЛ. Например, в проспективном исследовании ECLIPSE (n=2138) по крайней мере два средне-тяжелых или тяжелых обострения в течение первого года наблюдения отмечались у 22%, 33% и 47% пациентов со 2, 3 и 4 стадиями ХОБЛ, соответственно [13]. Самым надежным предиктором обострений была их частота в анамнезе.
Результаты некоторых исследований свидетельствуют о том, что эозинофилия крови может ассоциироваться с увеличением риска обострений ХОБЛ и позволяет предсказать эффективность ингаляционных глюкокортикостероидов (ИГКС) в их профилактике. Например, в датском исследовании более чем у 7000 пациентов с ХОБЛ увеличение числа эозинофилов в крови сопровождалось почти двукратным повышением риска тяжелых обострений заболевания [14]. При анализе post hoc результатов клинических исследований было показано, что более высокое число эозинофилов в крови сочеталось с увеличением частоты обострений у больных ХОБЛ, получавших длительно действующие агонисты b2-адренорецепторов (ДДБА), а эффективность комбинированной терапии ДДБА/ИГКС была выше у пациентов с эозинофилией крови [15,16]. В то же время в когортном исследовании SPIROMICS ассоциация между эозинофилией крови и частотой или тяжестью обострений ХОБЛ отсутствовала, однако эозинофилия мокроты позволяла выделить пациентов с более тяжелым течением заболевания, частыми обострениями и более выраженной эмфиземой [17]. S. Cheng провел мета-анализ 5 исследований в целом у 12496 пациентов со средне-тяжелой и тяжелой ХОБЛ, у 60% из которых число эозинофилов в крови составляло ≥2% [18]. У пациентов с эозинофилией крови лечение ИГКС привело к снижению частоты обострений ХОБЛ на 17% (р=0,03), но ассоциировалось с двукратным увеличением риска пневмонии. В целом имеющиеся данные свидетельствуют о том, что эозинофилия крови является перспективным биомаркером у больных ХОБЛ, хотя ее роль как предиктора ответа на ИГКС необходимо подтвердить в проспективных клинических исследованиях [19].
Повторные обострения ХОБЛ приводят к ухудшению показателей функции дыхания и газообмена, более быстрому прогрессированию заболевания, снижению качества жизни больных и увеличению смертности, поэтому профилактика обострений является одной из основных целей лечения [20].
Стратегия медикаментозной терапии ХОБЛ
В настоящее время нет убедительных доказательств того, что какие-либо лекарственные средства позволяют замедлить прогрессирующее снижение объема форсированного выдоха за 1 с (ОФВ1) или снижают смертность больных ХОБЛ, однако медикаментозная терапия уменьшает симптомы заболевания, снижает частоту и тяжесть обострений, улучшает толерантность к физи чес кой нагрузке и качество жизни [10,11]. Препаратами выбора в лечении ХОБЛ остаются ингаляционные бронходилататоры, в том числе ДДБА и длительно действующие антихолинергические препараты (ДДАХ). ИГКС при ХОБЛ назначают только в дополнение к терапии длительно действующими бронхолитиками. Теофиллин и рофлумиласт, ингибирующий фосфоди эс те разу-4 и обладающий противовоспалительной активностью, применяют относительно редко (при неэффективности стандартной терапии). Эффект ДДБА продолжается в течение 12 ч (формотерол, салметерол) или 24 ч (индакатерол, олодатерол, вилантерол). ДДАХ также оказывают действие в течение около 12 ч (аклидиний) или 24 ч (гликопирроний, тиотропий, умеклидиний).
В настоящее время широко используются ком би ни рованные ингаляционные препараты, в состав которых входят ДДБА/ИГКС или ДДБА/ДДАХ (табл. 1). Разработаны также тройные комбинированные препараты, содержащие ДДБА/ДДАХ/ИГКС, в том числе беклометазона дипропионат/формотерол/гликопир роний и вилантерол/флутиказона фуроат/умеклидиний (в Российской Федерации они пока не зарегистрированы). В состав первого, как и фиксированной ком би нации беклометазона дипропионата и формотерола, входит экстра мелко дис персный беклометазона дипропионат (средний аэродинамический диаметр частиц 1,1 мкм). Основные преимущества ингаляции частиц лекарственного вещества малого размера – увеличение их отложения в легких (30-35% против 10-20% при применении стандартных ингаляторов) и уменьшение депозиции в ротоглотке. Доза экстрамелкодисперсного ИГКС в составе препарата (100 мкг) в 2,5 раза ниже стандартной дозы в неэкстрамелкодисперсных препаратах (250 мкг). Результаты ряда исследований у пациентов с бронхиальной астмой подтверждают, что применение экстрамелкодисперсных аэрозолей позволяет улучшить доставку препарата в малые дыхательные пути и повысить эффективность лечения, а также снизить суточную дозу ИГКС [21,22].
| Группы | Препараты |
|---|---|
| Короткодействующие | Сальбутамол |
| β2-агонисты | Фенотерол |
| Длительно действующие | Вилантерол |
| β2-агонисты (ДДБА) | Индакатерол |
| Салметерол | |
| Олодатерол | |
| Формотерол | |
| Короткодействующие антихолинергические препараты (КДАХ) | Ипратропий |
| Длительно действующие | Аклидиний |
| антихолинергические препараты | Гликопирроний |
| Умеклидиний | |
| Ингаляционные | Беклометазона дипропионат |
| глюкокортикостероиды (ИГКС) | Будесонид |
| Мометазон | |
| Флутиказона пропионат | |
| Флутиказона фуроат | |
| Циклесонид | |
| Фиксированные комбинации | Гликопирроний/индакатерол |
| ДДАХ/ДДБА | Тиотропий/олодатерол |
| Умеклидиний/вилантерол | |
| Аклидиния бромид/формотерол | |
| Фиксированные комбинации | Беклометазона |
| ИГКС/ДДБА | дипропионат/формотерол |
| Будесонид/формотерол | |
| Флутиказона пропионат/ | |
| салметерол | |
| Флутиказона пропионат/ вилантерол | |
| Фиксированные комбинации | Беклометазона дипропионат/ |
| ИГКС/ДДБА/ДДАХ | формотерол/гликопирроний |
| Вилантерол/флутиказона | |
| фуроат/умеклидиний | |
| Ингибиторы фосфодиэстеразы-4 | Рофлумиласт |
| Другие | Теофиллин |
Лечение стабильной ХОБЛ обычно начинают с монотерапии бронходилататором длительного действия (ДДАХ или ДДБА). В двух прямых сравнительных исследованиях ДДАХ превосходил ДДАБ по эффективности в профилактике обострений ХОБЛ [23,24], поэтому в рекомендациях GOLD 2019 года у пациентов с высоким риском обострений (группа С) предпочтение отдается препаратам первой группы [10]. При наличии выраженных симптомов и повторных обострений (по крайней мере 2 среднетяжелых обострения в течение 1 года или хотя бы 1 тяжелое обострение, потребовавшее госпитализации) (группа D) возможна стартовая комбинированная терапия ДДАХ/ДДБА [10]. У пациентов с ХОБЛ, сочетающейся с бронхиальной астмой, обоснована комбинированная терапия ДДБА/ИГКС. Доводом в пользу применения ИГКС в составе двойной терапии может также служить высокое число эозинофилов крови. При недостаточной эффективности ДДБА/ ДДАХ или ДДБА/ИГКС рекомендуется тройная терапия двумя длительно действующими бронходилататорами и ИГКС, которая может проводиться с использованием фиксированной комбинации ДДАХ/ ДДБА и отдельного ингалятора ИГКС или фиксированной комбинации ДДБА/ИГКС и отдельного ингалятора ДДАХ. Как указано выше, разработаны также фиксированные комбинация всех трех препаратов.
Эффективность и безопасность тройной комбинированной терапии у пациентов с ХОБЛ
В последние годы опубликованы результаты крупных контролируемых клинических исследований, которые подтвердили преимущества тройной комбинированной терапии экстрамелкодисперсным беклометазона дипропионатом/формотерола фумаратом/гликопиррония бро мидом (БДП/ФФ/ГБ) перед другими схемами лечения у пациентов с ХОБЛ тяжелого и очень тяжелого течения.
TRILOGY. Целью двойного слепого, рандомизированного контролируемого исследования TRILOGY было сравнение эффективности и безопасности фиксированной комбинации БДП/ФФ/ГБ и фиксированной комбинации БДП/ФФ у 1368 пациентов с ХОБЛ, у которых отмечались тяжелая бронхиальная обструкция (ОФВ1 после ингаляции бронходилататора 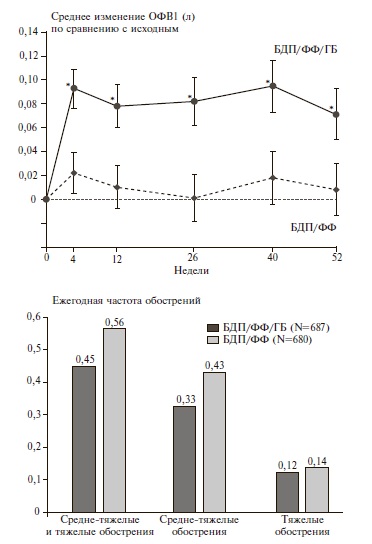
Переносимость двух схем терапии была сопоставимой, а частота пневмонии была низкой (3%) и не отличалась между двумя группами. Таким образом, у больных с ХОБЛ тяжелого или очень тяжелого течения и высоким риском обострений комбинированная терапия БДП/ФФ/ГБ достоверно превосходила терапию БДП/ФФ по бронходилатирующему действию, влиянию на качество жизни и эффективности в профилактике средне-тяжелых и тяжелых обострений и не отличалась по безопасности. Резуль таты исследования TRILOGY обосновывают присоединение ДДАХ к терапии ИГКС/ДДБА в случае недостаточной эффективности последней.
TRINITY. В двойном слепом, рандомизированном клиническом исследовании TRINITY были сопоставлены эффективность и безопасность фиксированной комбинации БДП/ФФ/ГБ, монотерапии длительно действующим ДДАХ тиотропием и комбинации БДП/ФФ с тиотропием у 2691 пациента с ХОБЛ [26]. В исследование включали пациентов с выраженными бронхиальной обструкцией (ОФВ1 после ингаляции бронходилататора 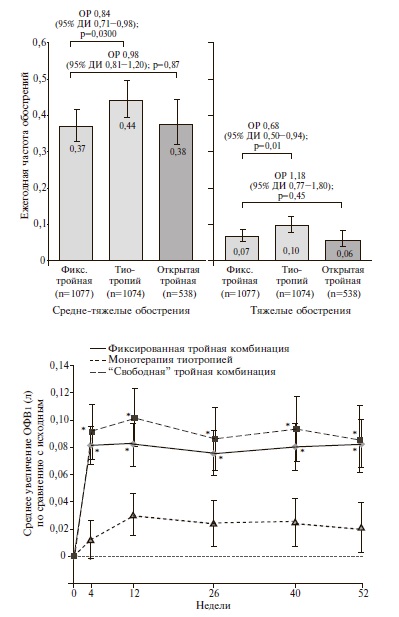
При лечении фиксированной комбинацией БДП/ ФФ/ГБ через 52 недели было выявлено достоверное увеличение ОФВ1 до ингаляции бронходилататора в среднем на 0,061 л по сравнению с монотерапией тиотропием (p 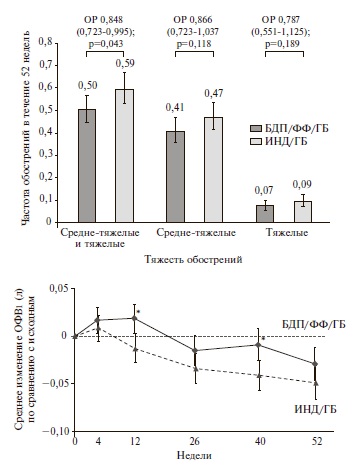
Частота нежелательных явлений (в основном легких или средне-тяжелых) была сопоставимой в трех группах. Как и в исследовании TRILOGY, пневмония на фоне тройной терапии развивалась редко (2%), а частота ее была сопоставимой с таковой в группах сравнения (1-2%).
Таким образом, результаты исследования TRINITY показали, что тройная комбинация двух бронходилататоров и ИГКС имеет достоверные преимущества перед монотерапией ДДАХ по эффективности в профилактике средне-тяжелых и тяжелых обострений ХОБЛ, бронходилатирующей активности и влиянию на качество жизни. Более значительного преимущества тройной терапии по эффективности в профилактике обострений можно ожидать у пациентов с числом эозинофилов в крови ≥2%. Кроме того, полученные данные свидетельствовали о том, что переход с монотерапии тиотропием на комбинацию трех препаратов не приводит к ухудшению безопасности лечения, в частности увеличению риска развития пневмонии.
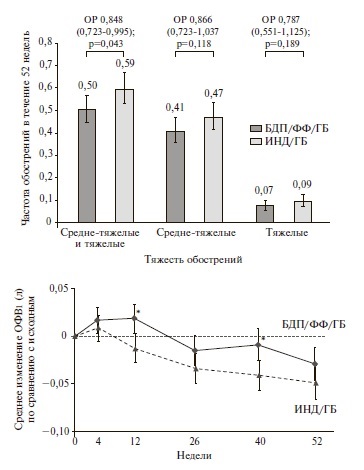
TRIBUTE. В двойном слепом, рандомизированном исследовании TRIBUTE были сопоставлены эффективность и безопасность терапии БДП/ФФ/ГБ и фиксированной двойной терапии индакатеролом (ИНД)/ГБ у 1532 пациентов с ХОБЛ тяжелого или очень тяжелого течения, перенесших по крайней мере одно среднетяжелое или тяжелое обострение в течение предыдущего года несмотря на ингаляционную терапию [27]. Комбинация ИНД/ГБ была выбрана в качестве препарата сравнения, так как в предыдущих исследованиях она по эффективности превосходила монотерапию ДДАХ или комбинированную терапию ИГКС/ДДБА [28,29]. Длительность исследования составила 52 недели. Скорректированная частота средне-тяжелых и тяжелых обострений в группах БДП/ФФ/ГБ и ИНД/ГБ равнялась 0,50 и 0,59 на пациента в год, соответственно. Снижение частоты обострений при тройной терапии составило 15% (отношение рисков 0,848, 95% ДИ 0,723–0,995; p=0,043). Тройная терапия привела к снижению частоты средне-тяжелых и тяжелых обострений на 13% и 21%, соответственно, хотя разница между группами не достигла статистической значимости (рис.3). Наиболее выраженное снижение частоты обострений (на 25%) было отмечено у пациентов с хроническим бронхитом, в то время как у пациентов с преобладающей эмфиземой или эмфиземой/бронхитом тройная терапия не имела существенных преимуществ перед ИНД/ГБ. Кроме того, лечение БДП/ФФ/ГБ вызывало достоверное снижение частоты обострений (на 19%) у пациентов с числом эозинофилов в крови ≥2%.
В обеих группах после недели 12 было отмечено снижение ОФВ1, однако негативная динамика этого показателя была менее выраженной на фоне тройной терапии. Кроме того, терапия БДП/ФФ/ГБ привела к достоверному улучшению среднего индекса SGRQ при всех визитах, хотя доля пациентов, у которых отмечалось клинически значимое улучшение качества жизни, достоверно не отличалась между двумя группами.
Частота нежелательных явлений, которые в основном были легкими или средне-тяжелыми, оказалась сопоставимой в двух группах. Частота пневмонии также была одинаковой (4%).
Таким образом, в исследовании TRIBUTE тройная терапия БДП/ФФ/ГБ вызывала достоверное снижение частоты средне-тяжелых и тяжелых обострений ХОБЛ по сравнению с двойной терапией ДДАХ/ДДБА и не сопровождалась увеличением риска нежелательных явлений, в том числе пневмонии. Полученные данные свидетельствуют о том, что присоединение ИГКС к терапии двумя ингаляционными бронходилататорами позволяет улучшить результаты лечения у пациентов с тяжелой или очень тяжелой ХОБЛ, особенно при наличии хронического бронхита или повышенного числа эозинофилов в крови (≥2%).
Мета-анализ. Y. Zheng и соавт. провели мета-анализ 21 рандомизированного контролируемого исследования длительностью от 8 до 52 недель, в которых сравнивали эффективность и безопасность тройной терапии и других схем терапии у больных с ХОБЛ [30]. Тройная терапия двумя бронходилататорами и ИГКС привела к достоверному снижению частоты средне-тяжелых и тяжелых обострений ХОБЛ по сравнению с монотерапией ДДАХ (отношение рисков 0,71, 95% ДИ 0,600,95), комбинированной терапией ДДАХ/ДДБА (относительный риск 0,78, 95% ДИ 0,70-0,88) и ИГКС/ ДДБА (относительный риск 0,77, 95% ДИ 0,66-0,91). Кроме того, тройная терапия по сравнению с другими схемами терапии вызывала достоверное уменьшение степени бронхиальной обструкции и улучшение качества жизни. Достоверной разницы смертности между группами сравнения выявлено не было. Профиль безопасности тройной терапии был благоприятным. Риск пневмонии при тройной терапии увеличился в клинических исследованиях, в которых ее сравнивали с комбинированной терапии ДДАХ и ДДБА (относительный риск 1,53, 95% ДИ 1,25-1,87), в то время как в других исследованиях риск развития пневмонии был сопоставимым в группах сравнения.
Место тройной терапии в рекомендациях GOLD2019 года
В рекомендациях GOLD 2019 года выделен специальный раздел, посвященный тройной терапии, в котором указано, что она позволяет улучшить функцию легких и исходы, регистрируемые пациентами, в частности снизить риск обострений, по сравнению с монотерапией ДДАХ или комбинированной терапией ДДБА/ДДАХ [10]. Возможные алгоритмы перехода на тройную терапию при неэффективности терапии двумя препаратами изображены на (рис. 4.)
Заключение
В рекомендациях GOLD 2019 года пациентам с тяжелым и очень тяжелым течением ХОБЛ и высоким риском обострений, не отвечающим на лечение двумя длительно действующими бронходилататорами или бронходилататором в комбинации с ИГКС, предлагается назначать тройную терапию ДДАХ, ДДБА и ИГКС. Результаты рандомизированных клинических исследований и их мета-анализа показали, что тройная терапия приводит к достоверному снижению частоты среднетяжелых и тяжелых обострений ХОБЛ, степени бронхиальной обструкции и улучшению качества жизни по сравнению со всеми другими схемами терапии. Более выраженного снижения частоты обострений при присоединении ИГКС к двум длительно действующим бронходилататорами, по-видимому, можно ожидать у пациентов с числом эозинофилов в крови ≥2%. Перспективным представляется применение фиксированных комбинированных препаратов, таких как экстрамелкодисперсный БДП/ФФ/ГБ, эффективность которого была доказана в нескольких крупных контролируемых исследованиях (TRILOGY, TRINITY, TRI BUTE). Включение ИГКС в схему терапии может ассоциироваться с увеличением риска развития пневмонии, хотя при применении БДП/ФФ/ГБ не было отмечено повышения частоты этого нежелательного явления, в том числе по сравнению с комбинированной терапией ДДАХ/ДДБА или монотерапией ДДАХ.
Формотерол в лечении бронхиальной астмы
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Формотерол является высокоселективным агонистом b2–адренорецепторов с уникальными свойствами. Будучи наряду с сальметеролом представителем класса b2–агонистов длительного действия (ДД), он сочетает в себе преимущества и пролонгированных (длительность бронхорасширяющего эффекта до 12 ч), и короткодействующих (быстрое начало действия) бронходилататоров. Благодаря такому сочетанию свойств, а также синергизму действия с ингаляционными глюкокортикостероидами (ИГКС) формотерол широко применяется в лечении бронхообструктивных заболеваний – бронхиальной астмы (БА) и хронической обструктивной болезни легких.
Формотерол представлен в России двумя ингаляционными препаратами – Форадил и Оксис. Форадил выпускается в капсулах по 12 мкг для ингаляций с помощью порошкового ингалятора (ПИ) Аэролайзер.
В данной статье будут рассмотрены данные по формотеролу, полученные исключительно в контролируемых клинических исследованиях.
Бронхорасширяющий
эффект формотерола
Бронхорасширяющий эффект (оценивался после провокации метахолином) у формотерола (12 мкг) развивается почти так же быстро, как и у сальбутамола (200 мкг). Специфическая проводимость дыхательных путей выросла в 2 раза через 5 и 4 мин. после ингаляции, а максимальный эффект в отношении этого показателя наблюдался через 120 и 80 мин. [1].
Быстрота наступления эффекта после ингаляции формотерола, сальбутамола и сальметерола оценивалась у больных БА, которым проводился тест с метахолином. Объем форсированного выдоха за 1–ю секунду (ОФВ1) поднимался до уровня 85% от исходного соответственно через 7,2, 6,5 и 14,1 мин. (при ингаляции плацебо – 35 мин.). Различия между формотеролом и сальметеролом были достоверны [2].
При сравнении бронхорасширяющего эффекта формотерола (ПИ Турбухалер, по 12 мкг 2 раза в сутки) и сальметерола (ПИ Дискус, по 50 мкг 2 раза в сутки) у больных со среднетяжелой БА (n=99) показано, что он через 1 ч после ингаляции не различался между группами [3]. Не было различий и по продолжительности эффекта при лечении в течение 1 нед. (через 11 ч после приема последней дозы). Однако сопротивление дыхательных путей через 2 мин. после ингаляции формотерола снизилось в среднем на 29%, а через 2 мин. после ингаляции сальметерола у 49% пациентов произошло усиление бронхоконстрикции (увеличение сопротивления в среднем на 16%). Такую парадоксальную реакцию на сальметерол у половины пациентов можно связать с относительно большим содержанием лактозы (носителя в ПИ Дискус).
В двойном слепом плацебо-контролируемом исследовании (ДСПКИ) у больных БА продемонстрирован одинаковый эффект формотерола при доставке через ПИ Турбухалер и ПИ Аэролайзер [4].
Таким образом, бронхорасширяющий эффект формотерола развивается так же быстро, как у сальбутамола, а по продолжительности и силе не уступает таковому у сальметерола.
При регулярном применении b2–агонистов ДД наблюдается снижение чувствительности к короткодействующим b2–агонистам. Так, после регулярного приема формотерола в течение 2 нед. у больных БА прирост ОФВ1 под действием сальбутамола был на 29% меньше, чем исходно [5]. Снижение чувствительности у больных БА к короткодействующим b2–агонистам более выражено при регулярном использовании сальметерола, чем формотерола (данные перекрестного ДСПКИ) [6].
Тем не менее при мета-анализе исследований по применению Форадила (ПИ Аэролайзер) у детей в возрасте 5–12 лет обнаружено, что чувствительность к препарату не снижалась с течением времени (срок наблюдения до 15 мес.) [7].
Протективное действие формотерола
Форадил используется не только для регулярной терапии, но и ситуационно для предупреждения бронхоспазма, обусловленного физической нагрузкой, воздействием аллергена или холодного воздуха.
Протективное действие формотерола и сальметерола в увеличивающихся дозах при провокации метахолином изучалось в двойном слепом перекрестном исследовании [8]. Защитное действие формотерола сильнее возрастало с увеличением дозы (увеличение пороговой дозы метахолина в 4,6 раза после ингаляции максимальной дозы), чем сальметерола (прирост в 2,6 раза). Таким образом, в клиническом испытании формотерол подтвердил свои свойства полного агониста b2–рецепторов – в отличие от сальметерола, являющегося их частичным агонистом.
В ДСПКИ [9] изучалось действие формотерола (Форадил Аэролайзер 24 мкг) на позднюю фазу аллерген–индуцированной астматической реакции у больных БА (n=24). По сравнению с плацебо Форадил оказывал достоверный бронхопротективный эффект. При этом авторам удалось вычленить из этого эффекта компонент, обусловленный прямой бронходилатацией (действием на миоциты бронхов), и компонент, связанный с другими механизмами. Бронхорасширяющее действие Форадила было достоверным в первые 5 часов после провокации, а ослабление поздней фазы реакции на аллерген сохранялось в период от 3 до 32 ч после провокации. Таким образом, бронхопротективный эффект формотерола при контакте с аллергеном обусловлен не только его бронхорасширяющей активностью, но и другими механизмами.
Защитное действие формотерола (Форадил Аэролайзер 12 и 24 мкг) в отношении предупреждения постнагрузочного бронхоспазма изучали в сравнении с плацебо и сальбутамолом. Тест с физической нагрузкой проводили через 15 мин., 4, 8 и 12 ч после ингаляции препаратов. Обе дозы Форадила обладали достоверным защитным действием по сравнению с плацебо во все временные интервалы, а сальбутамол оказывал достоверный защитный эффект только через 15 мин. и 4 ч после ингаляции (причем клинически значимым он был лишь через 15 мин.). Различий по эффективности между двумя дозами Форадила отмечено не было [10].
Противовоспалительные
свойства формотерола
В ряде исследований in vitro обнаружены противовоспалительные свойства формотерола, которые были подтверждены и данными клинических испытаний.
В исследовании у здоровых добровольцев показана способность формотерола уменьшать по сравнению с плацебо экссудацию плазмы в дыхательные пути, что может способствовать его противоастматической активности [11].
Более выраженное протективное действие формотерола при провокации аденозинмонофосфатом (его бронхоконстрикторное действие опосредовано выбросом медиаторов из тучных клеток), нежели прямым бронхоконстриктором – метахолином, может свидетельствовать о способности формотерола стабилизировать тучные клетки у больных БА [12,13].
Влияние формотерола на маркеры аллергического воспаления в дыхательных путях продемонстрировано у больных БА в нескольких ДСПКИ. После 4–8 нед лечения отмечено снижение содержания эозинофилов в материале биопсии стенки бронха [14,15], а также уменьшение в крови числа эозинофилов, концентрации эозинофильного катионного протеина и интерлейкина–4 [16].
Длительное применение
формотерола при БА
Эффективность и безопасность Форадила (12 или 24 мкг 2 раза в сутки) в сравнении с сальбутамолом (180 мкг 4 раза в сутки) и плацебо изучали при легкой/среднетяжелой БА у пациентов в возрасте 12–75 лет (n=554). Это многоцентровое ДСПКИ длилось 12 нед. Обе дозы Форадила достоверно превосходили плацебо и сальбутамол по бронхорасширяющему эффекту во всех контрольных точках, а также по влиянию на другие показатели функции внешнего дыхания (ФВД) и клинические параметры. Лечение Форадилом и сальбутамолом было хорошо переносимым [17].
У пациентов, получающих ингаляционные глюкокортикостероиды (ИГКС), ежедневный прием Форадила дважды в день в течение 6 мес. обеспечивал лучший контроль БА (по бронхиальной гиперреактивности, ОФВ1, симптомам и потребности в b2–агонистах), чем ежедневный прием сальбутамола (4 раза в день) или его использование по потребности. После незначительного уменьшения бронходилатационного и бронхопротективного эффекта во всех группах вскоре после начала лечения дальнейшего снижения эффективности не наблюдалось. Не отмечено и феномена «рикошета» после отмены b2–агонистов [18].
Эффективность терапии Форадилом (12 мкг 2 раза в сутки) или сальбутамолом по потребности на протяжении 3 мес у больных среднетяжелой БА (n=259), получающих ИГКС, сравнивали в открытом рандомизированном исследовании реальной практики [19]. Лечение Форадилом привело к достоверно большему приросту ОФВ1 и пиковой скорости выдоха (ПСВ), сильнее уменьшило выраженность симптомов БА, чем в группе сальбутамола, снизило на 2/3 потребность в приеме бронходилататоров. Доля дней и ночей, свободных от симптомов, в группе формотерола увеличилась на 20 и 33%.
При длительной терапии (1 год) формотерол (24 мкг/сут.) в сочетании с будесонидом в дозе 200 мкг/сут. обеспечивал такой же уровень контроля среднетяжелой БА, как монотерапия будесонидом в дозе 800 мкг/сут. [20]. Добавление формотерола к терапии ИГКС приводит к улучшению не только клинических и функциональных показателей, но и качества жизни при длительном (1 год) лечении [21].
У пациентов с тяжелой БА, не контролируемой высокими дозами ИГКС или системными глюкокортикостероидами (ГКС), формотерол (12 мкг 2 раза в сутки) оказался равным по эффективности сальметеролу (50 мкг 2 раза в сутки) [22].
В открытом многоцентровом рандомизированном исследовании у получающих ИГКС больных БА (n=528) изучали эффективность регулярной терапии формотеролом (12 мкг 2 раза в сутки) или сальметеролом (50 мкг 2 раза в сутки). В течение 6 мес. лечения у пациентов в группе формотерола оказалось достоверно больше дней, свободных от симптомов, и меньше потребность в использовании короткодействующих b2–агонистов [23].
В крупное (n=6239) многоцентровое открытое исследование [24] включались больные с недостаточным контролем БА, исходно получавшие ИГКС и сальбутамол по потребности (часть из них в сочетании с сальметеролом 50 мкг 2 раза в сутки). 2/3 этих пациентов был назначен Форадил (12 мкг 2 раза в сутки) – вместо сальметерола или в дополнение к сальбутамолу по потребности. Лечение Форадилом через 4 нед. привело к достоверному увеличению ПСВ и улучшению клинических симптомов по сравнению как с группой сальбутамола, так и группой сальметерола.
В многоцентровом ДСПКИ пациентам с недостаточным контролем БА, исходно получавшим 500 мкг/сут. беклометазона, к лечению добавляли Форадил (12 мкг 2 раза в сутки) или удваивали дозу ИГКС [25]. В группе Форадила через 12 нед. лечения ПСВ была достоверно выше, чем в группе только ИГКС; при этом увеличение дозы беклометазона до 1000 мкг/сут. сопровождалось достоверным подавлением секреции эндогенного кортизола. Таким образом, добавление Форадила к лечению ИГКС более эффективно, чем увеличение их дозы, и позволяет избежать подавления функции надпочечников.
В мета-анализах библиотеки Cochrane [27,28] обобщены данные клинических исследований с позиций медицины, основанной на доказательствах. При регулярной терапии БА b2–агонисты ДД (формотерол и сальметерол) обладали преимуществом перед короткодействующими b2–агонистами по влиянию на дневные и ночные симптомы, потребность в ситуационных бронходилататорах и ПСВ. Различий в частоте обострений БА не было обнаружено [27]. В другом мета-анализе оценивали сравнительную эффективность и безопасность при БА добавления к регулярной терапии ИГКС b2–агонистов ДД или увеличения в 2 раза дозы ИГКС. Не было выявлено достоверных различий по частоте обострений, требовавших назначения системных ГКС, хотя риск выбытия из исследования из–за ухудшения контроля БА был меньше при комбинированной терапии (ИГКС + b2–агонисты ДД). По влиянию на ФВД, потребность в ситуационных бронходилататорах и симптомы БА комбинированная терапия имеет преимущества перед монотерапией высокими дозами ИГКС [28].
Безопасность формотерола
Формотерол оказывает менее выраженное влияние на частоту сердечных сокращений, артериальное давление, продолжительность интервала QT на ЭКГ и уровень калия в плазме по сравнению с тербуталином. Терапевтический индекс формотерола в 2,5 раза больше, чем сальбутамола, а продолжительность его нежелательных эффектов (НЭ) не превосходит таковую у короткодействующих b2–агонистов [29]. В другом исследовании высокие дозы Форадила (36 мкг 3 раза в сутки через Аэролайзер) приводили к увеличению содержания в крови калия и глюкозы, а также к небольшому удлинению интервала QT, но ни у одного пациента эти изменения не были клинически значимыми [30]. Системные НЭ при использовании больших доз (в 4 раза больше рекомендованных) одинаковы по своей выраженности у формотерола и сальметерола [31].
Как показано в 12–недельном ДСПКИ, регулярное применение короткодействующих b2–агонистов (сальбутамола) может приводить к ухудшению течения БА после их отмены в виде уменьшения ОФВ1 и нарастания бронхиальной гиперреактивности – в отличие от формотерола, прием которого не сопровождается феноменом «рикошета» [32].
При мета-анализе 3 исследований был сделан предостерегающий вывод о том, что лечение высокими дозами формотерола (48 мкг/сут.) может быть ассоциировано с повышенным риском тяжелых обострений БА [33]. Однако в других крупных многоцентровых исследованиях [34–36] это положение не подтвердилось. В недавно опубликованном многоцентровом ДСПКИ [36] изучалась частота обострений БА у пациентов (n=2085), получавших в течение 16 нед. одну из схем терапии: формотерол по 24 мкг 2 раза в сутки, формотерол по 12 мкг 2 раза в сутки, формотерол по 12 мкг 2 раза в сутки и дополнительные дозы 12 мкг по потребности (не более 2 доз за сутки), плацебо. Частота обострений, потребовавших назначения системных ГКС, составила соответственно 6,3; 5,9; 4,4 и 8,8%, при этом гибкая схема назначения формотерола привела к достоверному снижению риска обострений по сравнению с группой плацебо.
Этот факт подтверждается и мета–анализом библиотеки Cochrane [37]. По сравнению с плацебо добавление b2–агонистов ДД к регулярной терапии ИГКС (как низкими, так и высокими дозами) достоверно снижало риск обострений БА, требующих назначения системных ГКС.
Заключение
Контролируемые клинические исследования, обладающие высоким уровнем доказательности, подтверждают эффективность и безопасность формотерола в лечении БА. Формотерол оказывает быстрый и длительный бронхорасширяющий эффект, обеспечивает длительную бронхопротекцию (предупреждает бронхоспазм, связанный с физической нагрузкой и другими триггерами). Вероятно, формотерол обладает и определенным противовоспалительным действием. Благодаря этим свойствам формотерол широко используется при БА, особенно в комбинации с ИГКС, позволяя использовать меньшие дозы ИГКС и снизить риск нежелательных эффектов.