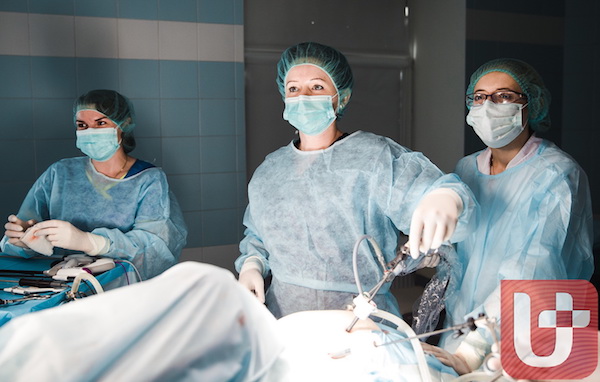
Сальник это анатомия человека что
Операция по удалению рака яичников
Основным методом лечения при раке яичника является операция, цель которой — максимальное удаление злокачественной опухоли. Хирургическое вмешательство может быть самостоятельным методом лечения (например, при опухоли I A стадии), или выступать в качестве этапа комплексных мероприятий.
Оперативное лечение показано на всех стадиях болезни, от операции при раке яичника, выполненной в полном объеме, напрямую зависит прогноз заболевания. На первом этапе проводится, если возможно, полная или оптимальная циторедуктивная операция, в ходе которой удаляются видимые злокачественные образования, в том числе расположенные на внутренних органах. Целью циторедукции («цито» — клетка, «редукция» — сокращение) является уменьшение количества клеток опухоли. Различают циторедукцию:
Чем меньше объема раковых клеток остается перед началом второго этапа лечения — химиотерапии, тем лучше результат. При невозможности проведения оптимальной циторедукции на первом этапе лечения назначается химиотерапия.
Авторская методика лечения
Важным этапом при диагностике и удалении рака яичников является лапароскопия — малоинвазивная операция, во время которой оценивается характер процесса и степень его распространения на другие структуры малого таза. Возможны ситуации, когда на месте предполагаемой до лапароскопии локализованной опухоли обнаруживается более обширный процесс. Поэтому в ходе ревизии органов таза и брюшной полости важно оценить состояние поверхности диафрагмы и брюшины, прорастание капсулы, вовлечение в процесс второго яичника и придатков, наличие спаек между тканями и опухолью.
Также в ходе лапароскопии можно взять смывы из брюшной полости и жидкость при наличии асцита для морфологического исследования. Нередко атипичные клетки обнаруживаются в выпоте или в асцитической жидкости, при этом видимых образований в зоне малого таза может не оказаться.
В ходе лапароскопии берется биопсия из видимых очагов патологии, затем изъятые частицы ткани отправляются на гистологическое исследование. Этот метод является наиболее эффективным для точного определения стадии болезни и морфологии злокачественных клеток, на основе его результатов подбирается тактика дальнейшего лечения.
При лапароскопии также можно удалить первичную опухоль, при необходимости провести операцию в полном объеме, с выполнением пангистерэктомии, экстирпацией большого сальника — оментэктомия, и удалением парааортальной клетчатки. Удаление матки с двусторонней сальпингэктомией и овариэктомией оправдано, поскольку даже при локализации злокачественной опухоли с одной стороны у 20% пациенток остаются скрытые метастазы, из которых в дальнейшем снова развивается опухоль. Необходимость удаления сальника и лимфоузлов объясняется тем, что в эти структуры легко метастазируют злокачественные клетки; не удаленные, они станут причиной появления новых очагов.
У женщин, вступивших в период менопаузы, радикальная операция при раке яичников выполняется в один этап, поскольку эти пациентки, как правило, имеют различные сопутствующие заболевания. Проведение одной операции вместо двух сопровождается меньшей нагрузкой на организм.
Подход к лечению рака яичника у пациенток репродуктивного возраста
Если перед хирургическим вмешательством выявлена опухоль неясного происхождения, то проводится лапароскопия, в ходе которой выполняется ревизия внутренних органов, берутся смывы с поверхности брюшины, после чего опухоль с пораженной стороны удаляется вместе с придатками. Затем проводится биопсия второго яичника и рядом расположенной брюшины, дугласового пространства, большого сальника и расположенных вокруг аорты лимфоузлов, поскольку эти зоны подвержены метастазированию. Таким образом оценивается зона распространения раковых клеток.
Если при гистологическом анализе наличие злокачественного образования яичника не будет подтверждено, что встречается у 90-95% пациенток, то хирургическое лечение на этом заканчивается. Но женщина должна находиться под наблюдением гинеколога. Такой подход позволяет сохранить репродуктивную функцию женщины. Поскольку лапароскопия была проведена через несколько небольших разрезов на передней брюшной стенке, то следы на коже со временем станут незаметными. Через три дня пациентка выписывается из клиники, а спустя 10-14 дней считается трудоспособной.
В случае, если наличие злокачественного процесса будет подтверждено гистологически, дальнейшая тактика лечения обговаривается на консилиуме врачей, куда входят хирург-гинеколог, онколог, химиотерапевт, морфолог. При отсутствии показаний к химиотерапии через 4-5 дней после лапароскопии проводится повторная операция, но в полном объеме: пангистерэктомия с экстирпацией большого сальника, при необходимости также показана лимфаденэктомия. При повторном вмешательстве я также использую лапароскопический доступ.
При желании женщины сохранить функцию репродукции может быть проведена односторонняя аднексэктомия с резекцией другого яичника. В этом случае также рекомендовано удаление большого сальника и лимфаденэктомия. Однако при выборе этой методики перечень показаний довольно ограничен:
Онкологический диагноз подтверждается лишь у 5-10% пациенток, поэтому на первом этапе я всегда стремлюсь провести у молодых женщин при подозрении на рак яичников органосохраняющую операцию.
Как проводится операция — основные этапы
На ранних этапах опухоли яичников операция проводится с обязательным стадированием в объеме.
При заболевании III-IV стадии операции по удалению рака яичников предшествует 2-3 курса неоадъювантной химиотерапии, хирургическое вмешательство проводится после ответа на лечение. После оперативного лечения назначается адъювантная химиотерапия.
Преимущества лапароскопии
Операцию по удалению опухоли яичников, независимо от стадии болезни, я всегда провожу лапароскопическим методом. Использование современного видеоэндоскопа позволяет выполнять все манипуляции под визуальным контролем с максимальной точностью. Полученное изображение зоны вмешательства передается в режиме реального времени на монитор под большим увеличением, что повышает эффективность и безопасность операции.
При удалении клетчатки, окружающей органы таза, в которой множество лимфатических и кровеносных сосудов, я использую аппарат Thunderbeat (Япония), одним из его достоинств является возможность использования ультразвуковой и биполярной энергии. За счет этого удается добиться в ходе операции абсолютно сухого поля, что также повышает безопасность и результативность вмешательства. Благодаря использованию современных технологий можно провести адекватный гемостаз даже в отечной ткани.
Отсечение сальника выполняется в бессосудистой зоне холодным способом с помощью специальных ножниц. Использование аппарата дозированного лигирующего воздействия на ткани — LigaSure (Швейцария) — при пангистерэктомии дает возможность надежно и быстро проводить диссекцию связочного аппарата, заваривать сосуды, что сокращает длительность операции, исключает кровотечение и риск постоперационных осложнений. Извлечение удаленного материала проводится с использованием специального контейнера; предварительное погружение препарата позволяет избежать контакта частиц опухоли с краями разреза. Помимо безопасного оперирования, лапароскопия при удалении опухоли яичника также обеспечивает:
Благодаря щадящей технике лапароскопии начало адъювантного лечения становится возможным спустя 10-14 дней после операции по удалению опухоли яичников. По сравнению с открытым оперативным вмешательством, когда для восстановления требуется не менее двух месяцев, лапароскопический доступ предпочтительней. Прежде всего, раннее начало химиотерапии влияет на прогноз, после операции при раке яичника методом лапароскопии он благоприятнее, поскольку в случае неполного уничтожения микрометастаз в ходе хирургического вмешательства химиотерапия в ближайшие сроки уничтожает оставшиеся клетки опухоли. Таким образом можно предотвратить развитие рецидива.
Прогноз
Выживаемость после операции при раке яичников зависит от стадии заболевания, среди пациенток, приступивших к лечению на 1 стадии, пятилетний порог преодолевают 60-90% женщин. На II стадии выживаемость составляет 40-50%, на III — лечение оказывается успешным лишь для 11% пациенток. И только 5% женщин, обратившихся за врачебной помощью на IV стадии, имеют шансы прожить пять лет после оперативного вмешательства.
Также прогноз выживаемости при раке яичника зависит от морфологической структуры опухоли, ее дифференцировки. Например, более благоприятными по прогнозу являются высокодифференцированные опухоли, серозный или муцинозный рак. Однако основная роль в излечении отведена используемым при лечении методикам. Операция в полном объеме, современные технологии при лечении и главное — опыт врача, способного безошибочно определить стадию болезни и назначить адекватную терапию — те составляющие, без которых выздоровление невозможно.
На моем счету более 800 лапароскопических операций, проведенных по поводу онкогинекологической патологии. Одним из основных принципов в лечении для меня является индивидуальный подход к каждой пациентке. При планировании тактики лечения я учитываю и особенности течения болезни, и сопутствующие заболевания, и пожелания, касающиеся сохранения репродуктивной функции. Опыт, накопленный за более чем 20-летнюю работу, позволяет мне проводить операции максимально бережно и эффективно. Результаты лечения обобщены в научных работах и монографиях, которые публикуются в различных рецензируемых отечественных и зарубежных изданиях.
Резекция большого сальника (лапароскопия/лапаротомия)
Резекция большого сальника — операция, при которой иссекается и ушивается складка брюшины, покрывающая полость брюшины от области желудка до тонкого кишечника. Данное хирургическое вмешательство, как правило, не является самостоятельной операцией, и чаще выполняется при злокачественном процессе в органах брюшины и малого таза. Как показывает практика, при поражении матки и придатков своевременная выполненная резекция увеличивает выживаемость пациенток. Объясняется это тем, что в ткани сальника легко метастазируют злокачественные клетки. Незамеченные при операции, они будут причиной новых очагов, поэтому удаленная ткань сальника в обязательном порядке должна направляться на гистологический анализ. В ходе хирургического вмешательства по поводу злокачественного процесса удалению также подлежат затронутые раком структуры: лимфатические узлы, кишечник.
Резекция большого сальника может быть проведена с использованием лапароскопического или лапаротомического доступа. В ходе лапаротомии выполняется разрез передней брюшной стенки, открытый метод целесообразен, если необходим обзор пораженных участков. Продолжительность госпитализации в этом случае составляет около 10 дней, восстановление займет около 1-1,5 месяца. В отличие от лапаротомии, при лапароскопическом доступе манипуляции выполняются через несколько небольших разрезов на животе с использованием видеоэндоскопического оборудования. Все действия хирурга отражаются на мониторе с качественным разрешением, визуальный контроль современной аппаратуры обеспечивает высокую точность манипуляций. После лапароскопии длительность пребывания в клинике составляет не более трех дней, период восстановления занимает не более 4 недель.
Показания и противопоказания
Преимущества резекции большого сальника
Комментарий врача

Руководитель хирургической службы SwissClinic Пучков Константин Викторович
Почему резекцию большого сальника лучше сделать в Швейцарской Университетской клинике?
Часто задаваемые вопросы
В чем заключается подготовка к резекции большого сальника?
Перед операцией необходимо тщательно очистить кишечник. Также за несколько дней до вмешательства нужно исключить из рациона продукты, способные вызвать повышенное газообразование. Операция проводится строго натощак, последний прием пищи, как минимум, за 8 ч до ее начала. При необходимости приема каких-либо медикаментов необходимо предупредить лечащего врача, возможно, некоторые препараты нужно будет исключить на несколько дней.
Возможны ли осложнения при резекции большого сальника?
Как при любом оперативном вмешательстве, при резекции также есть риск развития осложнений, теоретически нельзя исключить кровотечения или повреждения близлежащих органов в ходе вмешательства, инфицирование в ранний послеоперационный период. Поэтому наши пациенты проходят тщательное предоперационное обследование, чтобы исключить факторы, увеличивающие риск развития осложнений. Визуальный контроль процесса и использование при проведении операции оборудования и инструментария последнего поколения сводит к минимуму риск негативных последствий.
Реабилитация после резекции большого сальника
На продолжительность восстановления влияет, прежде всего, метод проведения операции. Но, независимо от используемого доступа, через несколько часов женщина может ходить, ей разрешается принимать жидкую легкую пищу. При лапаротомическом доступе длительность госпитализации составляет около 7-10 дней, восстановление занимает 4-6 недель. После лапароскопии период реабилитации значительно короче, женщина, как правило, выписывается на 3 сутки, полное восстановление занимает 2-4 недели. В послеоперационный период могут быть назначены антибактериальные и обезболивающие препараты. На протяжении месяца следует отказаться от интенсивных физических нагрузок и половых контактов, лучше исключить посещение бассейна или сауны.
Используется ли анестезия при резекции большого сальника?
В ходе оперативного вмешательства какие-либо болезненные ощущения полностью исключены, операция может быть проведена под общим наркозом, эпидуральной или спинальной анестезией. Какому способу отдать предпочтение, решает врач в каждом случае индивидуально.
Заболевания
Рак шейки матки
Рак шейки матки — онкологическое заболевание, при котором эпителий нижнего отдела матки трансформируется в злокачественные клетки. В зависимости от типа эпителия различают плоскоклеточный рак — он диагностируется у 85-95% больных, и аденокарциному — появляющуюся в 5-15%.
Рак эндометрия
Рак эндометрия — онкологическое заболевание, при котором злокачественный процесс развивается во внутреннем слое матки. Среди онкологических патологий женской половой сферы эта болезнь по частоте возникновения занимает лидирующее место. Согласно статистике, на 100 тысяч женщин приходится около 13 пациенток с диагностированным заболеванием. Около 75% заболевших приходится на женщин после 50 лет — предменопаузального и постменопаузального возраста, однако в последние годы все чаще пациентками онколога становятся женщины помоложе.
Рак яичников
Рак яичников — одно из распространенных онкологических заболеваний в гинекологии, по частоте развития уступает первенство лишь злокачественным опухолям матки. Поражение яичника может быть первичным — патологический очаг находится в самом яичнике, и вторичным, называемым метастатическим — очаг патологии расположен в любом другом органе. Злокачественные клетки в тканях яичника могут появляться при опухолях в молочной железе, матке, кишечнике, желудке.
Записывайтесь на консультацию: +7 (495) 782-50-10
Морфофункциональная характеристика большого сальника
Полный текст:
Аннотация
Ключевые слова
Об авторах
ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России
Россия
ул. Советская, 6, Оренбург, 460000, Российская Федерация
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России
Россия
Уфа
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России
Россия
Уфа
Список литературы
1. Березовская С.Э. Структурная организация большого сальника как иммунокомпетентного органа (экспериментально-морфологическое исследование): автореф. дисс. … канд. мед. наук. Ярославль; 1990
2. Березовская С.Э., Марков И.И. Функциональное значение большого сальника как иммунокомпетентного органа. Физиология вегетативной нервной системы. Куйбышев: КМИ; 1988: 17–8
3. Большой сальник. Под ред. Д. ЛиберманМерфферт, Х.Уайт. Пер. с англ. М.: Медицина; 1989
4. Величанская А.Г., Ермолин И.Л., Погадаева Е.В., Бугрова М.Л., и др. Структурные изменения жировой ткани в диастазе поврежденного седалищного нерва. Морфология. 2018;153(3):57–8
5. Гатауллин Н.Г., Ганцев Ш.Х., Хунафин С.Н. Диагностика и лечение заболеваний большого сальника. Уфа: Башкирское кн. изд-во; 1988
6. Дедов И.И., Мельниченко Г.А., Бутрова С.А. Жировая ткань как эндокринный орган. Ожирение и метаболизм. 2006;1:6–13
7. Дорошкевич С.В., Дорошкевич Е.Ю. Поражение жировой ткани при экспериментальном панкреатите. Морфология. 2009;136(4):52
8. Зурнаджан С.А., Мусатов О.В., Tризно М.Н., Фомичев В.В. Показатели микроциркуляции тканей передней брюшной стенки и ряда органов брюшной полости у кроликов. Морфология. 2018;153(3):117
9. Зурнаджан С.А., Мусатов О.В., Чернухин А.А., Хайрулин Ю.Х. Изменение содержания тканевого IgG после гастро- и оментолиенопластики в эксперименте. Ученые записки СПбГМУ им. акад. И.П.Павлова. 2006;13(4):73–5
10. Иванова В.Ф. Взаимоотношения ядерной оболочки и органелл клеток брюшины в онтогенезе и при экспериментальной патологии. Морфология. 2013;143(2):51–7
11. Иванова В.Ф. Эпителий серозных оболочек. В кн.: Руководство по гистологии. 2-е издание, исправл. и дополн. Под ред Р.К.Данилова. СПб.: СпецЛит; 2011
12. Караганов Я.Л., Миронов В.А., Гусев С.А. О физиологическом значении и механизмах образования «стомат» в мезотелии брюшины. Архив анатомии. 1981;80(4):85–94
13. Колесников Л.Л., Пархоменко Ю.Г., Сабиров Ш.Р., Чукбар А.В., Тишкевич О.А. Морфологический анализ различных видов гемостаза некоторых паренхиматозных органов. Морфология. 2006;129(4):66
14. Ломакин В.И., Вострилов И.М., Пелих К.И., Карелина Н.Р. Строение и кровоснабжение большого сальника. Морфология. 2012;141(3):93–4
15. Макурина О.Н., Шалаев С.В., Шацкова И.А. Влияние иммуногенных воздействий на морфофункциональное состояние большого сальника некоторых видов млекопитающих. Российские морфологические ведомости. 2001;1–2:35
16. Маслова Н.А., Овчинникова Т.В. Пространственная ориентация прекапиллярных артериол в малом сальнике человека. Морфология. 2018;153(3):180
17. Маслова Н.А., Овчинникова Т.Н. Организация жировой ткани в малом сальнике. Морфология. 2009;136(4):96
18. Мусатов О.В., Зурнаджан С.А., Тризно М.Н. Динамика микроциркуляции в желудочном лоскуте и сальнике после аутопластики ими раны селезенки в эксперименте. Астраханский медицинский журнал. 2012;7(4):190–3
19. Мусатов О.В., Зурнаджан С.А., Хайрулин Ю.Х. Сравнительная морфологическая и иммуноморфологическая оценка репаративного процесса после гастро- и оментонефропластики в эксперименте. Астраханский медицинский журнал. 2011;6(1):87–91
20. Некрутов А.В., Карасева О.В., Рошаль Л.М. Большой сальник: морфофункциональные особенности и клиническое значение в педиатрии. Вопросы современной педиатрии. 2007;6:58–63
21. Новикова Е.Г., Шевчук А.С., Пронин С.М. Резекция большого сальника у больных со злокачественными опухолями яичников. Российский вестник акушера-гинеколога. 2005;4:36–40
22. Странжа Н.Б., Банин В.В., Суслов В.Б., Лихачева Л.М., и др. Цитологические реакции при формировании искусственной брюшной стенки с использованием полимерной сетки Parietex. Морфология. 2012;141(3):151
23. Халикова Л.В. Большой сальник: морфофункциональные особенности и клиническое значение в онкологии. Креативная хирургия и онкология. 2011;4:131–4
24. Attard J-AP., MacLean AR. Adhesive small bowel obstruction: epidemiology, biology and prevention. Can J Surg. 2007;50(4):291–300.
25. Brüggmann D, Tchartchian G, Wallwiener M, Münstedt K, Tinneberg H-R, Hackethal A. Intraabdominal Adhesions. Deutsches Aerzteblatt Online. 2010 Nov 5;107:769–75. doi: 10.3238/arztebl.2010.0769
26. Chen J-Y, Chiu J-H, Chen H-L, Chen T-W, Yang W-C, Yang A-H. Human Peritoneal Mesothelial Cells Produce Nitric Oxide: Induction by Cytokines. Peritoneal Dialysis International: Journal of the International Society for Peritoneal Dialysis. 2000 Nov;20(6):772–7. doi: 10.1177/089686080002000631
27. Cheong YC, Laird SM, Li TC, Shelton JB, Ledger WL, Cooce ID. Peritoneal healing and adhesion formation/reformation. Human Reproduction Update. 2001 Nov 1;7(6):556–66. doi: 10.1093/humupd/7.6.556
28. Cheong YC, Laird SM, Shelton JB, Ledger WL, Li TC, Cooce ID. The correlation of adhesions and peritoneal fluid cytokine concentrations: a pilot study. Human Reproduction. 2002 Apr 1;17(4):1039–45. doi: 10.1093/humrep/17.4.1039
29. Cronauer MV, Stadlmann S, Klocker H, Abendstein B, Eder IE, Rogatsch H, et al. Basic Fibroblast Growth Factor Synthesis by Human Peritoneal Mesothelial Cells. The American Journal of Pathology. 1999 Dec;155(6):1977–84. doi: 10.1016/s0002-9440(10)65516-2
30. Darimont C, Avanti O, Blancher F, Wagniere S, Mansourian R, Zbinden I, et al. Contribution of mesothelial cells in the expression of inflammatory-related factors in omental adipose tissue of obese subjects. International Journal of Obesity. 2007 Jul 17;32(1):112–20. doi: 10.1038/sj.ijo.0803688
31. Durgakeri PU, Kaska M. Post-operative intraperitoneal adhesion prevention – the recent knowledge. Rozhl Chir. 2006 Jun;85(6):286-9.
32. Fedorko ME, Hirsch JG. Studies on transport of macromolecules and small particles across mesothelial cells of the mouse omentum. Experimental Cell Research. 1971 Nov;69(1):113–27. doi: 10.1016/0014-4827(71)90317-x
33. Foley-Comer AJ, Herrick SE, Al-Mishlab T, et al. Evidence for incorporation of free-floating mesothelial cells as a mechanism of serosal healing. J Cell Sci. 2002 Apr 1;115(7):1383-9.
34. Fotev Z, Whitaker D, Papadimitriou JM. Role of macrophages in mesothelial healing. The Journal of Pathology. 1987 Mar;151(3):209–19. doi: 10.1002/path.1711510309
35. Ghellal AM, Syucchi A.F, Chegini N, et al. Role of transforming growth factor beta-1 in peritonitisinduced adhesions,. Journal of Gastrointestinal Surgery. 2000 Jun;4(3):316–23.
36. Grant HW, Parker MC, Wilson MS, Menzies D, Sunderland G, Thompson JN, et al. Populationbased analysis of the risk of adhesion-related readmissions after abdominal surgery in children. Journal of Pediatric Surgery. 2006 Aug;41(8):1453–6. doi: 10.1016/j.jpedsurg.2006.04.023
37. Grant HW, Parker MC, Wilson MS, Menzies D, Sunderland G, Thompson JN, et al. Adhesions after abdominal surgery in children. Journal of Pediatric Surgery. 2008 Jan;43(1):152–7. doi: 10.1016/j.jpedsurg.2007.09.038
38. Havel PJ. Update on Adipocyte Hormones: Regulation of Energy Balance and Carbohydrate/Lipid Metabolism. Diabetes. 2004 Jan 28;53(1):S143–51. doi: 10.2337/diabetes.53.2007.s143
39. Healy JC, Reznek RH. The peritoneum, mesenteries and omenta: normal anatomy and pathological processes. European Radiology. 1998 Jul 28;8(6):886–900. doi: 10.1007/s003300050485
40. Hobson KG. Expression of Transforming Growth Factor β1 in Patients With and Without Previous Abdominal Surgery. Archives of Surgery. 2003 Nov 1;138(11):1249–52. doi: 10.1001/archsurg.138.11.1249
41. Horowitz NS, Miller A, Rungruang B, Richard SD, Rodriguez N, Bookman MA, et al. Does Aggressive Surgery Improve Outcomes? Interaction Between Preoperative Disease Burden and Complex Surgery in Patients With AdvancedStage Ovarian Cancer: An Analysis of GOG 182. Journal of Clinical Oncology. 2015 Mar 10;33(8):937–43. doi: 10.1200/jco.2014.56.3106
42. Kamel RM. Prevention of postoperative peritoneal adhesions. European Journal of Obstetrics & Gynecology and Reproductive Biology. 2010 Jun;150(2):111–8. doi: 10.1016/j.ejogrb.2010.02.003
43. Kasahara M, Yamaguchi H, Kageyama K. Studies on the antibody formation of the cultured omentum cells using hemolytic plaque method. Pathology International. 1973 Feb;23(1):43–9. doi: 10.1111/j.1440-1827.1973.tb00773.x
44. Kawanishi K. Diverse properties of the mesothelial cells in health and disease. Pleura and Peritoneum. 2016 Jun 1;1(2):79–89. doi: 10.1515/pp-2016-0009
45. Kim S, Moustaid-Moussa N. Secretory, Endocrine and Autocrine/Paracrine Function of the Adipocyte. The Journal of Nutrition. 2000 Dec 1;130(12):3110S-3115S. doi: 10.1093/jn/130.12.3110s
46. Kimber CP, Westmore P, Hutson JM, Kelly J. Primary omental torsion in children. Journal of Paediatrics and Child Health. 1996 Feb;32(1):22–4. doi: 10.1111/j.1440-1754.1996.tb01535.x
47. Krist LFG, Eestermans IL, Steenbergen JJE, Hoefsmit ECM, Cuesta MA, Meyer S, et al. Cellular composition of milky spots in the human greater omentum: An immunochemical and ultrastructural study. The Anatomical Record. 1995 Feb;241(2):163–74. doi: 10.1002/ar.1092410204
48. Kurman RJ, Shih I-M. The Dualistic Model of Ovarian Carcinogenesis. The American Journal of Pathology. 2016 Apr;186(4):733–47. doi: 10.1016/j.ajpath.2015.11.011
49. Lambert FG. Milky spots in the greater omentum. Cancer Immunol. Immunother. 1998;47:20 –12.
50. Lanfrancone L, Boraschi D, Ghiara P, Falini B, Grignani F, Peri G, et al. Human peritoneal mesothelial cells produce many cytokines (granulocyte colony-stimulating factor [CSF], granulocyte-monocyte-CSF, macrophage- CSF, interleukin-1 [IL-1], and IL-6) and are activated and stimulated to grow by IL-1. Blood. 1992 Dec 1;80(11):2835–42. doi: 10.1182/blood.v80.11.2835.bloodjournal80112835
51. Liakakos T, Thomakos N, Fine PM, Dervenis C, Young RL. Peritoneal Adhesions: Etiology, Pathophysiology, and Clinical Significance. Digestive Surgery. 2001;18(4):260–73. doi: 10.1159/000050149
52. LI S, LI Q. Cancer stem cells and tumor metastasis. International Journal of Oncology. 2014 Apr 2;44(6):1806–12. doi: 10.3892/ijo.2014.2362
53. Li M-Z, Lian L, Xiao L, Wu W, He Y, Song X. Laparoscopic versus open adhesiolysis in patients with adhesive small bowel obstruction: a systematic review and meta-analysis. The American Journal of Surgery. 2012 Nov;204(5):779–86. doi: 10.1016/j.amjsurg.2012.03.005
54. Madison LD, Bergstrom-Porter B, Torres AR, Shelton E. Regulation of surface topography of mouse peritoneal cells. Formation of microvilli and vesiculated pits on omental mesothelial cells by serum and other proteins. The Journal of Cell Biology. 1979 Sep 1;82(3):783–97. doi: 10.1083/jcb.82.3.783
55. Miura M, Yonemura Y. Morphological study of human omental milky spots and their morphological changes in omental disseminated metastasis. Jap. J. Lymphology. 2011;34:2–6.
56. Mogensen JB, Kjær SK, Mellemkjær L, Jensen A. Endometriosis and risks for ovarian, endometrial and breast cancers: A nationwide cohort study. Gynecologic Oncology. 2016 Oct;143(1):87–92. doi: 10.1016/j.ygyno.2016.07.095
57. Mutsaers SE, Whitaker D, Papadimitriou JM. Mesothelial regeneration is not dependent on subserosal cells. The Journal of Pathology. 2000 Jan;190(1):86–92. doi: 10.1002/(sici)1096-9896(200001)190
58. Mutsaers SE. Mesothelial cells: Their structure, function and role in serosal repair. Respirology. 2002 Sep;7(3):171–91. doi: 10.1046/j.1440-1843.2002.00404.x
59. Mutsaers SE. The mesothelial cell. The International Journal of Biochemistry & Cell Biology. 2004 Jan;36(1):9–16. doi: 10.1016/s1357-2725(03)00242-5
60. Nehéz L, Vödrös D, Axelsson J, Tingstedt B, Lindman B, Andersson R. Prevention of postoperative peritoneal adhesions: Effects of lysozyme, polylysine and polyglutamate versus hyaluronic acid. Scandinavian Journal of Gastroenterology. 2005 Jan;40(9):1118–23. doi: 10.1080/00365520510023332
61. Ohtani O, Ohtani Y. Organization and developmental aspects of lymphatic vessels. Archives of Histology and Cytology. 2008;71(1):1–22. doi: 10.1679/aohc.71.1
62. Ott D. Laparoscopy and Adhesion Formation, Adhesions and Laparoscopy. Seminars in Reproductive Medicine. 2008 Jul;26(04):322–30. doi: 10.1055/s-0028-1082390
63. Park SL, Caberto CP, Lin Y, Goodloe RJ, Dumitrescu L, Love S-A, et al. Association of Cancer Susceptibility Variants with Risk of Multiple Primary Cancers: The Population Architecture using Genomics and Epidemiology Study. Cancer Epidemiology Biomarkers & Prevention. 2014 Aug 19;23(11):2568–78. doi: 10.1158/1055-9965.epi-14-0129
64. Pezzolla FG, Maiorino R, Ferrarese F. Peritoneal adhesions: pathophysiology. G Chir. 2008;29(3):115–25.
65. Podgrabinska S, Skobe M. Role of lymphatic vasculature in regional and distant metastases. Microvascular Research. 2014 Sep;95:46–52. doi: 10.1016/j.mvr.2014.07.004
66. Rasouli N, Kern PA. Adipocytokines and the Metabolic Complications of Obesity. The Journal of Clinical Endocrinology & Metabolism. 2008 Nov 1;93(1):64–73.. doi: 10.1210/jc.2008-1613
67. Saed GM, Zhang W, Chegini N, Holmdahl L, Diamond MP. Transforming Growth Factor Beta Isoforms Production by Human Peritoneal Mesothelial Cells after Exposure to Hypoxia. American Journal of Reproductive Immunology. 2000 May;43(5):285–91.. doi: 10.1111/j.8755-8920.2000.430507.x
68. Senthilkumar MP, Dreyer JS. Peritoneal adhesions: pathogenesis, assessment and effects. Trop. Gastroenterol. 2006;27(1):11–8.
69. Shavell VI, Saed GM, Diamond MP. Review: Cellular Metabolism: Contribution to
70. Postoperative Adhesion Development. Reproductive Sciences. 2009 Mar 16;16(7):627–34. doi: 10.1177/1933719109332826
71. Shimotsuma M, Kawata M, Hagiwara A, Takahashi T. Milky Spots in the Human Greater Omentum. Cells Tissues Organs. 1989;136(3):211–6. doi: 10.1159/000146888
72. Shimotsuma M, Simpson-Morgan MW, Takahashi T, Hagiwara A. Activation of omental milky spot macrophages by intraperitoneal administration of a streptococcal preparation, OK-432. Cancer Res. 1992;52(19):5400–2.
73. Schoppmann SF. Limphangiogenesis, inflammation and metastasis. Anticancer Res. 2005;25:4503–11.
74. Thompson J. Pathogenesis and prevention of adhesion formation. Digestive Surgery.1998;15(2):1054–57. doi: 10.1159/000018610
75. Torre M, Favre A, Pini Prato A, Brizzolara A, Martucciello G. Histologic study of peritoneal adhesions in children and in a rat model. Pediatric Surgery International. 2002 Dec;18(8):673–6. doi: 10.1007/s00383-002-0872-6
76. Vodice A. The greater omentum a uselles and hazardous organ for the patient and surgeon. Advantages of omentectomie in all abdominal operations. Dia. Med. Dia Med. 1963 Jan 28;35:69–70.
77. Wang Y, Oliver G. Current views on the function of the lymphatic vasculature in health and disease. Genes & Development. 2010 Oct 1;24(19):2115–26. doi: 10.1101/gad.1955910
78. Yao V, Platell C, Hall JC. Role of peritoneal mesothelial cells in peritonitis. British Journal of Surgery. 2003;90(10):1187–94. doi: 10.1002/bjs.4373
79. Yao V, Platell C, Hall JC. Peritoneal mesothelial cells produce inflammatory related cytokines. ANZ Journal of Surgery. 2004 Nov;74(11):997–1002. doi: 10.1111/j.1445-1433.2004.03220.x
80. Zhang Q-X, Magovern CJ, Mack CA, Budenbender KT, Ko W, Rosengart TK. Vascular Endothelial Growth Factor Is the Major Angiogenic Factor in Omentum: Mechanism of the Omentum-Mediated Angiogenesis. Journal of Surgical Research. 1997 Feb;67(2):147–54. doi: 10.1006/jsre.1996.4983
Для цитирования:
Шевлюк Н.Н., Халикова Л.В., Халиков А.А. Морфофункциональная характеристика большого сальника. Журнал анатомии и гистопатологии. 2020;9(2):90-99. https://doi.org/10.18499/2225-7357-2020-9-2-90-99
For citation:
Shevlyuk N.N., Khalikova L.V., Khalikov A.A. Morphofunctional Characteristic of the Greater Omentum. Journal of Anatomy and Histopathology. 2020;9(2):90-99. (In Russ.) https://doi.org/10.18499/2225-7357-2020-9-2-90-99