Симметричная гипертрофия миокарда лж что это такое
Гипертрофия миокарда сердца — особенности заболевания
Гипертрофия миокарда сердца — это увеличение, разрастание мышечной массы стенки сердца. Такие изменения приводят к изменению размеров, формы органа, утолщению межжелудочковой перегородки.
Симптомы
Как правило, данная патология обнаруживается случайно, в процессе проведения ЭКГ или Эхо-КГ. Специалисты выделяют такие основные признаки гипертрофии миокарда:
Развитие стенокардии происходит в результате сжатия сосудов, обеспечивающих необходимым питанием сердечную мышцу. В конечном итоге происходит увеличение мышцы в размерах. Она начинает потреблять больше кислорода в комплексе с питательными веществами. У пациентов, страдающих от гипертрофии миокарда сердца, также может возникать состояние, в процессе которого замирает сердце на несколько мгновений (не бьется вообще). В этом случае человек теряет сознание.
Диагностика
Как правило, заболевание выявляется при ультразвуковом исследовании. МРТ сердца считается наиболее простым, информативным методом. В определенных случаях заболевание диагностируют при помощи ЭКГ. К дополнительным исследованиям относят: вентрикулографию, коронарографию, а также радиоизотопное исследование.
Профилактика
К числу эффективных профилактических действий по предотвращению развития заболевания относят:
В случае контроля препаратами удается поддерживать нормальный уровень сахара, а также контролировать остальные факторы риска, возникающие при сахарном диабете. Соблюдение таких профилактических мер позволяет избегать развития гипертрофии миокарда сердца.
Лечение гипертрофии миокарда
Для проведения квалифицированного лечения необходимо продиагностировать заболевание, а также определить его характер, особенности течения. На основе этих данных подбирается оптимальный способ лечения. В большинстве случаев лечение гипертрофии миокарда состоит в приеме препарата верампила с бета-блокаторами. Комплексное применение лекарств позволяет снизить симптоматику заболевания, а также нормализовать общее состояние больного. В роли дополнительной терапии необходимо соблюдать назначенную диету, а также отказаться от курения, приема алкоголя. Кроме того, необходимо сокращение количества соли, потребляемых продуктов с максимально высоким содержанием жиров. При лечении физические нагрузки должны быть умеренными.
В особо тяжелых случаях требуется хирургическое вмешательство. В этом случае специалист удаляет гипертрофированную часть мышцы. В процессе лечения состояние пациента отслеживается при помощи ЭКГ.
Реабилитация
Как известно, после проведенного лечения, операционного вмешательства требуется полноценная реабилитация. Лечебная диета является неотъемлемой составляющей реабилитационного процесса. В таком случае питаться необходимо до 6 раз в день небольшими порциями. Мучные изделия при этом нужно ограничить, жирные, копченые блюда также исключаются из рациона. Уровень физических нагрузок необходимо снизить. Полноценная реабилитация позволяет пациенту намного оперативнее восстановиться после проведенного лечения.
Записаться на приём
Запишитесь на приём и получите профессиональное обследование в нашем центре
Гипертрофическая кардиомиопатия
(В.Н. Коваленко, Е.Г. Несукай)
Международные названия
Содержание
Гипертрофическая кардиомиопатия — первичное поражение миокарда, обусловленное генетической неполноценностью сократительных белков, характеризуется ГЛЖ при отсутствии сердечной или системной причины.
Эпидемиология
Широко распространена среди многих расовых групп и в странах Европы, США, Канаде, Израиле, Южной Америке и Дальнем Востоке. В общей популяции ее распространенность составляет 0,2% и наблюдается преимущественно у мужчин.
Этиология
В возникновении заболевания может также иметь значение нарушение взаимодействия развивающегося сердца плода с катехоламинами, тиреоидными гормонами, соматотропином, аденозином.
Распространенность и локализация гипертрофии значительно варьирует, даже среди родственников. Одинаковая мутация может привести к тяжелой гипертрофии желудочка у одного члена семьи и умеренной гипертрофии у другого. Причины этих фенотипических различий у лиц с идентичной генетической мутацией не совсем понятны, но могут быть следствием других генетических факторов, которые играют роль в экспрессии гипертрофии сердца, таких как DD-генотип АПФ, НУП и другие детерминанты роста миоцитов.
Патогенез
К основным патогенетическим факторам ГКМП относятся снижение эластичности и сократительной способности гипертрофированного миокарда ЛЖ с ухудшением его диастолического наполнения, в результате чего в пересчете на единицу массы миокарда работа сердца существенно уменьшается, коронарный кровоток не соответствует степени гипертрофии миокарда. Нарушается скорость проведения возбуждения в желудочках с асинхронным сокращением различных отделов миокарда, что снижает пропульсивную способность ЛЖ.
В результате диастолической дисфункции возникает хроническое повышение конечно-диастолического давления ЛЖ, давления заклинивания капилляров ЛА, застой в легких, прогрессирующая гипертрофия предсердий. Систолическая функция не нарушена или даже усилена вследствие гипердинамичности ЛЖ (ФВ достигает 80–90%), при этом КДО уменьшен (нередко
Патологическая анатомия
Заболевание характеризуется гипертрофией миокарда, наиболее часто в области межжелудочковой перегородки, дезорганизацией кардиомиоцитов и миофибрилл, фиброзом миокарда и поражением мелких сосудов.
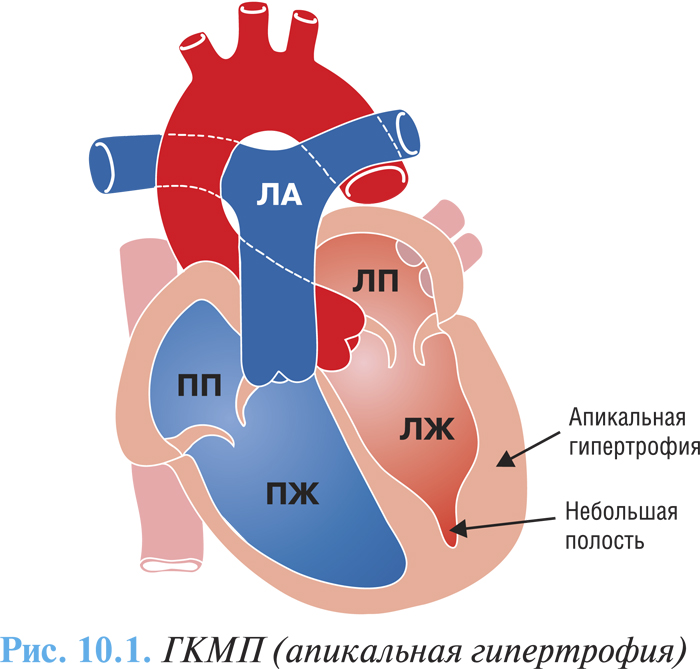
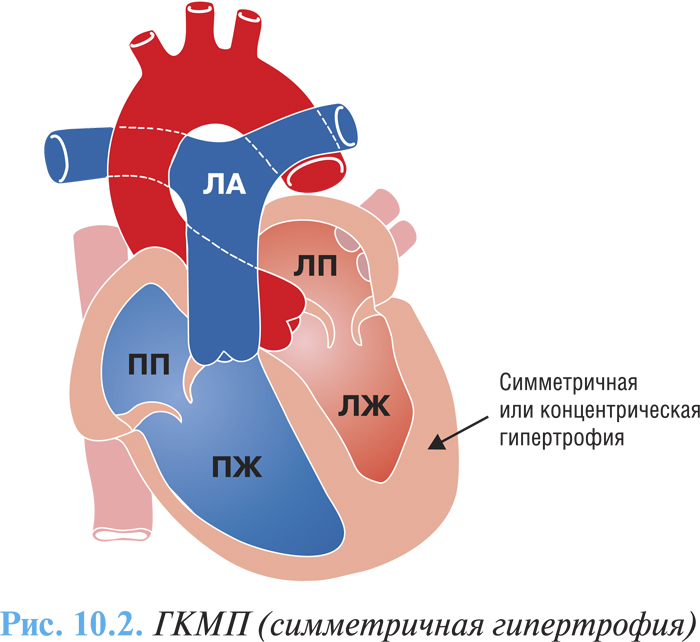
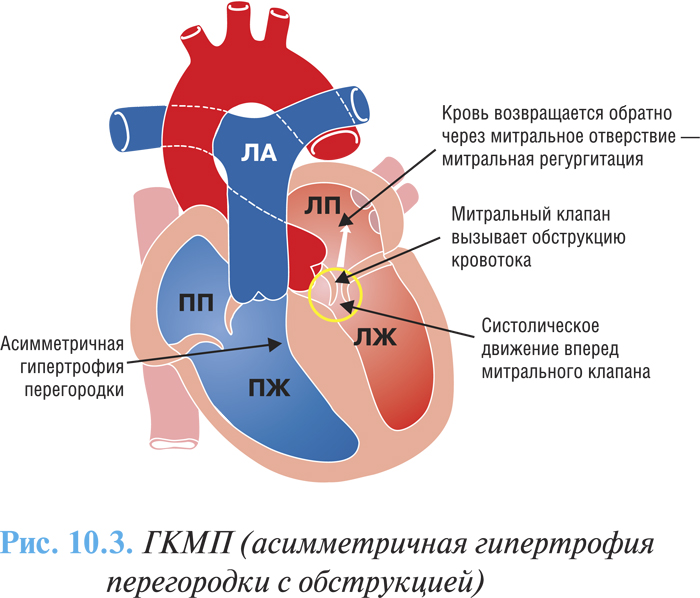
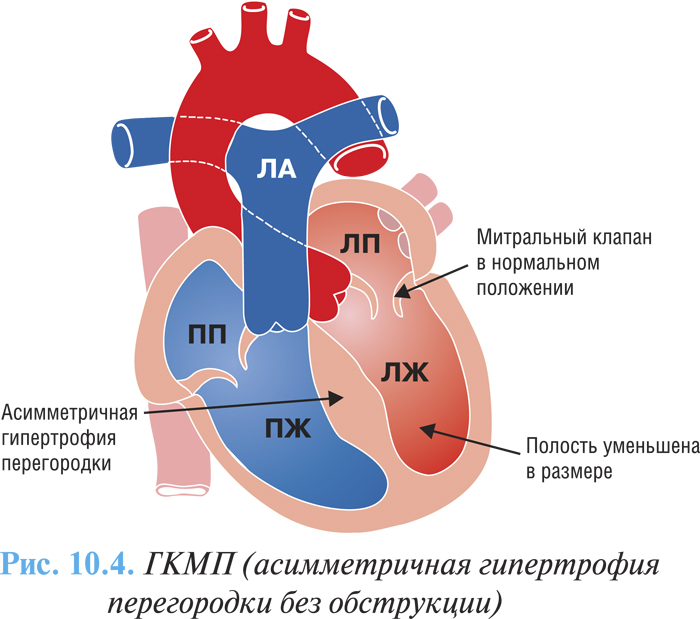
Макроскопически различают три варианта ГКМП: асимметричная (60–95%) — изолированная гипертрофия межжелудочковой перегородки (изолированный гипертрофический субаортальный стеноз); гипертрофия различных отделов ЛЖ, чаще апикальной части (рис. 10.1); симметричная — тотальная концентрическая гипертрофия (5%) (рис. 10.2).
У 25% больных отмечают обструкцию выносящего тракта ЛЖ в покое. Равномерная концентрическая гипертрофия миокарда сопровождается значительным увеличением массы сердца, но обструкции желудочков не наблюдается. ПЖ вовлекается в патологический процесс примерно в 50% случаев, что значительно усугубляет течение заболевания.
В зависимости от выраженности утолщения миокарда выделяют три степени гипертрофии: умеренная (15–20 мм), средней степени (21–25 мм), выраженная гипертрофия (>25 мм).
Характерным анатомическим признаком ГКМП является структурное изменение митрального клапана, передняя створка которого расположена под углом к плоскости клапана, утолщена и «выпадает» в просвет выносящего тракта ЛЖ, образуя дополнительное препятствие кровотоку. Полость ЛЖ небольших размеров, левое предсердие часто гипертрофировано и дилатировано.
Типичные патогистологические изменения включают гипертрофию кардиомиоцитов и нарушение взаимной ориентации мышечных волокон (как наиболее частый результат мутаций саркомеров), а также очаги фиброза и рубцовые изменения вследствие некроза миокарда. Волокна размещаются короткими рядами, имеют склонность к закручиванию при отсутствии изменений интрамуральных сосудов. Ядра клеток изменены, имеют уродливую форму, часто окружены светлой зоной («перинуклеарным нимбом»), в которой отмечается накопление гликогена.
Классификация
В зависимости от степени выраженности преграды оттоку крови выделяют две основные формы ГКМП: обструктивная (рубрика I42.1 по МКБ-10), характеризуется наличием градиента давления между полостью ЛЖ и аортой (рис. 10.3) и необструктивная (рубрика I42.2 по МКБ-10) — без градиента давления (рис. 10.4)
Клиническая картина
Степень обструкции и гипертрофии ЛЖ не коррелирует с наличием клинических симптомов. Заболевание может быть полностью бессимптомным или манифестировать в любом возрасте, наиболее часто симптомы проявляются у 40–50-летних пациентов.
При необструктивной форме отклонений от нормы при физикальном обследовании может не быть, но иногда определяются увеличение продолжительности верхушечного толчка, аускультативно IV тон сердца.
При обструктивной форме при физикальном обследовании выявляется пульсация сонных артерий, быстрый «отрывистый» пульс при пальпации сонных артерий; усиленный продолжительный верхушечный толчок, занимающий всю систолу вплоть до II тона.
Аускультативно тоны сердца глухие, выявляется IV тон, а также определяется систолический шум (crescendo-diminuendo), который не проводится или слабо проводится на сонные артерии и в область спины, усиливается при уменьшении наполнения сердца и снижении ОПСС (вставание из положения сидя на корточках, натуживание, прием нитроглицерина) и ослабевает при увеличении наполнения сердца, повышении ОПСС (в положении лежа, сидя на корточках, при сжимании кулаков).
Течение ГКМП медленно прогрессирующее, тяжесть его зависит от локализации и степени гипертрофии миокарда в зоне утолщения, а также от обструкции выносящего тракта ЛЖ.
Диагностика
Изменения на ЭКГ выявляют у 95% больных. Наиболее частыми из них являются увеличение левого предсердия, нарушения реполяризации ЛЖ в виде депрессии сегмента ST и инверсии зубца Т и патологические зубцы Q (25–30%), признаки гипертрофии ЛЖ. При апикальной гипертрофии возможны глубокие «гигантские» (до 4 см) симметричные отрицательные зубцы Т. Суточное мониторирование ЭКГ позволяет выявить нарушения ритма сердца: желудочковые экстрасистолы (88%), пароксизмы желудочковой тахикардии (25–30%), суправентрикулярные тахиаритмии (30–40%), а также нарушения проводимости.
Рентгенологическую картину во многом определяет степень выраженности заболевания. Возможны следующие рентгенологические изменения: в первой косой проекции появляется выбухание ЛЖ, обусловленное гипертрофией путей оттока, отсутствие талии сердца и закругления дуг, расширение левого предсердия.
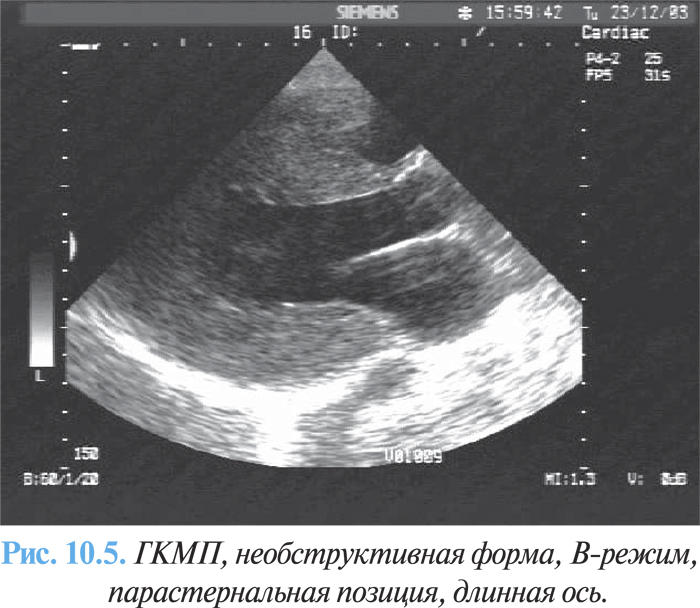
ЭхоКГ является методом выбора и позволяет выявить гипертрофию ЛЖ — утолщение стенки >1,5 мм в диастолу (рис. 10.5), без увеличения его полости, увеличение левого предсердия, нарушение диастолической функции при допплеровской эхоКГ.
По данным эхоКГ-исследования в М-режиме наиболее часто можно выявить асимметричный характер гипертрофии перегородки, систолическое переднее движение митрального клапана, небольшой размер полости ЛЖ, уменьшение подвижности перегородки и преждевременное закрытие аортального клапана.
При двухмерном изображении определяются различные варианты локализации гипертрофии миокарда. Систолическая функция обычно не нарушена, ФВ увеличена (часто >80%).
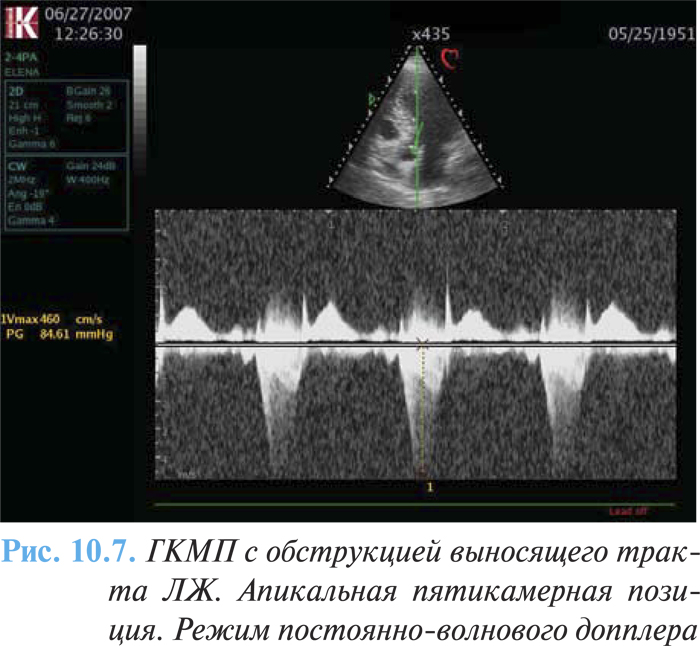
Приблизительно у 25% больных отмечают градиент давления между полостью и выносящим трактом ЛЖ в покое. Хотя клиническое значение градиента выносящего тракта у больных с ГКМП интенсивно обсуждается многие годы, этот градиент в настоящее время рассматривается как показатель истинной обструкции выброса ЛЖ. Принято соглашение, по которому обструкция выносящего тракта ЛЖ определяется при наличии градиента не менее 30 мм рт. ст. (Maron B.J. et al., 2003). Обструкция клинически важна (от средней степени до тяжелой) только в случаях, если градиент выносящего тракта составляет >50 мм рт.ст.
В зависимости от величины градиента давления согласно классификации NYHA выделяют следующие стадии заболевания:
I стадия — градиент давления до 25 мм рт. ст., как правило, жалоб больные не предъявляют;
II стадия — градиент давления до 36 мм рт. ст., самочувствие ухудшается при физической нагрузке;
III стадия — градиент давления до 44 мм рт. ст., выражены клинические симптомы — стенокардия, одышка и нарушения гемодинамики;
IV стадия — градиент давления 80 мм рт. ст. и выше, имеются значительные нарушения гемодинамики.
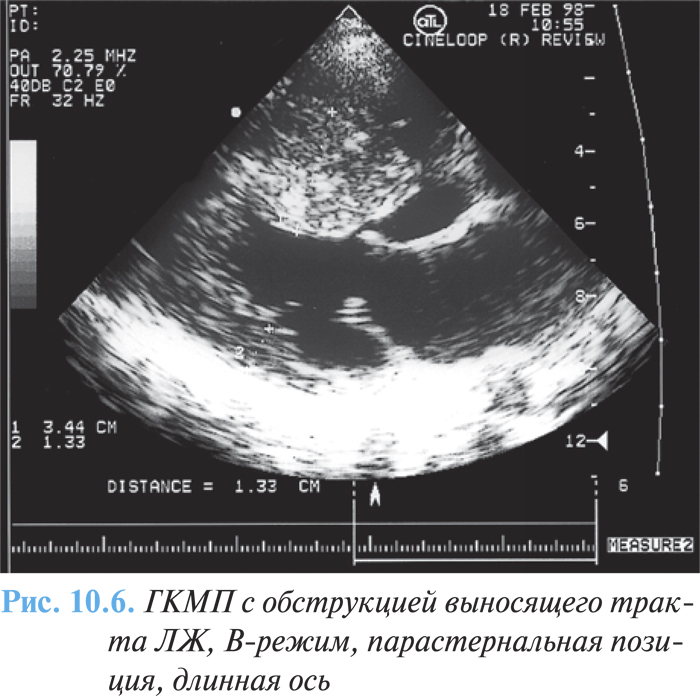
При проксимальной форме ГКМП (субаортальном стенозе) наиболее характерными эхоКГ-признаками являются утолщение межжелудочковой перегородки и снижение ее экскурсии в базальном сегменте, увеличение соотношения толщины межжелудочковой перегородки и задней стенки более 1,3 (1,5–2) (рис. 10.6), наличие градиента давления при допплеровской эхоКГ (рис. 10.7).
Для дистальной формы (апикальной ГКМП) при эхоКГ-исследовании наиболее характерно утолщение и уменьшение амплитуды движения межжелудочковой перегородки в верхушечном сег менте по длинной оси в двухмерном изображении, полость ЛЖ в левой апикальной четырехкамерной позиции пикообразной формы за счет гипертрофии дистальных отделов межжелудочковой перегородки и прилегающих отделов задней стенки ЛЖ.
Концентрическая (симметричная) форма характеризуется утолщением межжелудочковой перегородки и задней стенки ЛЖ в диастолу при значительном увеличении общей массы миокарда, уменьшением систолического и диастолического объемов ЛЖ, повышением индекса соотношения размеров левого предсердия и устья аорты.
Изолированная гипертрофия ПЖ при эхоКГ-исследовании имеет следующие признаки: увеличение диастолической толщины и уменьшение амплитуды движения межжелудочковой перегородки в верхушечном сегменте, утолщение передней стенки и уменьшение диастолического размера ПЖ.
При биопсии миокарда выявляют хаотическое расположение и укорочение волокон миокарда, дегенеративные изменения с исчезновением миофибрилл, деформацию ядер клеток, фиброзное замещение миокарда.
Катетеризацию полостей сердца обычно проводят при клинически выраженной митральной регургитации для оценки возможности хирургического лечения. Внутрижелудочковые градиенты давления выявляют в ЛЖ и реже в ПЖ. Градиент повышается после экстрасистол, во время пробы Вальсальвы и после ингаляции амилнитрита. Конечно-диастолическое давление повышено вследствие сниженной податливости желудочка.
По данным вентрикулографии выявляют характерную деформированность камеры, зависящую от формы ГКМП и также иногда подтверждают митральную регургитацию. Коронарные артерии обычно широкие с адекватным кровотоком.
С помощью МРТ можно наиболее точно оценить морфологические изменения, распространенность и выраженность гипертрофии миокарда, особенно при диагностике верхушечной формы и гипертрофии нижней части межжелудочковой перегородки и ПЖ, определить систолическую и диастолическую функцию ЛВ.
При подозрении на ГКМП диагноз устанавливают по данным генетического исследования (анализ ДНК), которое позволяет выявить характерные мутации генов, ответственных за синтез сократительных белков кардиомиоцитов.
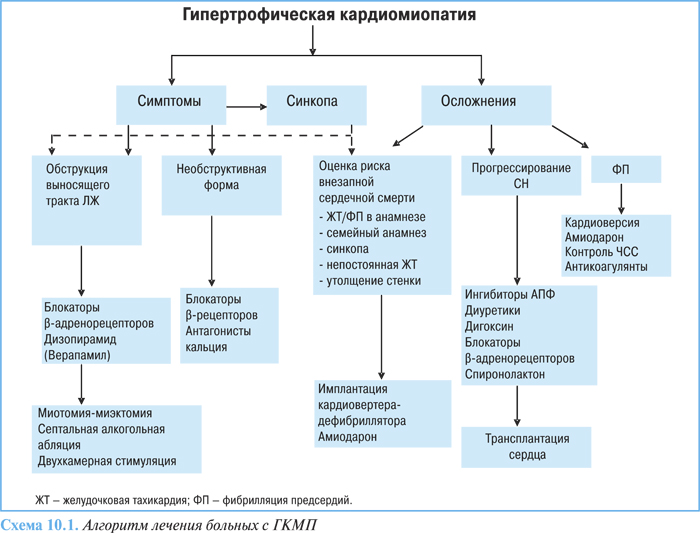
Лечение
Должно быть направлено на уменьшение диастолической дисфункции, гипердинамической функции ЛЖ и устранение нарушений ритма сердца.
Общие мероприятия включают ограничение физических нагрузок, которые усугубляют гипертрофию миокарда, повышают внутрижелудочковый градиент давления и риск внезапной смерти.
Блокаторы β-адренорецепторов являются препаратами первой линии у больных независимо от наличия или выраженности градиента внутрижелудочкового давления, имеющих симптомы одышки или непереносимости физических нагрузок: сниженной сократимостью ЛЖ, ограниченным латентным градиентом выносящего тракта, сниженным потреблением кислорода миокардом и ишемией (схема 10.1). Блокаторы β-адренорецепторов улучшают симптомы у 70% больных, снижая ЧСС, таким образом улучшая пассивное наполнение желудочков и уменьшая потребность миокарда в кислороде.
Альтернативой может быть применение верапамила, который в дозе до 480 мг/сут у больных как с необструктивной, так и обструктивной ГКМП уменьшает выраженность симптоматики, особенно боли в области сердца, улучшает расслабление и наполнение желудочков, уменьшает ишемию миокарда и сократимость ЛЖ. При применении верапамила может возникать ухудшение гемодинамики, увеличение обструкции выносящего тракта, повышение давления в ЛА.
С осторожностью следует давать нагрузки больным с обструкцией выносящего тракта ЛЖ в покое.
При наличии нарушений сердечного ритма целесообразно назначать блокаторы β-адренорецепторов и антиаритмические средства, однако следует отметить, что применение последних не снижает риск внезапной смерти. У симптоматичных пациентов с обструкцией дизопирамид действует как антиаритмическое средство (в отношении как суправентрикулярных, так и желудочковых аритмий) и как отрицательный инотропный агент вызывает уменьшение выраженности симптомов. В дозах 300–600 мг/ сут может уменьшать обструкцию выносящего тракта и объем митральной регургитации. Для уменьшения выраженности побочных эффектов можно применять в комбинации с блокаторами β-адренорецепторов в низких дозах. Не следует применять дизопирамид с соталолом/амиодароном вследствие риска проаритмогенного действия.
Наличие фибрилляции предсердий обычно хорошо переносится, однако у больных с тяжелой диастолической дисфункцией потеря предсердного «вклада» вследствие аритмии может иметь необратимые гемодинамические последствия, что требует неотложного восстановления синусового ритма посредством электрической или медикаментозной кардиоверсии с помощью амиодарона. Последний эффективен для предупреждения пароксизмов фибрилляции предсердий. Контроль ритма с помощью блокаторов β-адренорецепторов или верапамила улучшает клинический статус пациентов. Применение варфарина показано как при пароксизмальной, так и при постоянной форме фибрилляции предсердий.
Рекомендуется профилактическое применение антибиотиков для предупреждения возникновения инфекционного эндокардита.
При лечении СН у больных с ГКМП терапевтическая стратегия должна быть направлена на стимуляцию регрессии гипертрофии ЛЖ и устранение симптомов СН путем снижения давления наполнения ЛЖ без уменьшения величины сердечного выброса. В этих случаях препаратами выбора могут быть ингибиторы АПФ и антагонисты рецепторов ангиотензина II из-за их способности блокировать РААС и вызывать обратное развитие гипертрофии ЛЖ.
Клинические исследования, проведенные в последние годы, продемонстрировали благоприятное действие ингибиторов АПФ на ряд важных показателей диастолической функции, включая диастолическое наполнение, изоволюмическое расслабление и взаимосвязь давление — объем ЛЖ и возможность обратного развития процессов ремоделирования миокарда. При этом улучшение диастолической функции (улучшение диастолической растяжимости и способности к расслаблению миокарда, снижение конечно-диастолического давления наполнения ЛЖ) было более выражено у больных с исходно более тяжелой степенью дисфункции.
Лечебные мероприятия при ГКМП и СН в определенной степени носят парадоксальный характер. Диуретики следует применять с осторожностью, предпочтительно при отсутствии значимой обструкции выносящего тракта.
Инотропные агенты, направленные на стимуляцию систолического выброса (сердечные гликозиды и прессорные амины), могут оказывать неблагоприятный гемодинамический эффект — они усиливают обструкцию выносящего тракта и не снижают повышенное конечно-диастолическое давление, могут вызвать развитие асистолии. При сохраненной систолической функции может возникнуть негативный эффект из-за усиления сократимости путем повышения внутриклеточной концентрации ионов кальция. Таким образом, при ГКМП «чистый» эффект от положительных инотропных средств (как увеличение жесткости миокарда, так и повышение давления наполнения ЛЖ) приводит к ухудшению диастолической функции. Тем не менее, дигоксин можно применять у больных с диастолической дисфункцией и фибрилляцией предсердий для снижения ЧСС и/или для восстановления синусового ритма.
Показания к проведению немедикаментозной терапии:
В последнее время успешно апробирован новый метод для уменьшения обструкции выносящего тракта у больных, рефрактерных к медикаментозной терапии, — перкутанная алкогольная абляция межжелудочковой перегородки. Успешная алкогольная абляция сопровождается прогрессивным уменьшением градиента в период от 6 до 12 мес у 80% больных, что сопровождается улучшением клинического статуса, уменьшением выраженности симптомов и диастолической дисфункции и увеличением переносимости физических нагрузок.
Целью хирургического вмешательства при обструкции выносящего тракта является устранение систолического переднего движения митрального клапана и септально-митрального контакта путем расширения выносящего тракта ЛЖ. Наиболее часто выполняется септальная миотомия-миэктомия, в результате которой у 95% больных отмечают значительное уменьшение градиента выносящего тракта, митральной регургитации, у 70% улучшаются клинические симптомы. Приблизительно у 5% пациентов операция осложняется аортальной регургитацией, которая обычно гемодинамически незначима.
Прогноз
Неблагоприятный, наиболее часто больные умирают внезапно, на фоне тяжелой физической нагрузки, в том числе при бессимптомном течении заболевания. ХСН развивается менее часто. Установленные факторы риска внезапной смерти при ГКМП: манифестация заболевания в молодом возрасте (до 16 лет), наличие в семейном анамнезе эпизодов внезапной смерти, частые синкопальные состояния, непродолжительные эпизоды желудочковой тахикардии, выявленные при 24-часовом мониторировании ЭКГ, патологическое изменение уровня АД при физической нагрузке. Степень гипертрофии ЛЖ или наличие обструкции выносящего тракта ЛЖ прогностического значения не имеют.
Симметричная гипертрофия миокарда лж что это такое
МКБ 10: I42.1/I42.2
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
ID: КР283
Общество специалистов по сердечной недостаточности Общество специалистов по неотложной кардиологии
Ключевые слова
обструкция выходного тракта левого желудочка
внезапная сердечная смерть
Список сокращений
ангиотензин – превращающий фермент
блокаторы кальциевых каналов
блокаторы рецепторов ангиотензина II
внезапная сердечная смерть
выходной тракт левого желудочка
гипертрофия левого желудочка
диастолическая дисфункция (диастолическая функция)
ингибиторы ангиотензин-превращающего фермента
легочный венозный поток
мозговой натрийуретический пептид
нарушения ритма сердца
неустойчивая желудочковая тахикардия
обструкция выходного тракта ЛЖ
однофотонная эмиссионная компьютерная томография миокарда
пароксизмальная мерцательная аритмия
предсердный натрийуретический пептид
переднее систолическое движение
позднее усиление сигнала гадолиния
ренин – ангиотензин – альдостероновая система
септальная алкогольная аблация
суточное мониторирование ЭКГ
толщина задней стенки левого желудочка
тканевая миокардиальная допплер-эхокардиография
трансмитральный диастолический поток
толщина межжелудочковой перегородки
фракция выброса левого желудочка
частота сердечных сокращений
Американская ассоциация сердца
Европейское Общество Кардиологов
ген лизосом-2-ассоциированного мембранного белка 2
Нью-Йоркская ассоциация кардиологов
N-концевой фрагмент предшественника мозгового НУП
Термины и определения
Обструктивная гипертрофическая кардиомиопатия (ОГКМП) – форма ГКМП, сопровождающаяся в связи с нарушениями внутрисердечной гемодинамики развитием градиента давления (Гр. Д) в выходном тракте левого желудочка (ВТЛЖ) и/или реже в среднем отделе ЛЖ > 30 мм. рт. ст., что определяет клиническую картину и имеет важное практическое значение при выборе тактики лечения.
Стратификация риска ВСС – определение независимых предикторов, определяющих вероятность риска ВСС у пациентов с определенной сердечно-сосудистой патологией.
1. Краткая информация
Кардиомиопатии, по-прежнему, остаются одними из наименее изученных кардиологических заболеваний, являясь объектом активно развивающейся области современной кардиологии. Повышенный интерес к проблеме изучения заболеваний миокарда объясняется необходимостью дальнейшего изучения этиологии и патогенеза, многообразием и неспецифичностью их клинических проявлений, значительными диагностическими и терапевтическими трудностями. Постоянный рост частоты встречаемости различных форм кардиомиопатий связан, по-видимому, как с истинным увеличением числа подобных больных, так и с прогрессом современных диагностических технологий. Кроме того, за последнее десятилетие формируется принципиально новая концепция по вопросам определения понятия «кардиомиопатии» и их места в структуре заболеваний сердца, что связано с достижениями медицинской генетики, морфологии, иммунологии и молекулярной эндокринологии. Отражением современной эволюции знаний является постоянный пересмотр, обновление и уточнение соответствующего понятия и классификации.
Гипертрофическая кардиомиопатия (ГКМП) – одна из основных и наиболее распространенных форм первичных кардиомиопатий. Полувековая история изучения проблемы ГКМП отражает значительную эволюцию знаний в вопросах этиологии, патогенеза, прогноза, вариантов клинического течения и лечения заболевания. Углубленное изучение различных аспектов патологии было тесно связано и обеспечено появлением прогрессивных инструментальных, морфологических, и наконец, молекулярно-генетических методов диагностики. Внедрение в практику современных визуализирующих методик: эхокардиографии (ЭХО-КГ), допплерографии, однофотонной эмиссионной компьютерной (ОЭКТ) и позитронно-эмиссионной томографии (ПЭТ), магнитно-резонансной томографии (МРТ), мониторирование ЭКГ, определило прогресс в понимании механизмов патогенеза, диагностики заболеванияи обоснования лечебной тактики.
1.1. Определение
В 2003 году создан Международный Комитет, объединивший американских и европейских экспертов по ГКМП, и опубликовано сообщение, суммировавшее основные положения, включая стратегию лечебных мероприятий [2]. В конце 2011 года члены рабочей группы ACCF/AHA (Американская ассоциация сердца) оформили новые рекомендации по вопросам номенклатуры, эпидемиологии, этиологии, патофизиологии, диагностики, вариантов течения и лечения ГКМП, основанных на детальном анализе результатов многоцентровых исследований [3].В августе 2014 года опубликованы последние клинические рекомендации Европейского общества кардиологов (ESC) [4].
Гипертрофическая кардиомиопатия определяется наличием утолщения стенки левого желудочка (ЛЖ), что не может объясняться исключительно повышением нагрузки давлением.
Основным методом диагностики остается эхокардиографическое исследование (ЭХО-КГ). В настоящее время особое место занимают современные визуализирующие методики, в частности магнитно-резонансная томография (МРТ), обладающая большей разрешающей способностью и позволяющая получить более точную информацию о структурных нарушениях в сердце.
1.2. Этиология и патогенез
1.2.1. Генетические аспекты ГКМП
Общепризнанной является концепция о наследственной природе ГКМП. В литературе широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». Большинство (не менее 60%) всех случаев заболевания являются наследуемыми, при этом основным типом наследования является аутосомно-доминантный при разной степени пенетрантности и с 50%-ым риском передачи потомкам [13, 14, 16]. Оставшиеся случаи объясняются мутациями denovo, но внешне спорадические случаи, когда у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда, могут появляться в связи с неполной пенетрантностью заболевания у родителей или, реже, при аутосомно-рециссивном наследовании.Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, то есть, вызваны случайными и/или неустановленными мутациями.
ГКМП является генетически гетерогенным заболеванием, причиной которого являются около 1500 описанных к настоящему времени мутаций нескольких генов, кодирующих белки сердечного саркомера и некоторые несаркомерные белки [13, 14, 15, 16]. Типичная картина заболевания рассматривается как генетически обусловленная болезнь сердечного саркомера.
К настоящему времени известны 11 белковых компонентов, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП (табл. 1). Причём в каждом гене множество дефектов могут быть причиной заболевания (полигенное мультиаллельное заболевание).
Таблица 1. Основные генетические детерминанты ГКМП