Синдром линча что это такое
Синдром Линча
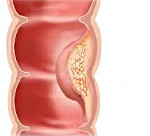
Синдром Линча – наследственное заболевание, сопровождающееся развитием злокачественных новообразований в толстом кишечнике. Клинические проявления аналогичны другим видам колоректального рака. Отличительными особенностями являются раннее начало, высокая частота первично-множественных опухолей и преимущественное поражение правых отделов толстого кишечника. При синдроме Линча-II колоректальный рак сочетается с внекишечными злокачественными неоплазиями. Диагноз выставляется с учетом семейного анамнеза, иммуногистохимических тестов, колоноскопии, ирригоскопии, биопсии и других исследований. Лечение – операции, химиотерапия.
Общие сведения
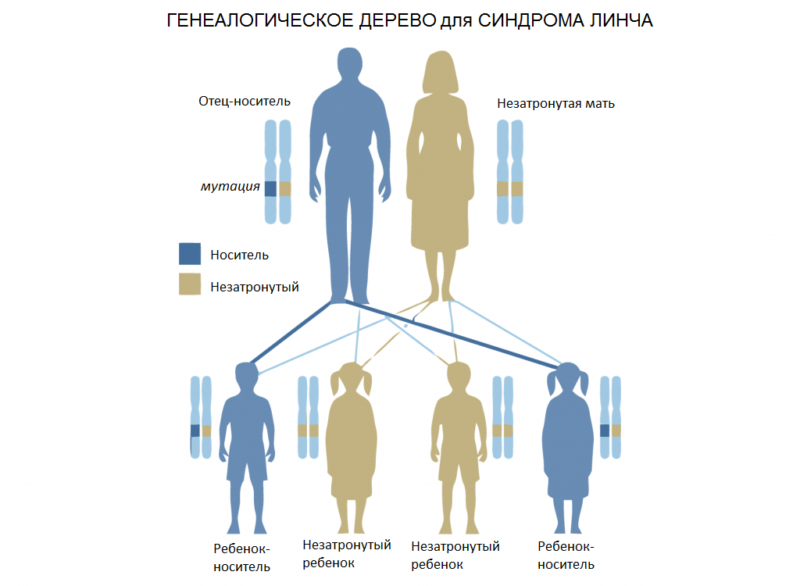
Синдром Линча (наследственный неполипозный колоректальный рак) – генетически обусловленное заболевание, при котором наблюдается развитие злокачественных опухолей толстого кишечника. Передается по аутосомно-доминантному типу. Составляет около 3% от общего количества случаев колоректального рака. В 30% случаев при синдроме Линча отмечается возникновение синхронных или метахронных неоплазий. В ряде случаев новообразования толстой кишки сочетаются с онкологическими поражениями яичников, матки, мочевого пузыря, почечной лоханки, мочеточника, желудка, желчных путей и тонкого кишечника.
Риск развития онкологического заболевания у больных синдромом Линча с подтвержденной генетической мутацией колеблется от 30 до 80%. Отличительной особенностью является раннее начало заболевания. Злокачественные опухоли при синдроме Линча обычно диагностируются в возрасте до 50 лет, на 10-15 лет раньше, чем в среднем по популяции. Средний возраст появления первых симптомов составляет 44 года. Около 70% неоплазий локализуются в правой половине толстого кишечника. Лечение проводят специалисты в сфере онкологии, абдоминальной хирургии и гастроэнтерологии.
Причины развития и классификация синдрома Линча
Причиной развития являются мутации генов, ответственных за ошибки репарации ДНК: PMS2, MSH6, MSH2 и MLH1. Возможно сочетание нескольких мутаций с соответствующим увеличением риска возникновения злокачественных новообразований. Выявляется аутосомно-доминантный характер наследования. Обычно у больных с синдромом Линча диагностируются слизистые аденокарциномы или перстневидно-клеточный рак. Для опухолей характерен низкий уровень дифференцировки клеток при редком метастазировании, хорошем ответе на терапию и относительно благоприятном прогнозе.
Различают два типа заболевания: синдром Линча-I и синдром Линча-II. Первый вариант протекает без внекишечных проявлений, единственным признаком заболевания является раннее развитие множественных неоплазий толстого кишечника при отсутствии предшествующего полипоза. При синдроме Линча-II наблюдается сочетание аденокарцином толстой кишки и злокачественных опухолей других локализаций. Обычно страдают внутренние женские половые органы, возможно также поражение вышележащих отделов пищеварительного тракта. Вероятность развития рака эндометрия при синдроме Линча-II составляет от 30 до 60%, риск возникновения новообразований других локализаций – 10-15%.
Симптомы синдрома Линча
До появления злокачественных опухолей толстого кишечника симптоматика отсутствует. При развитии неоплазий клинические проявления соответствуют ненаследственному колоректальному раку. Наблюдаются боли, нарушения аппетита, расстройства стула, слабость и анемия. Из-за высокого расположения новообразований кровь в кале при синдроме Линча визуально обычно не определяется. Выраженность и характер болевого синдрома существенно варьируют. Обычно пациенты жалуются на ноющие либо тянущие боли слабой или средней интенсивности. Реже у больных синдромом Линча возникает кратковременная приступообразная боль, напоминающая боли при остром холецистите или остром аппендиците.
При пальпации достаточно крупных опухолей определяются малоподвижные узлы плотно- или мягкоэластической консистенции. При прогрессировании злокачественного новообразования у больных синдромом Линча выявляются симптомы интоксикации, возникшие из-за распада неоплазии, и явления кишечной непроходимости, обусловленные препятствием прохождению каловых масс по кишечнику. При отдаленном метастазировании наблюдаются нарушения функций соответствующих органов. Отмечаются выраженная слабость, эмоциональная лабильность, склонность к депрессиям, повышение температуры и прогрессирующее истощение.
Симптомы опухолей других локализаций при синдроме Линча также соответствуют ненаследственным формам онкологических поражений тех или иных органов. Рак эндометрия и рак яичников на начальных стадиях могут протекать бессимптомно. В последующем при раке эндометрия наблюдаются боли, кровянистые, серозные или серозно-сукровичные выделения. При распространении новообразования на соседние органы возникают расстройства дефекации и мочеиспускания. Для рака яичников характерны ощущение дискомфорта, увеличение живота, нарушения менструального цикла и т. д.
Диагностика синдрома Линча
До появления злокачественных новообразований синдром Линча диагностируют на основании семейной истории и данных генетических исследований. Из-за незначительной распространенности в популяции проведение всеобщих скрининговых обследований считается нецелесообразным, генетические анализы выполняют только при выявлении соответствующего семейного анамнеза. Анамнестическими критериями синдрома Линча являются наличие гистологически подтвержденных карцином толстого кишечника у трех или более близких родственников, являющихся представителями двух или более поколений, а также один или несколько случаев начала заболевания в возрасте младше 50 лет.
Для обнаружения характерных для синдрома Линча генетических мутаций используют иммуноферментные исследования и тест на микросателлитную нестабильность. При появлении клинических признаков заболевания пациентов с синдромом Линча направляют на ирригоскопию и колоноскопию. Выполняют анализ кала на скрытую кровь. Осуществляют УЗИ, КТ или МРТ брюшной полости. План обследования больных синдромом Линча с подозрением на злокачественные опухоли женских половых органов и верхних отделов ЖКТ составляют с учетом установленных стандартов для неоплазий соответствующих локализаций. Перечень исследований при подозрении на отдаленное метастазирование определяют с учетом предположительного расположения вторичных очагов.
Лечение и профилактика при синдроме Линча
Всех пациентов с подтвержденной наследственной мутацией рассматривают, как представителей группы риска. Больным с синдромом Линча необходимо пожизненное диспансерное наблюдение, включающее в себя регулярные осмотры онколога и гастроэнтеролога, проведение колоноскопии 1 раз в 1-2 года, начиная с 25 лет, фиброгастродуоденоскопии и УЗИ брюшной полости – 1 раз в 1-2 года, начиная с 30 лет. Женщинам с синдромом Линча проводят регулярные гинекологические осмотры. Инструментальные обследования назначают 1 раз в 1-2 года, начиная с 30 лет.
При возникновении злокачественной опухоли толстого кишечника предпочтительным вариантом для больных синдромом Линча является субтотальная колэктомия. Это хирургическое вмешательство позволяет увеличить продолжительность жизни и обеспечивает более благоприятный прогноз по сравнению с частичной резекцией толстой кишки. Учитывая влияние удаления значительной части толстого кишечника на качество жизни пациентов, решение о проведении подобной операции принимают после подробного разъяснения последствий вмешательства. Вопрос о целесообразности химиотерапии при синдроме Линча пока остается дискутабельным, хотя некоторые исследователи указывают на достаточно высокую эффективность иринотекана.
Синдром Линча
Синдром Линча относится к наследственным заболеваниям с аутосомно-доминантным типом наследования. Он развивается в результате мутации в одном или нескольких генах (MHL1, PMS2, MSH2, MSH6), которые могут проявляться в различных сочетаниях. Чем больше генов изменяется, тем тяжелее протекает заболевание. Синдром Линча бывает двух типов. При первом типе у пациентов обнаруживают злокачественные опухоли только в толстой кишке, а при втором выявляются дополнительные очаги в других органах. Именно эта особенность определяет клинику, диагностику и лечение больных синдромом Линча.
Так как основные проявления синдрома Линча связаны с онкологическими процессами, то в клинической картине будут преобладать характерные симптомы. Пока опухоль находится на ранней стадии и имеет небольшие размеры, пациента может ничего не беспокоить. По мере прогрессирования опухолевого процесса в толстом кишечнике постепенно появляются следующие симптомы:
При распаде опухоли, нарушении целостности толстой кишки или высокой агрессивности опухоли клиника при синдроме Линча более яркая. У пациента может развиваться кишечная непроходимость, перитонит, общая интоксикация организма. При появлении отдаленных метастазов присоединяются симптомы, характерные для пораженного органа.
Методы диагностики
Чтобы выявить синдром Линча до появления клинических признаков, изучается семейный анамнез. Если у близких родственников первой степени родства было диагностировано данное заболевание, то назначается генетическое исследование, направленное на поиск мутаций в генах MHL1, PMS2, MSH2, MSH6. Так как синдром Линча выявляется достаточно редко, то узконаправленных методов скрининга не разработано. Однако существуют способы раннего выявления злокачественных опухолей, в том числе и для толстой кишки. В их число входят анализы кала на скрытую кровь, колоноскопия, УЗИ органов брюшной полости, МРТ, КТ, определение в крови специфических онкомаркеров. Если опухолевый процесс выявлен в запущенной форме, то для поиска отдаленных очагов назначается дополнительное обследование.
В тех случаях, когда генетическое тестирование достоверно подтвердило наличие синдрома Линча, пациент включается в особую группу с повышенным риском развития рака. Он должен состоять на пожизненном диспансерном наблюдении и как можно чаще проходить профилактические обследование, направленное на раннее выявление онкологии.
Лечение колоректального рака у пациентов с синдромом Линча проводится по стандартным протоколам. В зависимости от характеристик опухоли назначается частичная резекция или субтотальное удаление толстой кишки. Химиотерапия в подобных случаях обычно не показана, однако некоторые исследования показывают хорошую эффективность определенных лекарственных препаратов. При наличии злокачественных опухолей в других органах врач составляет соответствующий план лечения по принятым стандартам.
В целом прогноз при синдроме Линча во многом зависит от агрессивности и распространенности опухолевого процесса. При удалении опухоли на ранних стадиях удается добиться высокой продолжительности жизни, но так как риск рецидива остается высоким, профилактическое наблюдение за пациентом продолжается.
Синдром Линча
(Наследственная неполипозная колоректальная карцинома; ННПКРК)
, MD, Fox Chase Cancer Center, Temple University
Симптомы и признаки синдрома Линча
Симптомы и признаки синдром Линча сходны с таковыми при других формах колоректальный рак, применяются те же принципы диагностики и лечения опухоли.
Диагностика синдрома Линча
Подробный семейный анамнез
Клинические критерии сопровождаемые исследованием на микросателлитную нестабильность (МСН) или иммуногистохимией (ИГХ)
Генетическое исследование для подтверждения диагноза
(См. также Диагностика и терапия синдрома Линча 2015 г [2015 diagnosis and management of Lynch syndrome] и Клиническое руководство по генетическому тестированию и лечению наследственных синдромов рака желудочно-кишечного тракта Американской коллегии гастроэнтерологов [American College of Gastroenterology’s clinical guideline on the genetic testing and management of hereditary GI cancer syndromes.)
Специфический диагноз синдрома Линча подтверждают генетическим тестированием. Тем не менее сложно определить, кому проводить тестирование, поскольку, в отличие от семейного аденоматозного полипоза, нет типичной фенотипической картины. Таким образом, при подозрении на синдром Линча подробный семейный анамнез должен быть собран у всех пациентов молодого возраста с колоректальным раком (КРР).
Для установления соответствия Амстердамским критериям II диагностики синдрома Линча необходимо наличие всех трех из описанных признаков:
Три или более родственника с КРР или раком, ассоциированным с синдромом Линча
КРР отмечается по крайней мере в двух поколениях;
по крайней мере в одном случае КРР развился в возрасте
Пациентам, отвечающим этим критериям, необходимо провести анализ опухолевых тканей или на микросателлитную нестабильность или с помощью иммуногистохимических методов определить протеины, которые отвечают за репарацию ошибок репликации ДНК; впрочем, большинство коммерческих и госпитальных патологоанатомических лабораторий в настоящее время, в рабочем порядке, выполняют этот анализ на всех образцах колоректальной аденокарциномы. Руководство American Gastroenterological Association 2015 года рекомендуют проводить иммуногистохимические исследования и тест на микросателитную недостаточность пациентам с опухолями. Показано генетическое тестирование на наличие генетических мутаций, специфичных для синдрома Линча, если результаты ИГС (иммуногистохимических) исследований или анализ на МСН (микросателитную недостаточность) были положительными.
Пациентам с синдромом Линча должна проводиться контрольная колоноскопия каждые 1-2 года. Пациенты с подтвержденным синдромом Линча нуждаются в непрерывном скрининге на предмет рака других органов. Для выявления рака эндометрия рекомендуется ежегодно проводить аспирацию эндометрия или трансвагинальное УЗИ. Для выявления рака яичников следует ежегодно проводить трансвагинальное УЗИ и исследование уровня СА-125 в сыворотке. Также может рассматриваться профилактическое удаление матки с придатками. Для скрининга рака почки можно применять общий анализ мочи.
Родственникам пациентов с синдромом Линча 1-й степени родства необходимо провести генетическое тестирование. В случае, если генетическое тестирование не было проведено, им необходимо проводить колоноскопию каждые 1–2 года, начиная с 20 лет, а в возрасте старше 40 лет – ежегодно. Родных 1-й степени родства женского пола необходимо ежегодно обследовать на рак эндометрия и яичников.
Справочные материалы по диагностике
1. Umar A, Boland CR, Terdiman JP, et alUmar A, Boland CR, Terdiman JP, et al: Revised Bethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst 96(4):261–268, 2004. doi: 10.1093/jnci/djh034
Лечение синдрома Линча
Наиболее распространенным лечением синдрома Линча является резекция наибольшего пораженного опухолью участка с частым наблюдением на предмет развития другого вида рака толстой кишки и любых ассоциированных опухолей других органов. Поскольку большинство опухолей при синдроме Линча развиваются проксимальнее селезеночного изгиба, как один из методов хирургического лечения проводится субтотальная колэктомия с сохранением ректосигмоидного отдела. В любом случае необходимо тщательное наблюдение пациента.
Ключевые моменты относительно синдрома Линча
Определенные аутосомные доминантные генетические мутации несут 70–80% – риск развития колоректального (КРР) в течение жизни.
У таких пациентов также повышен риск развития других опухолей, особенно рака эндометрия и яичников.
Клинические проявления, принципы диагностики и лечения сходны с таковыми для других форм колоректального рака.
В случаях, соответствующих определенным критериям наследственной отягощенности, следует исследовать ткань опухоли на микросателлитную нестабильность (МСН) или провести иммунохимический анализ; при позитивном результате проводится генетическое тестирование.
Родным пациентов с ННПКРР 1-й степени родства, которым не было проведено генетическое тестирование, необходимо проводить колоноскопию каждые 1–2 года, начиная с 3-ей декады жизни, а в возрасте старше 40 лет – ежегодно. Женщин необходимо ежегодно обследовать на рак эндометрия и яичников.
Дополнительная информация о синдроме Линча
Ниже следуют некоторые англоязычные ресурсы, которые могут быть информативными. Обратите внимание, что The manual не несет ответственности за содержание этих ресурсов.
PREMM5: Prediction model for MLH1, MSH2, MSH6, PMS2, and EPCAM gene mutations
Генетический ландшафт синдрома Линча
Наследственные опухолевые синдромы характеризуются наличием генетического дефекта, приводящего к крайне высокому риску развития неоплазий определенных локализаций. Ранний возраст возникновения опухолей и особые фенотипические признаки, определяющие возможности терапии и прогноз, обусловливают важность включения в программу обследования пациентов консультации врача-генетика (онкогенетика), который определит необходимость проведения высокоспецифичных (а также относительно дорогостоящих) молекулярно-генетических исследований с анализом нуклеиновых кислот и выявлением герминальных мутаций в определенных генах.
От 20 до 30 % случаев колоректального рака (КРР) предположительно связаны с генетическими факторами, а 3–5 % этой патологии представлены наследственными формами КРР с идентифицированной генетической составляющей [1].
Синдром Линча (СЛ) — наиболее распространенная форма наследственного КРР (2–4 % всех случаев КРР). При наличии этого синдрома риск развития КРР составляет 20–70 % при относительно раннем возрасте постановки первичного диагноза (от 44 до 61 года, наиболее часто в период с 40 до 45 лет, при этом у больных со спорадическими формами КРР средний возраст развития заболевания около 69 лет) [2].
Это аутосомно-доминантное наследственное заболевание, основа которого — герминальная мутация в генах системы репарации ошибочно спаренных оснований ДНК (МisМatch Repair, MMR). Функция этой системы — исправление ошибок между некомплементарными основаниями при скольжении ДНК-полимеразы в период репликации [3].
СЛ долгое время характеризовался как наследственный неполипозный колоректальный рак (HНКРР). Это название отражало морфологическое отличие от другой формы наследственного КРР — семейного аденоматозного полипоза, важным признаком которого является обнаружение от 100 до 1000 полипов. Но все же термин ННКРР не совсем корректен, так как у больных СЛ отмечается возникновение от одного до нескольких аденоматозных полипов толстой кишки, а также злокачественные новообразования других локализаций: рак эндометрия (риск возникновения от 50 до 71% при среднем возрасте первичной диагностики 48–62 лет), почечных лоханок, мочевого пузыря, мочеточника, яичников (риск 4–12 % при среднем возрасте первичной диагностики 42,5 лет), желудка (риск развития 6–13 % при среднем возрасте первичной диагностики 56 лет), тонкой кишки, а также опухоли головного мозга, сальных желез. Выделение синдромов Линча I (наличие в семье пациента только случаев рака толстой кишки) и II (ранний возраст развития рака преимущественно в проксимальных отделах толстой кишки у пациента и данные о наличии в его семье случаев злокачественных новообразований внекишечной локализации) в настоящее время не актуально, так как вероятность возникновения опухолей различной локализации присутствует у любого пациента с СЛ [2].
Описаны различные варианты СЛ. Например, синдром Мюир-Торре, также имеющий аутосомно-доминантный тип наследования и мутации в генах MMR. Помимо неполипозного КРР, при этом заболевании отмечено возникновение аденом сальных желез, эпителиом и карцином кожи, множественных кератоакантом; известны случаи развития рака тела матки, рака органов мочевыделительной системы, верхних отделов желудочно-кишечного тракта. Один из двух типов синдрома Тюрко характеризуется наличием у пациента СЛ в сочетании с глиальными опухолями головного мозга (в основном глиобластомами) [4].
Неоднозначны представления о рисках развития рака молочной железы, поджелудочной железы [5] и простаты [6].
Помимо раннего возраста возникновения опухолей, другими фенотипическими особенностями злокачественных новообразований при СЛ являются локализация в правой ободочной кишке, наличие множественных синхронных и метахронных опухолей, низкая степень дифференцировки (перстневидноклеточные и слизистые гистологические типы рака), выраженная лимфоцитарная перитуморальная воспалительная инфильтрация, напоминающая гистологические признаки так называемой «реакции Крона», наличие микросателлитной нестабильности [4].
Повреждения в системе репарации ДНК выключают онкосупрессорную активность этой системы. В подавляющем большинстве случаев аберрации при СЛ затрагивают ген MLH1 (mutL homolog 1), расположенный на третьей хромосоме на участке 3p21, ген MSH2 (mutS homolog 2) — вторая хромосома, участок 2p16 — у 71 % и 84 % пациентов с СЛ соответственно. Эти два гена считаются мажорными для СЛ. Также повреждаются и другие гены, которые называют минорными. К ним относят ген MSH6 (mutS homolog 6: вторая хромосома, участок 2p16), ген PMS2 (postmeiotic segregation increased 2, расположенный на седьмой хромосоме в регионе 7p22), ген MLH3 (mutL homolog 3, на второй хромосоме в регионе 2p16) и ген MSH3 (mutS homolog 3, на пятой хромосоме на участке 5q11) [7].
Белки, кодируемые этими генами, обеспечивают «работу над ошибками» во время скольжения по молекуле ДНК. Если в период репликация ДНК возникало нарушение последовательности нуклеотидов (небольшие инсерции или делеции), ее обнаруживает гетеродимерный комплекс белков MSH2 и MSH6. После этого на место происшествия прибывает другой гетеродимер, состоящий из белков MLH1 и PMS2. И уже этот «квартет» призывает экзонуклеазы, совместно с которыми безжалостно удаляет ошибочные последовательности оснований и исправляет поврежденный участок за счет ресинтеза.
Помимо мутаций в перечисленных генах, на ход MMR может повлиять структура гена EPCAM, кодирующего молекулу клеточной адгезии на мембране клетки. Он является «соседом» гена MSH2, располагаясь перед ним на хромосоме. Выпадение (делеция) нуклеотидов на 3’ конце EPCAM приведет к гиперметилированию промотора гена MSH2, что обеспечит эпигенетический механизм его инактивации [8].
Для каждого гена описаны «излюбленные» локализации опухолей. При наличии патогенных вариантов нуклеотидной последовательности в гене MSH2 отмечают более высокую частоту возникновения экстраколонических злокачественных опухолей (у 48–61 % пациентов обнаруживается рак тела матки, желудка, яичников или почек), чем при поломках в гене MLH1 (всего около 11–42 % опухолей внекишечной локализации).
Что касается минорных генов, мутации гена MSH6 ассоциируются с более легким течением заболевания, а при аберрациях гена PMS2 отмечено развитие множественных колоректальных аденом и глиобластом. При мутациях в гене MLH3 также наблюдается возникновение опухолей головного мозга. Двуаллельные мутации в гене MSH3 вызывают полипозные формы, сходные с фенотипом семейного аденоматозного полипоза [9].
Снижение функции системы MMR определяет высокую частоту мутаций (увеличение или уменьшение количества мономеров) в коротких (от 1 до 6 нуклеотидов) повторяющихся последовательностях ДНК — микросателлитах. Это состояние описывается как микросателлитная нестабильность (МСН) и обнаруживается приблизительно в 95 % случаев всех ассоциированных с ЛС злокачественных новообразований. Высокий уровень микросателлитной нестабильности ассоциирован с более благоприятным прогнозом, но при нем отмечена низкая эффективность применения 5-фторурацила. В спорадических (ненаследственных) случаях КРР также может наблюдаться МСН, сочетающаяся с соматической мутацией в онкогене BRAF, приводящей к замене глутамата на валин в кодоне 600 (BRAF V600E) [10].
Кроме МСН, описано еще одно нарушение, ассоциированное с состоянием «нестабильности». Это так называемые «повышенные микросателлитные изменения в отдельных тетрануклеотидных повторах» (еlevated microsatellite alterations at selected tetranucleotide repeats, EMAST). Одной из известных причин EMAST является снижение экспрессии или дисфункция MSH3, активность которого в комплексе с MSH2 необходима для устранения несоответствия тетрануклеотидных повторов. Обнаружение EMAST при КРР ассоциировано с ухудшением прогноза: снижение безрецидивной выживаемости пациентов, высокая вероятность возникновения отдаленных метастазов. В опухолевой ткани с этим феноменом при гистологическом исследовании обнаружены выраженные признаки воспаления с высокой плотностью CD8+ T-клеток в воспалительном инфильтрате.
Дефектный MSH3 также ассоциирован с нарушением гомологичной репарации, что может обеспечить чувствительность таких опухолей к использованию препаратов, усугубляющих репаративные возможности опухолевых клеток, что приводит к их гибели. К таким препаратам относятся, например, ингибиторы поли-АДФ-рибоза-полимеразы 1 (PARP1) (олапариб) [11].
Выявление характерных мутаций позволяет не только установить диагноз СЛ и обеспечить эффективную стратегию раннего наблюдения пациентов, но и определить пути таргетной терапии с учетом конкретного поврежденного гена, патологического варианта его нуклеотидной последовательности и изменений, вызванных нарушением его функции.