Склерозирующий холангит что это такое
Склерозирующий холангит: причины,симптомы и лечение
При склерозирующем холангите происходит воспаление желчных протоков, что приводит к перерождению ткани в соединительную и постепенному сужению, и зарастанию протоков. За этим следует застой желчи, перерастяжению стенок пузыря и протоков, прекращению подачи желчи в двенадцатиперстную кишку. Процесс может затронуть даже поджелудочную железу. Заболевание очень редкое. Возникает чаще у людей, чей возраст достигает 40 лет. Больше половины заболевших мужчины.
Причины возникновения заболевания
Точные причины возникновения склерозирующего холангита неизвестны или плохо изучены. Но отмечают связь с колитами, целиакией и другими аутоиммунными недугами. Например, при наличии воспаления кишечника заболевание наблюдается у 80% пациентов, при язвенном колите у 5%, при болезни Крона у 1%. Только небольшая часть холангитов выступает самостоятельным заболеванием. У людей с заболеваниями кишечника и холангитом есть риск возникновения колоректального рака.
Есть так же связь с наследственной предрасположенностью. У таких людей начало болезни могут запустить какие-либо инфекционные процессы. Данное заболевание постоянно изучается. Может в скором времени можно будет с точностью назвать причину возникновения и найти адекватное лечение.
Симптомы склерозирующего холангита развиваются постепенно. Среди них можно выделить:
Если имеются заболевания желчного пузыря, то склерозирующий холангит развивается быстро и тяжело. На последней стадии может развиться цирроз печени, скопление жидкости в брюшной полости, повышенное давление, печеночная недостаточность. В некоторых случаях развивается злокачественное образование. У многих людей данное заболевание долгое время никак себя не проявляет. Симптомы могут появиться только тогда, когда уже развивается цирроз печени.
Диагностика
Для начала нужно сдать анализы крови на биохимию. По ним можно проследить отклонения в работе печени (повышение билирубина, АсАт, АлАт). Далее нужно пройти ультразвуковую диагностику печени, желчного пузыря, МРТ. Иногда требуется биопсия, чтобы поставить окончательный диагноз.
Лечение
Вылечить склерозирующий холангит невозможно, поскольку это аутоиммунное заболевание и точные причины его развития неизвестны. Главной целью является замедление разрушающего процесса, облегчение симптоматики, достижение ремиссии.
При бессимптомном течении болезни пациентам нужно 2 раза в год проходить осмотр у врача, сдавать печеночные пробы, анализ на онкомаркеры. В первую очередь больным склерозирующим холангитом назначается строжайшая диета, которая не будет давать тяжелой нагрузки на печень и желчный пузырь. Нужно полностью отказаться от любых спиртных напитков, ограничить потребление лекарственных средств. Выписывают препараты, которые помогают справиться с застоем желчи. Требуются лекарства или мази, которые помогут убрать зуд кожи, антибактериальные препараты, если требуется.
Для поддержания работы печени назначаются гепатопротекторы. Остановить или замедлить развитие склеротического процесса на поздней стадии невозможно. Требуется проведение операции по расширению желчных протоков, но помогает она не всегда. Бывают случаи, что болезнь начинает прогрессировать более активно, и протоки снова зарастают. В очень тяжелых случаях требуется пересадка печени, что само по себе очень опасно, но это единственное, что поможет полностью излечиться. Операция назначается при асците, кровотечении из пищевода, печеночной недостаточности.
По статистике, после постановки диагноза продолжительность жизни составляет от 5 до 15 лет. Точных причин возникновения заболевания нет, поэтому и мер профилактики не существует. Главное – стараться вести здоровый образ жизни, вовремя лечить все заболевания ЖКТ, не злоупотреблять вредными привычками.
Склерозирующий холангит
Склерозирующий холангит – редкое хроническое заболевание желчных протоков, вызывающее нарушение оттока желчи, ее застой и повреждение клеток печени с дальнейшим развитием печеночной недостаточности. Патология длительно протекает без клинических проявлений. Основные симптомы: боль в области живота, желтуха, зуд, слабость, похудение. Диагностические мероприятия заключаются в проведении анализа крови и кала, УЗИ органов брюшной полости, МРПХГ, ЭРПХГ, биопсии печени. Лечение направлено на купирование симптомов, замедление патологического процесса и восстановление функций. Наибольший эффект дает трансплантация печени.
Общие сведения
Склерозирующий холангит – это воспалительное заболевание внутрипеченочных и внепеченочных желчных протоков, характеризующееся их склерозированием (рубцеванием) и нарушением оттока желчи. Сопровождается формированием цирроза печени, портальной гипертензии и печеночной недостаточности. Склерозирующий холангит встречается с частотой 1-4:100 000, хотя достаточно трудно судить о распространенности патологии, поскольку она длительно протекает бессимптомно. Кроме того, в большинстве случаев (до 80%) заболеванию сопутствует хроническая патология желудочно-кишечного тракта (язвенный колит, болезнь Крона и т. п.), признаки которой выступают на первый план. Именно это приводит к прогрессированию патологического процесса, нарастанию неблагоприятных симптомов и осложнений. Согласно статистике, заболеваемости склерозирующим холангитом подвержены мужчины в возрасте от 25 до 40 лет и женщины более старшего возраста. Не исключается возникновение болезни у детей, хотя в педиатрии ее регистрируют крайне редко.
Причины склерозирующего холангита
Выделяют первичный и вторичный склерозирующий холангиты. Причины возникновения первичного склерозирующего холангита до сих пор неизвестны. Ученые постоянно выдвигают различные гипотезы, но ни одна из них еще не подтверждена на 100%. Важную роль в развитии патологии играет наследственная предрасположенность в сочетании с нарушением работы иммунитета. Эта теория основана на статистических данных, которые зарегистрировали семейные случаи склерозирующего холангита и аутоиммунных заболеваний. Также выдвигается теория о негативном влиянии токсинов, бактерий и вирусов на желчные протоки.
Заболевание может развиться у любого человека, но есть ряд предрасполагающих факторов, повышающих риск появления патологии: возраст (чаще всего болеют люди старше 30 лет), пол (от заболевания в большей степени страдают мужчины), наличие болезни у родственников.
Вторичный склерозирующий холангит хорошо изучен, причинами его формирования могут быть токсическое повреждение протоков, тромбоз и нарушение работы печеночной артерии, постоперационные осложнения, камни в желчных путях, аномалии развития, цитомегаловирус и криптоспоридиоз при СПИДе, некоторые лекарственные препараты, холангиокарцинома.
Независимо от причин возникновения, патология вызывает нарушение работы желчных протоков и печеночную недостаточность. Воспаление желчных протоков приводит к тому, что они замещаются рубцовой тканью и спадаются, это ведет к нарушению оттока желчи, ее застою и обратному всасыванию в кровяное русло. Таким образом появляется желтуха. Застой желчи и повышение давления в желчных путях из-за нарушения ее оттока провоцируют необратимые изменения в печеночных клетках и их гибель, что проявляется печеночной недостаточностью.
Симптомы склерозирующего холангита
Длительное время склерозирующий холангит протекает бессимптомно, на ранних этапах заболевание можно заподозрить по нарушениям биохимического анализа крови (определяется изменение активности ферментов). При развитии дисфункции печени и рубцевания желчных путей появляются следующие признаки: боль в области живота, зуд, пожелтение слизистых оболочек, кожи и склеры глаз, повышение температуры тела, слабость и утомляемость, похудение.
Диагностика
Для подтверждения диагноза склерозирующего холангита гастроэнтеролог проводит сбор анамнеза и жалоб, внешний осмотр и дополнительные методы исследования: анализ крови, кала, ЭРПХГ, МРПХГ, УЗИ органов брюшной полости, биопсию печени.
Анализ крови позволяет выявить повышенную активность печеночных ферментов (АСТ, АЛТ). Во время анализа испражнений определяется изменение характеристик кала: он может быть светлым, дегтеобразным (из-за кровотечений), липким и жирным.
Лечение склерозирующего холангита
Лечение склерозирующего холангита направлено на замедление прогрессирования патологии, устранение неблагоприятных симптомов и осложнений. Ликвидировать клинические признаки можно путем назначения диеты (ограничение жиров, увеличение концентрации витаминов и кальция); при развитии гиповитаминозов показано внутривенное введение витаминных препаратов. Снизить кожный зуд можно при помощи урсодезоксихолевой кислоты и антигистаминных средств (хлоропирамин, цетиризин и др.).
При развитии бактериального холангита назначаются антибактериальные препараты (ампициллин, клиндамицин, цефотаксим и т. п.). Облегчить состояние пациентов могут желчесвязывающие средства (холестирамин).
Очень часто прибегают к хирургическим манипуляциям, которые помогают замедлить прогрессирование склерозирующего холангита и улучшить состояние пациентов. При обнаружении стриктур желчных протоков проводят баллонную дилатацию с целью расширения желчных путей; если это невозможно, то показано протезирование протоков или иссечение пораженных участков. Камни в желчных путях удаляют при эндоскопических операциях. Но эффективность этих манипуляций оценивается неоднозначно, так как они могут лишь замедлить прогрессирование болезни, а также нередко вызывают осложнения. Максимально возможные результаты дает трансплантация печени (особенно при циррозе и печеночной недостаточности). В 15-20% после пересадки печени возможно повторное развитие склерозирующего холангита.
Прогноз и профилактика
Специфической профилактики патологии нет. Но можно снизить риск ее появления, если своевременно лечить заболевания желчных путей, желчнокаменную болезнь, воспалительные процессы поджелудочной железы, а также проходить периодические медицинские осмотры в отделении терапии или гастроэнтерологии.
Первичный склерозирующий холангит
Первичный склерозирующий холангит (ПСХ) – это хроническое холестатическое заболевание печени, характеризующееся воспалением и фиброзом внутри- и внепеченочных желчных протоков, в исходе которого развивается билиарный цирроз.
Какие осложнения могут наблюдаться при первичном склерозирующем холангите?
• Хронический холестаз. Хронический холестаз приводит к возникновению стеатореи, дефициту жирорастворимых витаминов (A, D, E и K), остеопорозу и потере массы тела.
• Вторичный билиарный цирроз печени. В результате хронического холестаза при первичном склерозирующем холангите может развиться вторичный билиарный цирроз печени, что приводит к портальной гипертензии, которая проявляется асцитом и кровотечениями из варикозно-расширенных вен.
• Холелитиаз (камни в желчном пузыре и желчных протоках). Холелитиаз часто встречается у пациентов с первичным склерозирующим холангитом.
• Холангиокарцинома (злокачественная опухоль желчных протоков). Развитие холангиокарциномы отмечают у 6-30% пациентов с первичным склерозирующим холангитом (по данным аутопсии у 30-40% пациентов). Развитие холангиокарциномы непредсказуемо в каждом конкретном случае.
• Стриктуры (сужения) желчных путей. Образование стриктур желчных путей определяется в 20% случаев заболевания и требует дифференциальной диагностики с холангиокарциномой. Стриктуры приводят к усилению холестаза с возникновением желтухи и кожного зуда.
• Рак толстой кишки. Риск развития рака толстой кишки при одновременном наличии первичного склерозирующего холангита и язвенного колита выше, чем при наличии одного лишь язвенного колита.
Внепеченочные проявления первичного склерозирующего холангита
Описаны методы лечения первичного склерозирующего холангита (ПСХ). Исследованы распространенность и спектр внепеченочных проявлений ПСХ, наиболее часты из них – хронические воспалительные заболевания кишечника. Установлено, что ПСХ у детей сопровождается
Первичный склерозирующий холангит (ПСХ) — это хроническое прогрессирующее холестатическое заболевание печени неясной этиологии, характеризующееся негнойным деструктивным воспалением, облитерирующим склерозом и сегментарной дилятацией внутри- и внепеченочных желчных протоков, приводящее к развитию вторичного билиарного цирроза, портальной гипертензии и печеночной недостаточности [1]. Распространенность ПСХ в разных странах отличается. Так, в Северной Европе она составляет 10 на 100 тысяч населения, а в Азии ПСХ встречается в 10–100 раз реже. Болезнь развивается чаще у мужчин (женщины болеют в 1,5–2 раза реже) [2]. Чаще всего заболевание начинается в возрасте 30–40 лет, хотя известны случаи развития ПСХ в детском и пожилом возрасте [3].
В патогенезе ПСХ важная роль принадлежит нарушению иммунной толерантности. Доказательством этого являются обнаружение широкого спектра аутоантител в сыворотке крови таких больных: обнаружены антитела к ДНК, к гладкой мускулатуре, к билиарному эпителию, к тиреопероксидазе, антимитохондриальные антитела и некоторые другие (описано более 25 видов аутоантител у больных ПСХ), а также частое сочетание ПСХ с другими аутоиммунными заболеваниями, которые могут быть рассмотрены как системные проявления ПСХ [4]. Хронические воспалительные заболевания кишечника обнаруживают у 80–90% больных ПСХ, чаще это язвенный колит, реже встречается болезнь Крона с поражением толстой кишки [2, 3]. Реже ПСХ сочетается с аутоиммунным гепатитом, аутоиммунным тиреоидитом, сахарным диабетом 1-го типа, псориазом (до 10% случаев). Описаны отдельные наблюдения развития ревматоидного артрита, системной склеродермии, системной красной волчанки, склерита, увеита у больных ПСХ [5]. Частое сочетание ПСХ и воспалительных заболеваний кишечника легло в основу предположения о триггерной роли бактериальных антигенов в возникновении ПСХ, однако доказать это не удалось [2]. У родственников больных ПСХ в 11,5 раз повышен риск развития ПСХ, в 3 раза — язвенного колита и в 1,4 раза — болезни Крона [6]. Было сделано предположение о ключевой роли некоторых генов в развитии ПСХ. Были проведены исследования генов HLA-A, HLA-B, HLA-DR, MST1R, NOD2, ATG16L1, однако какого-либо одного гена, специфичного для ПСХ, не было найдено [2].
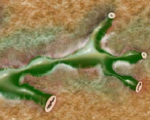
ПСХ можно заподозрить при наличии у больного синдрома холестаза, не объяснимого другими причинами. Чаще всего больных беспокоит выраженный кожный зуд, желтуха, лихорадка (чаще субфебрильная, при присоединении бактериального холангита — фебрильная), боли в правом подреберье, тошнота, общая слабость, быстрая утомляемость. Нередко (примерно у трети больных) жалобы отсутствуют, и холестаз выявляется случайно при лабораторном исследовании по другому поводу [3]. При лабораторном исследовании выявляют повышение активности гамма-глутамилтранспептидазы и щелочной фосфатазы, гипербилирубинемию (при развитии бактериального холангита уровень билирубина может резко возрастать), гиперлипидемию, повышение скорости оседания эритроцитов, иногда эозинофилию [7]. Диагноз подтверждают при магнитно-резонансной холангиографии или эндоскопической ретроградной холангиопанкреатографии («золотой стандарт»). При этих исследованиях выявляются участки сужения желчных протоков с неравномерными контурами, чередующиеся с нормальными или расширенными участками; мелкие внутрипеченочные протоки видны не все или не видны совсем (симптом «обгорелого дерева») [2]. При биопсии печени можно выявить особую форму ПСХ — мелкопротоковую (поражаются только мелкие внутрипеченочные протоки), а также иногда удается получить участки пораженных крупных протоков [3]. Морфологически ПСХ характеризуется негнойным деструктивным холангитом с облитерацией просветов желчных протоков и склерозом их стенок, выраженным перидуктальным фиброзом (феномен «луковичной шелухи»). Чаще всего (в 75% случаев) поражаются и крупные, и мелкие протоки, хотя встречаются случаи поражения только крупных или только мелких желчных протоков [2].
Препаратом выбора при консервативном лечении ПСХ является урсодезоксихолевая кислота в дозе 20–30 мг/кг/сут (Урсофальк, Урсосан, Урдокса). Урсодезоксихолевая кислота обладает гепатопротективным действием — она образует нетоксичные мицеллы с токсичными желчными кислотами (хенозедоксихолевой, литохолевой), а также включается в состав мембран гепатоцитов и холангиоцитов, увеличивая их стабильность. Это уменьшает степень повреждения клеток печени токсичными желчными кислотами. Урсодезоксихолевая кислота обладает свойствами иммуномодулятора, угнетая экспрессию HLA-антигенов на мембранах гепатоцитов и холангиоцитов. Кроме того, препарат уменьшает литогенность желчи за счет уменьшения абсорбции холестерина в кишечнике, а также стимулирует холерез, что увеличивает выведение желчных кислот через кишечник [2, 3]. При неэффективности монотерапии урсодезоксихолевой кислотой к терапии добавляют фибраты, которые способствуют уменьшению холестаза [2].
Получены данные о том, что лактулоза (Дюфалак, Нормазе) в дозе 15–45 мл/сут обладает гепатопротективным действием, которое может реализовываться посредством нескольких механизмов: 1) ингибирование продукции аммиака и других ксенобиотиков; 2) утилизация образовавшегося аммиака; 3) нарушение всасывания и быстрое выведение аммиака с калом [7, 8]. Уменьшение образования аммиака в кишечнике под действием лактулозы связано с уменьшением количества кишечной микрофлоры, продуцирующей уреазу. Утилизация аммиака происходит при помощи бактерий, использующих азотсодержащие соединения в качестве субстрата для синтеза собственных белков; лактулоза способствует увеличению количества этих микроорганизмов в кишечнике. Кроме того, лактулоза способна связывать молекулы аммиака и увеличивать скорость транзита содержимого по кишечнику, что способствует быстрому выведению аммиака из организма. Лактулоза обладает свойствами пребиотика: под ее воздействием в кишечнике увеличивается количество бифидобактерий и уменьшается количество патогенных бактерий, что предотвращает избыточный бактериальный рост и снижает риск проникновения антигенов патогенных бактерий из кишечника в кровь [14]. Недавно в России было проведено исследование, согласно результатам которого при лечении больных с холестазом урсодезоксихолевой кислотой в комбинации с лактулозой (Урсолив) наблюдается большее уменьшение выраженности холестаза, чем при лечении только урсодезоксихолевой кислотой [9].
Таким образом, совместное применение урсодезоксихолевой кислоты и лактулозы приводит к синергизму гепатопротективного эффекта обоих веществ.
При сочетании ПСХ с аутоиммунным гепатитом к лечению добавляют глюкокортикостероиды и/или иммуносупрессанты в дозах, стандартных для лечения аутоиммунного гепатита [9]. С целью устранения зуда в качестве препарата первой линии применяют Холестирамин (4 г/сут), однако не все пациенты хорошо его переносят: наиболее частыми причинами отказа от препарата являются его вкус, вздутие живота, запоры или диарея. При непереносимости Холестирамина применяют Рифампицин (300 мг/сут), Сертралин (75–100 мг/сут), Налтрексон (50 мг/сут). При выраженном зуде может потребоваться альбуминовый диализ или плазмаферез. Нестерпимый зуд, не купирующийся консервативными методами, может являться самостоятельным показанием к трансплантации печени. Длительный холестаз является фактором риска развития остеопороза, поэтому таким пациентам в схему лечения необходимо включать кальций (1500 мг/сут) и витамин D (1000 МЕ/сут). Витамин K назначается при наличии геморрагического синдрома, особенно перед инвазивными диагностическими процедурами [3, 10].
К хирургическим методам лечения ПСХ относятся установка стентов, резекция пораженных участков желчных протоков, трансплантация печени. Стентирование, баллонная дилятация и резекция пораженных участков протоков лишь временно уменьшают выраженность холестаза, не останавливая прогрессирование ПСХ. Наиболее эффективным хирургическим методом лечения ПСХ является трансплантация печени, которая улучшает выживаемость больных. Однако у 15–20% больных развивается рецидив ПСХ в трансплантате, что ухудшает прогноз таких пациентов [2, 3, 10].
При естественном течении ПСХ часто развивается холангиокарцинома (до 40% больных), повышен риск развития рака поджелудочной железы и колоректального рака, поэтому необходимы как можно более ранние диагностика и лечение этого заболевания [11, 12].
Цель исследования. Изучение распространенности и спектра внепеченочных проявлений первичного склерозирующего холангита.
Материалы и методы. Объектом исследования были 23 больных первичным склерозирующим холангитом, наблюдавшихся в Клинике нефрологии, внутренних и профессиональных заболеваний им. Е. М. Тареева Первого МГМУ им. И. М. Сеченова в период с 1984 по 2010 гг. В группе было 12 мужчин и 11 женщин, средний возраст данной группы составил 36,4 ± 13,7 года, средний возраст начала заболевания 30,6 ± 15 лет, средняя продолжительность заболевания 5,8 ± 5,2 года.
Материалами исследования служили данные из архивных записей в историях болезни и амбулаторных картах. Критерием включения в исследование являлся подтвержденный диагноз ПСХ (морфологически, посредством магнитно-резонансной холангиографии или ретроградной эндоскопической холангиопанкреатографии). Критерием исключения являлось наличие у больного сочетания ПСХ и аутоиммунного гепатита, так как аутоиммунный гепатит также характеризуется широким спектром системных проявлений. Изучалось наличие следующих системных проявлений ПСХ: хронические воспалительные заболевания кишечника (язвенный колит и болезнь Крона), поражение глаз (склерит, кератит), аутоиммунный тиреоидит, синдром Шегрена, геморрагический васкулит.
Результаты и обсуждение. У 16 больных (69,6%) были выявлены внепеченочные проявления ПСХ. Из данных, представленных в табл. 1, видно, что в обследованной группе были выявлены хронические воспалительные заболевания кишечника (язвенный колит и болезнь Крона), синдром Шегрена, геморрагический васкулит, поражение глаз (склерит, кератит), поражение щитовидной железы (аутоиммунный тиреоидит).
У пациентов с сочетанием ПСХ и болезни Крона (5 больных) в 1 случае была поражена только толстая кишка; в 2 случаях — и тонкая, и толстая кишка; в 2 случаях — только тонкая кишка. Отсутствие поражения толстой кишки у двух больных с болезнью Крона при ПСХ указывает на необходимость длительного динамического наблюдения за этими пациентами, так как в дальнейшем у них возможно присоединение поражения толстой кишки.
У 4 больных (17,4%) отмечено сочетание нескольких системных проявлений ПСХ. У 3 больных выявлено два внепеченочных проявления ПСХ (2 случая — язвенный колит в сочетании с аутоиммунным тиреоидитом, 1 случай — язвенный колит в сочетании с геморрагическим васкулитом). У 1 пациента выявлено три внепеченочных проявления ПСХ — язвенный колит в сочетании с геморрагическим васкулитом и поражением глаз (склерит, кератит).
В связи с повышенным риском развития онкологических заболеваний у больных ПСХ мы изучили распространенность злокачественных заболеваний в изучаемой группе больных. Онкологические заболевания были выявлены у 3 больных (13%): 1 случай (пациент с ПСХ в сочетании с болезнью Крона) — лимфома с поражением тонкой кишки, выявлена одновременно с подтверждением диагноза ПСХ; 1 случай (больная с ПСХ без системных проявлений) — лимфома с поражением печени, лимфатических узлов ворот печени, забрюшинных лимфатических узлов, выявлена одновременно с подтверждением диагноза ПСХ; 1 случай (пациентка с ПСХ в сочетании с язвенным колитом) — аденокарцинома толстой кишки, выявлена через 13 лет после подтверждения диагноза ПСХ. В связи с частым развитием злокачественных опухолей у больных ПСХ необходима постоянная онкологическая настороженность врачей, работающих с этой категорией больных.
Также мы проанализировали распространенность системных проявлений ПСХ в зависимости от пола больных и возраста первых проявлений ПСХ (табл. 2 и 3).
Как видно из табл. 2, хронические воспалительные заболевания кишечника, поражение глаз и синдром Шегрена встречались чаще у мужчин, а поражение щитовидной железы было зарегистрировано только у женщин. Возможно, меньшая подверженность женщин хроническим воспалительным заболеваниям кишечника связана с большей концентрацией эстрогенов в их крови, чем у мужчин. В эксперименте на мышах (Harnish D. C. et al., 2004) был доказан положительный эффект эстрогенов при лечении хронических воспалительных заболеваний кишечника, однако необходимо дальнейшее исследование этого вопроса [13]. Более частое развитие аутоиммунного тиреоидита у женщин, наиболее вероятно, связано с более низким содержанием тестостерона в их крови, чем у мужчин. В исследовании, проведенном на мышах, Ansar A. S. et al. (1986) доказали положительный эффект тестостерона при лечении аутоиммунного тиреоидита [14].
С целью изучения связи частоты обнаружения системных проявлений ПСХ и возраста начала заболевания мы разделили больных ПСХ на две подгруппы — тех, у кого заболевание началось в детском возрасте (6 человек, возраст начала заболевания от 10 до 17 лет), и тех, у кого первые проявления ПСХ возникли во взрослом состоянии (17 человек, возраст начала заболевания от 20 до 66 лет) (табл. 3).
Из табл. 3 следует, что в группе больных, у которых ПСХ начался в детском возрасте, внепеченочные проявления регистрировались чаще, чем в группе пациентов, заболевших во взрослом состоянии. Причина такого различия распространенности системных проявлений ПСХ в различных возрастных группах в настоящее время неясна, необходимы дальнейшие исследования этого вопроса, в том числе обследование больших групп больных ПСХ.
Выводы
Литература
Е. А. Александрова*
Э. З. Бурневич*, кандидат медицинских наук, доцент
Е. А. Арион**
* ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития РФ,
**Клиника нефрологии, внутренних и профессиональных болезней им. Е. М. Тареева, Москва
.gif)
_550.gif)
.gif)