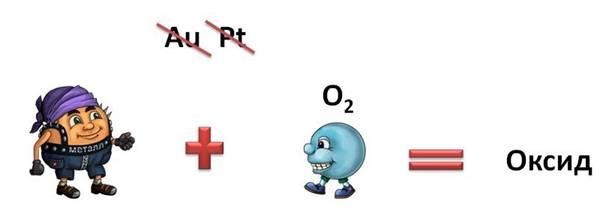Сопоставляя свойства таких химических элементов как медь кальций водород и золото можно утверждать
Помощь в дистанционном обучении
Решение тестов, помощь в закрытии сессии студентам МОИ, Синергии, ГТЕП, Витте, Педкампус, Росдистант
Химия тест МОИ с ответами
Тест Московского Открытого Института «Химия» 1 семестр. Цена 200р.
Сопоставляя свойства таких химических элементов, как медь, кальций, водород и золото, можно утверждать, что наименьшей восстановительной активностью обладает …
Способность самопроизвольно создавать свойственную только данному соединению пространственную структуру характерна для …
Соединение Н2SO3 – это …
В состав молекул дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК) входят остатки …
Качественная реакция на обнаружение глюкозы – …
реакцией «серебряного зеркала»
Перманганат калия K2Cr2O7 диссоциирует следующим образом: …
Функциональная группа альдегидов называется …
Направление смещения химического равновесия определяется …
принципом Ле Шателье
Соли высших карбоновых кислот – это …
Электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода, – это …
К моносахаридам относятся …
глюкоза, фруктоза рибоза
Количество вещества 1 моль содержит …
Углеводороды, в молекулах которых имеются бензольные кольца, – это …
Химическое равновесие – это состояние системы, при котором …
скорость прямой реакции равна скорости обратной
Атомная единица массы составляет …
1⁄12 массы свободного покоящегося атома углерода
Полимером глюкозы является …
Гомологической разностью называют группу …
Неверно, что к числу кислородсодержащих органических соединений относятся …
Высокомолекулярные природные полимеры, молекулы которых состоят из остатков аминокислот, соединенных пептидной связью, – это …
Распад электролитов на ионы при растворении их в воде – это …
Количество вещества молекулярного азота N2, если его объем равен 5,6 л (н.у.), составляет …
Состав нуклеотидов дезоксирибонуклеиновой кислоты (ДНК): …
аденин, гуанин, цитозин и тимин
При увеличении величины электроотрицательности элемента … свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные – усиливаются
Ученые, первыми сформулировавшие закон сохранения массы применительно для химических реакций, – …
Общая формула гомологического ряда предельных альдегидов и кетонов: …
Степень окисления фосфора в соединении K2HPO4 равна …
Кальций: способы получения и химические свойства
Кальций Ca — это щелочноземельный металл, серебристо-белый, пластичный, достаточно твердый. Реакционноспособный. Сильный восстановитель.
Относительная молекулярная масса Mr = 40,078; относительная плотность для твердого и жидкого состояния d = 1,54; tпл = 842º C; tкип = 1495º C.
Способ получения
1. В результате электролиза жидкого хлорида кальция образуются кальций и хлор :
2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С образуя кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
3. В результате разложения гидрида кальция при температуре выше 1000º С образуется кальций и водород:
4. Оксид кальция взаимодействует с алюминием при 1200º С и образует кальций и алюминат кальция:
4CaO + 2Al = 3Ca + Ca(AlO2)2
Качественная реакция
Кальций окрашивает пламя газовой горелки в коричнево-красный цвет.
Химические свойства
1.1. Кальций взаимодействует с азотом при 200 — 450º С образуя нитрид кальция:
1.2. Кальций сгорает в кислороде (воздухе) при выше 300º С с образованием оксида кальция:
2Ca + O2 = 2CaO
1.4. С водородом кальций реагирует при температуре 500 — 700º C с образованием гидрида кальция:
1.5. В результате взаимодействия кальция и фтора при комнатной температуре образуется фторид кальция:
1.6. Кальций взаимодействует с серой при 150º С и образует сульфид кальция:
Ca + S = CaS
1.7. В результате реакции между кальцием и фосфором при 350 — 450º С образуется фосфид кальция:
1.8. Кальций взаимодействует с углеродом (графитом) при 550º С и образует карбид кальция:
Ca + 2C = CaC2
2. Кальций активно взаимодействует со сложными веществами:
2.2. Кальций взаимодействует с кислотами:
2.2.1. Кальций реагирует с разбавленной соляной кислотой, при этом образуются хлорид кальция и водород :
Ca + 2HCl = CaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой кальций образует нитрат кальция, оксид азота (I) и воду:
если азотную кислоту еще больше разбавить, то образуются нитрат кальция, нитрат аммония и вода:
2.3. Кальций вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид кальция и гидрид кальция:
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид кальция и водород:
Тест по химии
Список вопросов теста
Вопрос 1
Положение металлов в Периодической таблице Д.М. Менделеева
Варианты ответов
в нижнем левом углу таблицы
в верхнем правом углу таблицы
в побочных подгруппах
в главных подгруппах
элементы семейства лантаноиды и актиноиды
Вопрос 2
Как меняются металические свойства в ряду химических элементов, образующих простые вещества?
Вопрос 3
Расположите элементы в порядке ослабления металических свойств.
Вопрос 4
Выберите верные утверждения. Для атомов металлов характерно:
(в ответе слово процесс не пишем, только название процесса)
Вопрос 6
Какая связь характерна для металлов?
Варианты ответов
ковалентная полярная
ионная
металлическая
ковалентная неполярная
Вопрос 7
Металлы обладают эектропроводностью. Лучшими проводниками электрического тока являются
Варианты ответов
железо
медь
магний
никель
марганец
олово
Вопрос 9
Вычислите объем водорода (н.у.), который образуется при растворении 119 г бронзы, содержащей 20% олова, в соляной кислоте.
Вопрос 10
Какие металлы энергично окисляются кислородом только при нагревании?
Варианты ответов
железо, цинк, медь
кальций, алюминий, цинк
литий, железо, свинец
барий, кальций, цинк
Вопрос 11
Какие из перечисленных металлов при взаимодействии с водой образуют растворимые основания и водород?
Варианты ответов
натрий
железо
кальций
калий
цинк
медь
Вопрос 12
Выберите правильный ответ. Какие из перечисленных реакций не могут протекать?
Варианты ответов
медь + серная кислота
оксид меди (2) + сернистая кислота
медь + сера
сероводородная кислота + гидроксид меди (2)
медь + сульфид натрия
медь + сульфид серебра
Вопрос 14
Установите соответствие. Состав сплавов
Варианты ответов
сплав меди с добавлением до 20% олова
сплав железа с углеродом и добавки: хром, никель, вольфрам, молибден и др.
сплав меди с добавлением цинка от 10 до 50% цинка
сплав железа, содержащий от 2 до 4,5% углерода, а также марганец, кремний, фосфор и серу
сплав алюминия, магния, марганца,меди и никеля
Вопрос 15
Конечным продуктом химической коррозии железа является.
Варианты ответов
оксид железа (2)
гидроксид железа (3)
гидроксид железа (2)
оксид железа (3)
железная окалина
Химические свойства металлов
Урок 8. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Химические свойства металлов»
Химические свойства металлов
Сегодня мы с вами изучим общие химические свойства металлов.
В реакциях металлы проявляют восстановительные свойства, то есть они отдают электроны и превращаются в положительные ионы, сами при этом окисляются.
Сначала разберём реакции металлов с простыми веществами – неметаллами.
Например, с кислородом взаимодействуют практически все металлы, кроме золота и платины, при этом образуются оксиды.
Щелочные и щелочноземельные металлы при обычной температуре легко окисляются на воздухе, поэтому их обычно хранят в закрытых сосудах или под слоем масла.
Многие металлы взаимодействуют с кислородом при нагревании: например, медь при нагревании на воздухе чернеет, так как покрывается плёнкой чёрного оксида меди два.
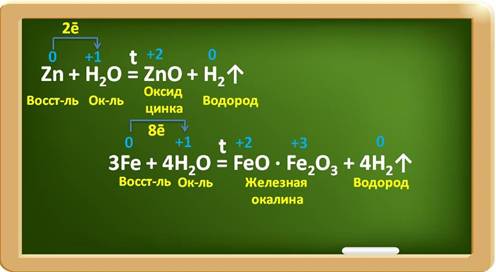
При прокаливании железа образуется железная окалина – это смешанный оксид, который состоит из оксида железа два и оксида железа три.
А вот магний при поджигании на воздухе сгорает яркой вспышкой, образуя оксид магния.
Таким образом, большинство металлов реагируют с кислородом с образованием оксидов, активные металлы вступают во взаимодействие с кислородом при обычных условиях, менее активные при нагревании, а такие, как золото или платина не реагируют с кислородом.
Металлы в этих реакциях являются восстановителями и, соответственно, повышают свою степень окисления, а кислород является окислителем и понижает свою степень окисления.
С серой все металлы, кроме золота, способны взаимодействовать при незначительном нагревании, образуя сульфиды:
Если смешать небольшое количество порошка алюминия с порошком серы и нагреть сверху смесь пламенем лучинки, то в результате бурной реакции образуется сульфид алюминия:
Таким образом, с серой при определённых условиях реагируют все металлы кроме золота, в результате этого взаимодействия образуются сульфиды, в которых степень окисления серы равна мину двум. В этих реакциях металлы выступают в роли восстановителей, а сера – в роли окислителя.
C фтором, хлором, бромом и йодом – металлы реагируют с образованием галогенидов.
Так, в реакции алюминия с йодом образуется йодид алюминия, а катализатором в этой реакции является вода.
Таким образом, в реакциях с галогенами, металлы являются восстановителями и повышают свою степень окисления, а сами галогены являются окислителями и понижают свою степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В результате этих реакций образуются галогениды.
Металлы не только реагируют с неметаллами – простыми веществами, но и вступают в реакции со сложными веществами.
Например, с водой эффективно реагируют щелочные и щелочноземельные металлы. Если натрий поместить в ёмкость с водой, в которую добавили несколько капель фенолфталеина, то он будет двигаться по поверхности воды, бурно реагируя с ней. При этом выделяется водород и образуется гидроксид натрия, окрашивающий фенолфталеин в малиновый цвет.
Металлический натрий выступает в качестве восстановителя, он повышает свою степень окисления с 0 до +1, а ионы водорода выступают в качестве окислителя и водород понижает свою степень окисления с +1 до 0. В этой реакции два атома натрия отдают по одному электрону ионам водорода.
Некоторые металлы взаимодействуют с водой при определённых условиях, например, цинк – при нагревании, железо – в раскалённом виде с парами воды. При этом образуются оксиды металлов и выделяется водород.
Так, в реакции с цинком образуется оксид цинка и водород. Цинк при этом, являясь восстановителем, повышает свою степень окисления с 0 до +2 и отдаёт по два электрона ионам водорода. Катионы водорода выступают в роли окислителя и понижают свою степень окисления с +1 до 0. В реакции с железом, аналогично, железо является восстановителем, повышает свою степень окисления с 0 до +2 и +3, при этом три атома железа отдают по восемь электронов ионам водорода, а ионы водорода понижают свою степень окисления с +1 до 0 и являются окислителями.
Если металл стоит в ряду активности после водорода, то он не вытесняет водород из воды ни при каких условиях.
Таким образом, щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей, при этом выделяется водород, некоторые металлы реагируют с водой только при нагревании, при этом образуются оксиды и выделяется водород, а металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли окислителя.
Металлы реагируют и с кислотами. Активность металлов при взаимодействии с растворами кислот зависит от положения металла в ряду активности. Металлы, стоящие в ряду активности до водорода, способны вытеснять водород из разбавленных растворов кислот.
Следует учитывать и следующее металл реагирует с кислотой:
· металл должен стоять в ряду активности до водорода
· если образуется растворимая соль
· концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами, при этом водород не выделяется
· на щелочные металлы это правило не распространяется, так как они реагируют активно с водой, а речь в данном случае идёт о растворах кислот
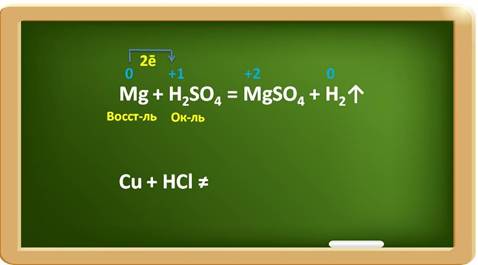
Например, в реакции магния с раствором серной кислоты, магний выступает в роли восстановителя, а ионы водорода в качестве окислителя.
При этом магний повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Каждый атом магния отдаёт по два электрона ионам водорода.
Металлы, стоящие в ряду активности после водорода, к такому взаимодействию не способны:
Например, медь стоит в ряду активности после водорода, поэтому она не реагирует с раствором соляной кислоты.
Если налить в две пробирки растворы кислот: в первую – раствор соляной кислоты, во вторую – раствор серной кислоты, а затем поместить в каждую по грануле цинка, то в результате у нас появляются пузырьки газа и в первой, и во второй пробирке. Значит, цинк стоит в ряду активности металлов до водорода, поэтому он способен вытеснять водород из раствора кислот.
Цинк в обеих реакциях является восстановителем, он повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0, при этом выступая в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам водорода.
Следует помнить, что металлы, стоящие в ряду активности до водорода, реагируют с растворами кислот, но в результате этих реакций должна образоваться растворимая соль, на щелочные металлы эти правила не распространяются, концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами.
Металлы реагируют с растворами солей, при этом нужно также использовать ряд активности металлов: более активный металл способен вытеснять другой металл из раствора соли, однако при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти протекают в растворе.
Если в две пробирки налить раствора сульфата меди (II) и поместить в первую кусочек железа, а во вторую гранулу цинка, то реакция будет у нас идти в двух пробирках. На кусочке железа и грануле цинка оседает медь и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на жёлтую, во второй – с голубой на более светлую.
В этой реакции железо выступает в роли восстановителя, само при этом окисляясь. Атомы железа превращаются в ионы железа. Ионы меди выступают в роли окислителя, они восстанавливаются, превращаясь в атомы меди. В результате окислительно-восстановительной реакции электроны от атомов железа переходят к ионам меди.
Во второй реакции, в роли восстановителя выступает цинк, сам он окисляется, атомы цинка превращаются в ионы цинка, ионы меди выступают в роли окислителя, ионы меди восстанавливаются и превращаются в атомы меди, электроны от атомов цинка переходят к ионам меди.
Следовательно, металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений металлов, при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, так как они реагируют с водой.
· металлы реагируют с простыми веществами, такими, как:
Химические свойства элементов:кальций

НАХОЖДЕНИЕ КАЛЬЦИЯ В ПРИРОДЕ
Кальций — один из наиболее распространенных элементов. Содержание его в земной коре составляет 3,25%. Благодаря высокой активности кальций встречается в природе исключительно в виде соединений. Наиболее распространенными из них являются известняк и мел. Известняк состоит в основном из минерала кальцита СаСО3, содержащего примеси Mg, Fe, Мп и др. Мел содержит 99 % чистого кальцита. Реже встречается кристаллическая форма карбоната кальция — мрамор. Кальций входит в состав многих осадочных и метаморфических пород доломитов, песчаников, сланцев и др., водных алюмосиликатов (цеолитов) и рудных минералов. Минералы кальция находят широкое практическое применение в качестве сырья для химической и металлургической промышленности, особенно в промышленности строительных материалов. Соединения кальция используются при производстве целлюлозы, очистке сахарного сиропа, изготовлении керамики и стекла. Металлический кальций применяют в качестве раскислителя при выплавке железа, меди и других металлов. Входит он и в состав некоторых подшипниковых сплавов.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА КАЛЬЦИЯ
Кальций — серебристо-белый металл. Хорошо прессуется, пластичен, может быть прокатан в листы, поддается обработке резанием.Кальций может существовать в двух аллотропных модификациях: α- и β-формах. Кальций — один из самых электроотрицательных элементов. Его электродный потенциал равен —2,84 В. Кальций легко взаимодействует с кислородом воздуха и водой, поэтому его хранят под слоем масла. При нагревании на воздухе кальций легко сгорает с образованием оксида кальция. Перекиси СаО2 и СаО4 являются сильными окислителями. Кальций взаимодействует с холодной водой довольно энергично. Однако со временем реакция замедляется вследствие образования пленки гидроксида кальция. Разбавленные кислоты растворяют кальций с выделением водорода. При повышенных температурах кальций очень энергично взаимодействует с галогенами. С серой кальций образует сульфид состава CaS. При нагревании кальций взаимодействует с водородом и азотом с образованием нитридов и гидридов. Фосфид кальция образуется при нагревании кальция с фосфором без доступа воздуха. При нагревании кальция с графитом получается карбид СаС2. Известны также силициды кальция CaSi, CaSi2.
СОЕДИНЕНИЯ КАЛЬЦИЯ
Оксид и гидроксид кальция. Оксид кальция — бесцветные кристаллы с кубической решеткой, плотность 3,4, т. пл. 2585° С. Оксид кальция образуется при прокаливании карбоната кальция, реагирует с водой с выделением большого количества тепла и образованием гидроксида кальция.
Гидроксид кальция — бесцветные кристаллы с гексагональной решеткой, плотность 2,24. При нагревании гидроксид кальция отщепляет воду, превращаясь в оксид кальция. Будучи сильным основанием, гидроксид кальция поглощает углекислый газ из воздуха.
Сульфат кальция — бесцветные кристаллы, существующие в виде нескольких модификаций. Природный минерал — ангидрит (нерастворимый ангидрит) Растворимый ангидрит, получаемый при обезвоживании гипса, известен в двух формах, кристаллизующихся в гексагональной сингонии и отличающихся лишь величиной кристаллов. α-Форма (крупнокристаллическая) получается при медленном обезвоживании. При быстром обезвоживании получается мелкокристаллическая β-форма. Превращение растворимого ангидрита в нерастворимый происходит выше 400° С. Нерастворимый ангидрит не гигроскопичен и нерастворим в воде. Растворимый ангидрит хорошо поглощает влагу и растворяется в воде. Сульфат кальция образует кристаллогидраты: CaSО4∙2 Н2О и 2CaSО4∙H2О Ниже 60° С стабилен кристаллогидрат CaSО4∙2Н2О, выше 60° С — 2CaSО4∙H2О. В питьевой воде сульфат кальция содержится в растворенном состоянии, что обусловливает постоянную жесткость воды. Однако растворимость его в воде невелика — 0,202 г/100 г Н2О при 18 С. Присутствие прочих сульфатов понижает растворимость CaSО4, наличие же других солей и кислот, не исключая и серную, значительно повышает растворимость сульфата кальция. С серной кислотой образуются растворимые продукты присоединения CaSО4∙ H2SО4 и CaSО4∙3 H2SО4, которые могут существовать в свободном состояний. С сульфатами щелочных металлов сульфат кальция образует труднорастворимые двойные соли — Na2SО4-CaSО4 (глауберит) и K2SО4-CaSО4-H2О (сингенит), встречающиеся в природе.
Галогениды кальция.
Фторид кальция имеет показатель преломления 1,43385, твердость по Моосу равна 4. Практически не растворим в воде и разбавленных кислотах. Концентрированной серной кислотой разлагается с выделением HF. Фторид кальция встречается в природе в виде плавикового шпата. Может быть получен при действии солей фтора на растворы солей кальция.
Хлорид кальция очень гигроскопичен, энергично поглощает водяные пары, образуя сначала твердые гидраты, затем расплываясь в жидкость. Для хлорида кальция характерен ряд кристаллогидратов.При охлаждении концентрированных растворов выпадает СаС12∙6Н2О. При 30,1° С последний плавится в кристаллизационной воде и переходит в СаС12∙4 Н2О, затем в СаС12∙2Н2О (при 45,1 0 С), и, наконец, в СаС12∙Н2О (при 175,5 °С). Хлорид кальция обезвоживается полностью выше 250° С.При обезвоживании хлорид кальция частично гидролизуется с образованием оксида кальция и хлористого водорода. Безводный хлорид кальция растворяется в воде со значительным выделением тепла, гексагидрат — с поглощением тепла. Хлорид кальция растворим в низших спиртах и жидком аммиаке, образуя с ними сольваты, а также в ацетоне.
Бромид кальция легко растворим в воде (595 г/100 г Н2О при 0° С) и спирте. Кристаллизуется из воды в виде СаВг2∙6Н2О, плавящегося при 38,2° С. Известны также гидраты с 5; 4; 3; 2; 1,5 и 1 молекулами воды. Бромид кальция растворим в жидком аммиаке и этиловом спирте с образованием сольватов.
Иодид кальция растворяется в воде лучше, чем бромид (757 г/100 г Н2Опри 0°С). Кристаллизуется из воды в виде кристаллогидрата состава CaI2∙6H2О. Известны кристаллогидраты с 7,4 и 3 молекулами воды. Иодид кальция очень гигроскопичен.
Нитрат кальция при комнатной температуре выделяется из водных растворов Ca(NО3)2∙4H2О в виде бесцветных кристаллов с температурой плавления 42,7° С. Выше 51,6° С кристаллизуется безводная соль. Плавится безводная соль при 561°С; при 500° С начинается ее разложение с выделением кислорода и образованием нитрита кальция. Последний распадается на оксид кальция и диоксид азота. Кристаллогидраты и безводная соль нитрата кальция гигроскопичны, поэтому нитрат кальция хранят без доступа влаги.
Фосфаты кальция. Из кальциевых солей фосфорных кислот наибольшее практическое значение имеют соли ортофосфорной кислоты — трикальцийфосфат, дикальцийфосфат и монокальцийфосфат.
Трикальцийфосфат Са3(РО4)2 — бесцветные гексагональные кристаллы, т. пл. 1670° G, плотность 3,14. Почти не растворим в воде (0,0025%) при 20° С. Взаимодействует с кислотами, даже слабыми, с образованием кислых солей, обычно хорошо растворимых.
Дикальцийфосфат СаНРО4 — бесцветные триклинные кристаллы, плотность 2,89. Кристаллизуется из водных растворов при температуре выше 36° С. Ниже 36°С кристаллизуется дигидрат СаНРО4∙2Н2О, в виде моноклинных кристаллов с плотностью 2,31.
Монокальцийфосфат Са(Н2РО4)2 — бесцветные гигроскопические кристаллы. Может быть получен взаимодействием фосфорной кислоты с известью или действием фосфорной кислоты на апатит или фосфориты. В зависимости от условий осаждения может быть получена как безводная соль, так и моногидрат Са(Н2РО4)2∙Н2О — кристаллы триклинной сингонии; плотность 2,22. Прокаливанием моногидрата при 900° С получается пирофосфат кальция Са2Р2О7.
Карбонат кальция встречается в двух кристаллических формах: кальцит и арагонит. Кальцит образует бесцветные кристаллы с гексагональной решеткой, плотность 2,711. Арагонит — бесцветные кристаллы ромбической сингонии, плотность 2,93. Кальцит широко распространен в природе, арагонит встречается реже.
При нагревании карбонат кальция разлагается без плавления на оксид кальция и углекислый газ Растворимость его в воде незначительна: кальцита 14 мг/л, арагонита 15 мг/л (18° С). В присутствии углекислого газа растворимость карбоната кальция резко увеличивается вследствие образования растворимого в воде бикарбоната кальция. Карбонат кальция легко растворяется в кислотах с выделением углекислого газа. В органических растворителях карбонат кальция нерастворим.
Оксалат кальция-соль щавелевой кислоты, используется для гравиметрического определения и отделения кальция.
Ключевые слова: кальций, кальций формула, кальций что это, кальций элемент, кальций реакции, кальций соединения, кальций получения, кальций свойства.