Спай белок коронавируса что это такое
Спайк-белок коронавируса сам по себе вызвал нарушения свертываемости крови
Lize M. Grobbelaar et al. / medRxiv, 2021
Биологи провели микроскопические исследования образцов крови здоровых людей с добавленным спайковым белком коронавируса и без него, а также пациентов, больных ковидом. Исследователи заметили, что добавление в кровь свободного S-белка вызывало формирование амилоидных сгустков и изменения формы клеток крови. Кроме того, ученые смоделировали ток плазмы в сосудах и экспериментально показали, что у пациентов с ковидом он может быть сильно затруднен. Препринт статьи опубликован на портале medRxiv.
Вызываемую SARS-Cov-2 инфекцию можно охарактеризовать беспрецедентными для других респираторных инфекций патологиями. Среди них – нарушения свертываемости крови (коагулопатии), которые могут приводить либо к кровотечениям, либо тромбозам. Связывание спайкового S-белка с рецепторами в момент проникновения вируса в клетку может вызывать клеточные патологии, но само по себе не может объяснить такую распространенность коагулопатии у пациентов. Однако S-белок путешествует в организме и сам по себе отдельно от вируса, высвобождаясь из инфицированных клеток: его, например, находили в мочеиспускательном канале. Частицы этого белка также могут проникать сквозь гематоэнцефалический барьер.
Ученые из Университета Стелленбоша под руководством Итерезии Преториус (Etheresia Pretorius) изучили способность частиц S-белка взаимодействовать напрямую с тромбоцитами и белком фибриногеном, вызывая в нем изменения и, как следствие, нарушения свертываемости крови. Сначала исследователи при помощи флуоресцентной микроскопии проверили, накапливаются ли аномальные амилоидные комплексы в плазме здоровых людей с добавлением частиц S-белка и без них. В образцы с добавлением одного нанограмма на миллилитр S-белка добавляли тромбин (активатор коагуляции) и делали микрофотографии. В тех образцах, куда попал вирусный белок, формировались более плотные фибриновые сгустки. В образцах цельной крови спайковый белок вируса вызывал гиперактивацию тромбоцитов.
Плазма здоровых людей без добавления спайк-белка (А) и с ним (В). После добавления тромбина в образцах с S-белком формируются более плотные сгустки.
Новый вариант коронавируса: что такое спайковый белок и почему в нем важны мутации?
Появление нового варианта коронавируса вызвало новый интерес к части вируса, известной как белок спайков. Новый вариант несет в себе несколько необычных изменений в белке шипа по сравнению с другими близкородственными вариантами — и это одна из причин, почему он вызывает большее беспокойство, чем другие, безвредные изменения вируса. мы наблюдали ранее. Новые мутации могут изменить биохимию спайка и повлиять на степень передачи вируса.
Спайковый белок также является основой современных вакцин против COVID-19, которые стремятся вызвать иммунный ответ против него. Но что такое протеин-шип и почему он так важен?
Захватчики клеток
Наши клетки эволюционировали, чтобы отражать такие вторжения. Одной из основных защит клеточной жизни от захватчиков является ее внешнее покрытие, которое состоит из жирового слоя, содержащего все ферменты, белки и ДНК, составляющие клетку. Из-за биохимической природы жиров внешняя поверхность имеет отрицательный заряд и обладает отталкивающими свойствами. Вирусы должны преодолеть этот барьер, чтобы получить доступ к клетке.
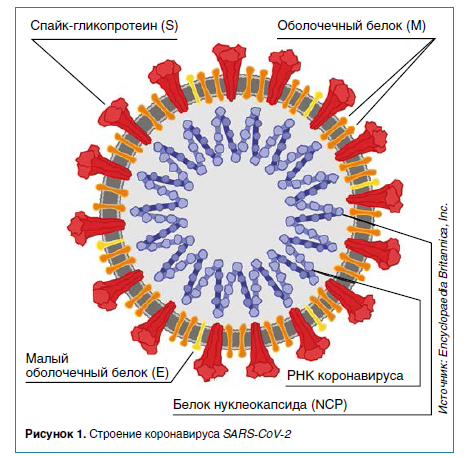
Как и клеточная жизнь, коронавирусы окружены жировой оболочкой, известной как оболочка. Чтобы проникнуть внутрь клетки, вирусы в оболочке используют белки (или гликопротеины, поскольку они часто покрыты скользкими молекулами сахара), чтобы соединить свою собственную мембрану с мембраной клетки и захватить клетку.
Спайковый белок коронавирусов — один из таких вирусных гликопротеинов. У вирусов Эбола один, у вируса гриппа — два, а у вируса простого герпеса — пять.
Архитектура шипа
Белок-шип состоит из линейной цепи из 1273 аминокислот, аккуратно свернутой в структуру, которая усеяна до 23 молекулами сахара. Белки-шипы любят слипаться, и три отдельные молекулы-шипы связываются друг с другом, образуя функциональную «тримерную» единицу.
Белок-спайк SARS-CoV-2 застревает на примерно сферической вирусной частице, внедряется в оболочку и выступает в космос, готовый цепляться за ничего не подозревающие клетки. По оценкам, на один вирус приходится примерно 26 тримеров шипов.
Одна из этих функциональных единиц связывается с белком на поверхности наших клеток, называемым ACE2, запуская захват вирусной частицы и, в конечном итоге, слияние мембран. Спайк также участвует в других процессах, таких как сборка, структурная стабильность и уклонение от иммунитета.
Вакцина против шипового белка
Учитывая, насколько важен для вируса спайковый белок, многие противовирусные вакцины или лекарства нацелены на вирусные гликопротеины.
От SARS-CoV-2 вакцины, производимые Pfizer / BioNTech и Moderna, дают нашей иммунной системе инструкции по созданию нашей собственной версии белка-шипа, что происходит вскоре после иммунизации. Производство спайка внутри наших клеток запускает процесс выработки защитных антител и Т-клеток.
Одна из наиболее тревожных особенностей спайкового белка SARS-CoV-2 — это то, как он перемещается или изменяется с течением времени в процессе эволюции вируса. Закодированный в вирусном геноме белок может мутировать и изменять свои биохимические свойства по мере развития вируса.
Большинство мутаций не принесут пользы и либо остановят работу спайкового белка, либо не повлияют на его функцию. Но некоторые могут вызвать изменения, которые дадут новой версии вируса избирательное преимущество, сделав его более передаваемым или заразным.
Один из способов, которым это могло произойти, — это мутация части белка-шипа, которая предотвращает связывание с ним защитных антител. Другой способ — сделать шипы более «липкими» для наших клеток.
Вот почему новые мутации, которые меняют функции спайков, вызывают особую озабоченность — они могут повлиять на то, как мы контролируем распространение SARS-CoV-2. Новые варианты, обнаруженные в Великобритании и других странах, имеют мутации в спайке и в частях белка, участвующих в проникновении внутрь ваших клеток.
В лаборатории необходимо будет провести эксперименты, чтобы выяснить, значительно ли — и как — эти мутации меняют спайк, и остаются ли эффективными наши текущие меры контроля.
О важности белков для восстановления после коронавируса
Рассказывает ведущий эксперт Центра молекулярной диагностики CMD ЦНИИ эпидемиологии Роспотребнадзора Маргарита Провоторова
На белки (протеины) приходится до 50 % от сухой массы клетки. Они же главная составная часть всех клеточных и межклеточных структур нашего организма. Мышцы, внутренние органы, гормоны, ферменты, антитела – это все белки по своей структуре.
Именно эти сложные органические вещества обеспечивают все основные процессы жизнедеятельности организма. Одни распадаются, на их месте появляются новые. Такие процессы происходят внутри нас каждую секунду. И чтобы здоровье не подводило, нужно вовремя подкармливать организм, поддерживать необходимый уровень белка.
Протеины состоят из 20 аминокислот. И 8 из них мы не может синтезировать самостоятельно. Поэтому полноценный набор белков растительного и животного происхождения, идеально дополняющих друг друга, организм может получить только из продуктов питания. Одна из основ нашего здоровья – это сбалансированное разнообразное питание.
Давайте подробно разберем, что же важного делают белки?
· Связывают и доставляют различные вещества из или внутрь клеток, являются главным транспортным средством для метаболитов по кровеносной системе нашего организма. Например, белок гемоглобин, транспортирует железо.
· Обеспечивают формирование полноценного иммунного ответа; как уже говорилось, все антитела по своей химической природе являются белками.
· Белки, входящие в состав свертывающей системы крови, участвуют в остановке кровотечения.
· Регулируют и поддерживают постоянство внутренней среды организма, участвуют в гормональной регуляции. Ведь гормоны это тоже белки.
· Белки актин и миозин помогают нашим мышцам сокращаться, а нам – свободно двигаться.
· Дают организму энергию, необходимую для нормальной жизни. 1 грамм белка в среднем обеспечивает нам 4 ккал.
И, конечно, невозможно приуменьшить значение белка в период восстановления после любого перенесенного заболевания, в том числе и COVID-19. Впрочем, в реабилитации после коронавируса есть свои детали.
Многие отмечают, что после выздоровления длительное время сохраняется сильная усталость – астения, которая сопровождается снижением аппетита. А на фоне нарушения работы органов чувств, запах и вкус белковых продуктов животного происхождения может казаться крайне неприятным, что может вообще отбить аппетит. Для полноценного же восстановления после заболевания рекомендуется употреблять до 1 грамма белка на 1 кг веса в сутки.
Что делать в этом случае? Постараться найти другие продукты, богатые белком, которые не вызывают отторжения. Удачной заменой могут стать бобовые, рыба, морепродукты, творог, молочные продукты, яйца, соя, киноа, орехи.
Есть и другая крайность, которая может негативно отразиться на нашем организме. Некоторые пациенты стараются как можно быстрее восстановить белковые запасы и употребляют белок в количествах, превышающих норму в несколько раз. Реабилитацию это не ускорит, а, например, при патологии почек, может ухудшить течение заболевания.
Как же составить правильный рацион, и на что еще обратить внимание при реабилитации?
Если вам кажется, что вы или кто-то из близких мало ест мяса, это не повод подозревать белковую недостаточность. Для этого состояния характерно не только снижение массы тела, но и снижение мышечной массы. И развивается оно не за одну-две недели. Определить, насколько пострадали мышцы самостоятельно сложно. Это можно сделать только с помощью специальных исследований.
Ориентируйтесь на свои вкусы. Красное мясо – не единственный источник белка. Не стоит заставлять себя есть его через силу, особенно если вкус или запах после болезни неприятен. Экспериментируйте с продуктами: курица, индейка, телятина, кролик, рыба и морепродукты обладают менее выраженными вкусовыми свойствами и легче усваиваются. Если отдадите предпочтение жирным сортам рыбы, то вместе с белком обеспечите себя еще и кислотами Омега-3.
2-3 порции молочных продуктов в день – достойная альтернатива мясу в период реабилитации. Творог, йогурт без сахара, сыр, кефир снабдят организм легкоусвояемым белком и кальцием, который просто необходим для костной ткани.
Если вы придерживаетесь веганского рациона, используйте по максимуму все богатое разнообразие бобовых продуктов. Нут, фасоль всех цветов, чечевица, горох, соя и соевый сыр тофу – рекордсмены по содержанию растительного белка.
Не забывайте об арахисе и орехах. Они богаты не только белком, но и содержат полезные ненасыщенные жиры, незаменимые для нормальной жизнедеятельности.
Когда используете в пищу растительное молоко, обращайте внимание на состав. Напиток без добавленных сахаров, обогащенный кальцием и витамином В12 – наилучший вариант. Для вегетарианцев это особенно актуально – в их рационе питания часто наблюдается дефицит последнего.
Говоря о полезных белковых продуктах, мы имеем в виду природные. Протеины в переработанных мясных изделиях, таких как сосиски, бекон, колбаса, ветчина, не имеют ценности для организма. Их из рациона нужно, по возможности, исключить.
Консультируйтесь с врачом и контролируйте основные лабораторные показатели. Самые распространенные дефициты, которые наблюдаются у пациентов после COVID-19 – недостаток железа, витамина В12, D, йода. Дефицит белка, к счастью, наблюдется несколько реже.
Если Вы не нашли необходимую информацию, попробуйте
зайти на наш старый сайт
Разработка и продвижение сайта – FMF
Почтовый адрес:
Адрес: 350000, г. Краснодар, ул. Рашпилевская, д. 100
Канцелярия +7 (861) 255-11-54
прием посетителей пн., вт., ср., чт. с 10.00 до 16.00
ПТ. и предпраздничные дни с 10.00 до 13.00
перерыв с 13.00 до 13.48
Антитела к RBD домену S1 белка вируса SARS- CoV-2, IgG
Наиболее частыми клиническими симптомами данной инфекции являются: повышение температуры тела, кашель, одышка, утомляемость, ощущение тяжести в грудной клетке.
В ответ на заражение организм вырабатывает антитела различных классов. Именно их обнаружение позволяет установить факт инфицирования даже у бессимптомных пациентов.
Первыми вырабатываются IgM-антитела, по их наличию можно судить о том, что человек недавно был инфицирован вирусом. По наличию антител класса G можно говорить, что уже две-три недели прошло с того момента, как человек был инфицирован коронавирусом.
Тест-система для определения антител к RBD домену S белка среди всех антител класса G выявляет только те, которые непосредственно нейтрализуют вирус и, соответственно, препятствуют связыванию вируса с клетками человека.
Это позволяет судить о наличии защитного иммунитета, который мог сформироваться как после перенесенного заболевания, так и после вакцинации, а также для оценки напряженности поствакцинального иммунитета.
Точность таких анализов близка к 100%. Поэтому, если наличие анти-RBD антител будет выявлено, то в течение, по крайней мере, ближайших нескольких месяцев вы защищены, и ковид вам не грозит.
Данное исследование так же подходит для оценки поствакцинального иммунного ответа, полученного иммунизацией вакцинным препаратом на основе RBD-домена Spike.
В первую очередь анализ на определение нейтрализующих антител G (АНТИ RBD) показан лицам, переболевшим новой коронавирусной инфекцией, а также после вакцинации препаратом «Спутник V» (Центр Гамалеи) или другими вакцинами, разрешенными к применению на территории РФ.
По данным последних исследований, у пациентов с положительными антителами G нельзя полностью исключить вероятность выделения вируса в окружающую среду. То есть, они в данном случае имеют инфекционный статус.
Антитела могут сохранятся и определятся в сыворотке в течении 5-7 месяцев после начала заболевания. Их уровень зависит от многих факторов (вес, пол, влияние вредных факторов и тд.)
Для проведения данного исследования специальной подготовки не требуется. Рекомендуется взятие крови не ранее, чем через 4 часа после последнего приема пищи.
Отрицательный результат – отсутствие антител IgG к вирусу / не исключена текущая стадия инфекции.
Положительный результат – подтверждает факт встречи с вирусом SARS-CoV-2 и выработку к нему специфических иммуноглобулинов. Наличие IgG свидетельствует о перенесенном заболевании (при отрицательном результате ПЦР).
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021






