Азитромицин или кларитромицин в чем отличие
Почему азитромицин остается препаратом выбора при внебольничных инфекциях нижних дыхательных путей
Инфекционно-воспалительные заболевания дыхательных путей занимают первое место в структуре инфекционной патологии. Пневмония является наиболее частой инфекционной причиной смерти в мире.
Инфекционно-воспалительные заболевания дыхательных путей занимают первое место в структуре инфекционной патологии. Пневмония является наиболее частой инфекционной причиной смерти в мире. В России ежегодно около 1,5 млн человек переносят пневмонию. В связи с этим остается актуальной проблема рационального выбора антибактериального средства для лечения инфекций нижних дыхательных путей. Выбор препарата для антибактериальной терапии должен основываться на его спектре действия, охватывающем выделенный или предполагаемый возбудитель, чувствительный к данному антибиотику, фармакокинетических свойствах антибактериального средства, обеспечивающих его проникновение в терапевтической концентрации в соответствующие ткани, клетки и жидкости организма, данных о безопасности антибиотика (побочных эффектах, противопоказаниях и возможном нежелательном взаимодействии с другими лекарствами), характеристиках лекарственной формы, способе введения и режиме дозирования, обеспечивающих высокий комплаенс терапии, фармакоэкономических аспектах лечения [4, 6, 8].
Инфекции нижних дыхательных путей и принципы выбора антибиотика
При неспецифических внебольничных инфекциях выбор антибактериального препарата в большинстве случаев основывается на статистических данных о наиболее частых их возбудителях, а также сведениях о подтвержденной в контролируемых клинических исследованиях эффективности тех или иных антибиотиков при инфекциях известной этиологии. Вынужденно эмпирический подход к лечению связан с отсутствием возможности микробиологического исследования в амбулаторных лечебных учреждениях, длительностью бактериологической идентификации возбудителя и определения его чувствительности к антибиотикам (3–5 дней, а в случае «атипичных» патогенов и больше), невозможностью в ряде случаев получить биологический материал для посева или бактериоскопии (например, около 30% больных пневмониями имеют непродуктивный кашель, что не позволяет исследовать мокроту), трудностями в разграничении истинных возбудителей и сапрофитов (обычно микроорганизмов ротоглотки, попадающих в исследуемый материал). Сложности выбора лекарственного средства в амбулаторных условиях определяются также отсутствием полноценного наблюдения за течением заболевания и, следовательно, своевременной коррекции лечения при его неэффективности. Антибиотики по-разному проникают в различные ткани и биологические жидкости. Лишь некоторые из них хорошо проникают в клетку (макролиды, тетрациклины, фторхинолоны, в меньшей степени — клиндамицин и сульфаниламиды). Поэтому, даже если препарат in vitro проявляет высокую активность в отношении данного возбудителя, но не достигает в месте его локализации уровня, превышающего минимальную подавляющую концентрацию (МПК) для данного микроорганизма, клинического эффекта он не окажет, хотя микробная резистентность к нему будет вырабатываться. Не менее важным аспектом антибактериальной терапии является ее безопасность, особенно для амбулаторного больного, лишенного повседневного медицинского наблюдения. В амбулаторных условиях следует отдавать предпочтение пероральному приему антибиотиков. В педиатрической практике имеют значение органолептические свойства препарата. Для повышения исполняемости пациентом врачебных назначений режим дозирования антибиотика должен быть максимально простым, т. е. предпочтительнее препараты с минимальной кратностью приема и коротким курсом лечения.
Возбудители неспецифических внебольничных инфекций нижних дыхательных путей
Острые респираторные вирусные инфекции (ОРВИ), протекающие с синдромом бронхита, в ряде случаев, чаще в детском возрасте, могут осложняться присоединением бактериальной флоры с развитием острого бронхита. Возбудителями острого бактериального бронхита в детском возрасте являются пневмококк, микоплазма или хламидия, реже гемофильная палочка, моракселла или стафилококк. Острый бактериальный бронхиолит у детей вызывают моракселла, микоплазма и возбудитель коклюша. Острый гнойный трахеобронхит у взрослых в 50% случаев вызывает гемофильная палочка, в остальных случаях пневмококк, реже моракселла (5–8% случаев) или внутриклеточные микроорганизмы (5% случаев).
Среди бактериальных возбудителей обострений хронического бронхита главную роль играют Haеmophilus influenzae (30–70% случаев), Streptococcus pneumoniae и Moraxella catarrhalis. Для курильщиков наиболее характерна ассоциация H. influenzae и M. catarrhalis. В отягощенных клинических ситуациях (возраст старше 65 лет, многолетнее течение болезни — более 10 лет, частые обострения — более 4 раз в год, сопутствующие заболевания, выраженные нарушения бронхиальной проходимости — объем форсированного выдоха за первую секунду (ОФВ1)
С. В. Лукьянов, доктор медицинских наук, профессор ФГУ «Консультативно-методический центр лицензирования» Росздравнадзора, Москва
Антихеликобактерные средства (ч. 2)
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты.
Преферанская Нина Германовна
Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Амоксициллин (табл./капс. 250 мг, 500 мг) — полусинтетический антибиотик пенициллинового ряда широкого спектра действия, с умеренной активностью в отношении H. pylori. Биодоступность составляет 70–80%, растворимая лекарственная форма — 90%. В тканях достигается терапевтическая концентрация. Амоксициллин характеризуется широким спектром антимикробного действия, низким уровнем резистентности, хорошей всасываемостью в желудочно–кишечном тракте, высокой биодоступностью и кислотостойкостью. Блокада амоксициллином пенициллиносвязывающих белков приводит к остановке роста и гибели микробной клетки.
Период полувыведения — 1–1,5 ч. Выводится на 50–70% почками в неизмененном виде путем канальцевой секреции (80%) и клубочковой фильтрации (20%), печенью — 10–20%. В небольшом количестве выделяется с грудным молоком.
Противопоказаниями служит повышенная чувствительность к амоксициллину, детский возраст до 3 лет.
Важно! Вызывает аллергические реакции, тошноту, нарушения со стороны крови и лимфатической системы очень редко, диарею, очень редко кристаллурию.
Кларитромицин (табл. 250 мг, 500 мг; капс. 250 мг) — относится к группе полусинтетических макролидов, оказывает дозозависимый бактериостатический эффект за счет блокирования белковых систем микробной клетки, взаимодействует с 50S рибосомальной субъединицей, подавляет синтез белка бактерий. Однако при достижении концентрации, которая в 2–3 раза превышает минимальную ингибирующую концентрацию, оказывает бактерицидное действие. Бактерицидное действие оказывает в отношении H. pylori, данная активность Кларитромицина выше при нейтральном pH, чем при кислом. Кларитромицин по эффективности в отношению к H. pylori превышает все другие активные субстанции этой группы. Обладает широким спектром действия и является одним из наиболее эффективных и распространенных макролидов. При приеме внутрь хорошо всасывается, концентрация его в тканях намного превышает сывороточную. Максимальное накопление также наблюдается в слизистой ЖКТ.
Препарат хорошо проникает внутрь клеток (моноцитов, макрофагов, фагоцитов), создавая высокие внутриклеточные концентрации. Высокие концентрации в очаге воспаления делают его средством выбора при H. pylori — ассоциированной патологии желудка и 12-перстной кишки. Благодаря лиофильности способен проникать в клетки и накапливаться в высоких концентрациях в слизистой оболочке желудка и двенадцатиперстной кишки, что имеет большое значение при эрадикации H. pylori.
Также нельзя не вспомнить позитивный эффект санации, присущий Кларитромицину. Широкий спектр активности данного антибиотика по отношению к грампозитивным и грамнегативным бактериям позволяет элиминировать патогенные и условно–патогенные возбудители из полости ЖКТ, колонизация которых наблюдается в условиях хеликобактер–ассоциированных заболеваний. Препарат обладает собственной противовоспалительной активностью, что обусловлено угнетением продукции провоспалительных цитокинов и стимуляцией синтеза противовоспалительных гуморальных факторов. Однако самым главным его качеством является способность разрушать матрикс биопленки. 99% микроорганизмов, к которым относится и H. pylori, существуют не в виде отдельных микроорганизмов, а в составе сложно организованных сообществ — биопленок, которые представляют собой совокупность бактериальных клеток, которые окружены внеклеточным матриксом, который имеет полисахаридную природу. Матрикс выполняет защитную функцию и часто является причиной устойчивости микроорганизмов к действию антибиотиков, резистентность бактерий в составе биопленки возрастает в 10–1000 раз.
Важно! При применении препарата могут возникать диарея, гиперчувствительность, аллергические реакции, часто сыпь, очень редко может вызвать анафилактоидную реакцию, дерматит, нарушение слуха, звон в ушах (частота неизвестна), а также снижение числа лейкоцитов и тромбоцитов.
Метронидазол (ТН «Трихопол», «Флагил», табл. 250 мг) — противопротозойный препарат, относится к производным 5-нитроимидазола, активен в отношении микроаэрофилов H. pylori. Механизм действия заключается в биохимическом восстановлении 5-нитрогруппы внутриклеточными транспортными протеинами анаэробных микроорганизмов и простейших. Препарат оказывает избирательный бактерицидный эффект в отношении тех микроорганизмов, ферментные системы которых способны восстанавливать нитрогруппу. Восстановленная 5-нитрогруппа взаимодействует с дезоксирибонуклеиновой кислотой (ДНК) клетки микроорганизмов. Возникает ингибирование тканевого дыхание, нарушается репликация ДНК, синтез нуклеиновых кислот и синтез белка, что ведет к гибели бактерий.
Метронидазол быстро проникает в ткани (легкие, почки, печень, кожу, желчь, спинномозговую жидкость, слюну, семенную жидкость, вагинальный секрет), в грудное молоко и проходит через плацентарный барьер. Около 30–60 % метронидазола метаболизируется путем гидроксилирования, окисления и глюкуронирования.
Препарат медленно выводится из организма, период полувыведения 8–10 час., при повторных введениях кумулирует. Проникает в ткани и жидкости организма, обеспечивая терапевтические концентрации.
Важно! Вызывает темное окрашивание мочи, металлический привкус во рту, тошноту, рвоту, диарею, могут возникать аллергические реакции: крапивница, кожная сыпь, нарушения со стороны иммунной системы: ангионевротический отек, анафилактический шок.
КОМПЛЕКСНОЕ ПРИМЕНЕНИЕ ЛС
Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной. В схемы терапии обязательно включают препараты висмута, химиотерапевтические препараты и ингибиторы протонной помпы (о последних препаратах мы писали в предыдущей статье).
Существуют стандартные схемы лечения двух-, трех- или четырехкомпонентной терапии в период лечения и обострения гастритов, язвенной болезни12-перстной кишки и желудка.
Используют:
√ БИТЕРАПИЮ: Ранитидин + Висмута цитрат (Пилорид);
Амоксициллин + Метронидазол (Хеликоцин);
√ ТРОЙНУЮ ТЕРАПИЮ:
Кларитромицин + Омепразол + Тинидазол (Пилобакт);
√ КВАДРОТЕРАПИЮ:
ЭРАДИКАЦИОННАЯ ТЕРАПИЯ H. pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы. Использование данных схем лечения значительно улучшает состояние больных и предупреждают развитие рецидивов.
Применение комбинированных лекарственных препаратов «Пилобакт», «Пилорид», «Хеликоцин» и др. значительно улучшает состояние больных и предупреждает развитие рецидивов. Как правило, терапия обязательно включает антисекреторные препараты, химиотерапевтические средства, гастропротекторы и препараты коллоидного висмута.
Интенсивную терапию проводят до достижения устойчивой ремиссии и отсутствия рецидивов у больных в течение 1,5–2 лет. При необходимости проводят профилактическую противорецидивную терапию. При применении комбинированной терапии необходимо убедиться в безопасном применении сочетанных препаратов, их переносимости и эффективности. При применении таких препаратов могут наблюдаться нежелательные побочные явления: тошнота, рвота (20%), диарея (10%), псевдомембранозный колит (1%), головокружение (2%), чувство жжения в ротовой полости, глотке, кандидоз (15%). Неэффективность лечения может быть обусловлена нарушением правил приема препаратов или развитием устойчивости бактерии к ним. Но несмотря на применение комбинированных схем лечения, у 10–20% пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя.
Повышают клиническую эффективность эрадикационной терапии комбинации ингибиторов протонной помпы (ИПП) с противомикробными препаратами.
Предполагается, что антисекреторные препараты из группы ИПП могут способствовать повышению концентрации антимикробных средств (Метронидазола и Кларитромицина) в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, а концентрация антибиотиков, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильную терапевтическую концентрацию антимикробных препаратов. При проведении эрадикационной антихеликобактерной терапии совместно с ИПП является одним из необходимых условий.
Успешность комбинированных схем терапии определяется во многом правильным выбором антибактериального средства и обеспечением постоянно высокого уровня эрадикации бактерии. Удлинение курса лечения до 10–14 дней также повышает эффективность эрадикации в среднем на 5%, а назначение высоких (двойных) доз ИПП позволяет дополнительно получить 8% показателей эффективности эрадикации H. pylori.
Именно два антибактериальных агента Амоксициллин и Кларитромицин определяют высокую эффективность в отношении микроорганизмов, которые находятся в фазе деления. Поддержка уровня рН в желудке выше чем 3,0 при помощи антисекреторных препаратов резко тормозит процесс деградации Кларитромицина (при рН 1,0 в желудочном соке Т½ составляет 1 час, а при рН 7,0 205 час.), что обеспечивает полноценную эрадикацию H. pylori. На протяжении последних 20 лет в основных схемах эрадикационной терапии сохраняется стойкая комбинация указанных антибиотиков, что связано с фармакокинетическими и фармакодинамическими особенностями данных препаратов.
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты. Продолжительность курса лечения определяется лечащим врачом. Самолечение такого опасного заболевания, как хеликобактериоз, категорически противопоказано.
Кларитромицин в педиатрии: фокус на инфекции дыхательных путей
Даже среди равных можно выбрать лучшего, но это не значит, что остальные хуже.
Козьма Прутков
Новейшая история макролидов
Были разработаны новые макролидные антибиотики следующего поколения, из которых наиболее удачными представителями оказались кларитромицин и азитромицин. Эти препараты отличаются от эритромицина значительно улучшенной фармакокинетикой, более низкой частотой побочных эффектов, большей активностью против ряда значимых возбудителей, сниженной способностью взаимодействовать с другими препаратами. Время создания современных макролидов совпало с открытием новых внутриклеточных возбудителей, поэтому уместной оказалась способность новых макролидов накапливаться внутри клетки и их активность против микоплазм, хламидий, легионелл. Наступил период «ренессанса» для этой фармакологической группы, особенно в педиатрической практике: новые макролиды стали популярны из-за хорошего профиля безопасности, удобства применения, высокой эффективности, быстрого исчезновения основных симптомов заболевания. Макролидные антибиотики стали препаратами выбора при лечении внебольничных инфекций верхних и нижних дыхательных путей, кожи и мягких тканей, отитов и многих других заболеваний и составили серьезную конкуренцию защищенным пенициллинам и цефалоспоринам [29, 32, 34, 46].
Кларитромицин обладает рядом выгодных преимуществ, выделяющих его среди других новых макролидов (диритромицина, рокситромицина, азитромицина).
Механизм действия
Характер действия макролидов обычно бактериостатический, но в высоких концентрациях они могут оказывать бактерицидное действие на стрептококки, находящихся в фазе роста [6].
Антибактериальная активность
Кларитромицин обладает in vitro и in vivo активностью против многих грамположительных и грамотрицательных бактерий, а также против микоплазм, хламидий и микобактерий [34, 41].
По своей активности против метициллиночувствительных стафилококков, стрептококков, гемофильной палочки, моракселлы и легионеллы (основных возбудителей инфекций дыхательных путей) кларитромицин превосходит другие макролиды [16].
Несмотря на то что эритромицин неэффективен в лечении инфекций, вызванных гемофильной палочкой, кларитромицин справляется с этим возбудителем, что обусловлено антибактериальной активностью основного метаболита препарата (14-гидроксикларитромицина), который в 3 раза активнее против гемофильной палочки, чем сам кларитромицин [19, 41]. Во взаимодействии препарата и его метаболита отмечается синергизм. Благодаря этому in vitro эффективность кларитромицина может быть ниже, чем реальная активность лекарства, так как не учитывается антибактериальное действие метаболита [16]. Ранее считалось, что из макролидов только азитромицин достаточно активен против гемофильной палочки, но оказалось, что благодаря своему метаболиту кларитромицин не уступает азитромицину. Эта особенность существенна, потому что гемофильная палочка входит в число трех наиболее распространенных возбудителей инфекций дыхательных путей.
Макролиды обладают высокой активностью против большинства внутриклеточных возбудителей хламидий, микоплазм, уреаплазм [33]. По воздействию на Chlamydia trachomatis кларитромицин превосходит другие препараты [34, 41].
Кларитромицин наиболее активно по сравнению с другими макролидами воздействует на Helicobacter pylory, он активнее других антибактериальных средств и непосредственно влияет на внутриклеточные формы возбудителя [17], поэтому широко используется в детской гастроэнтерологии.
В отличие от других макролидов кларитромицин высокоактивен против атипичных микобактерий (M. avium, M. leprae) и превосходит азитромицин in vitro в 4 раза [6, 41], что имеет значение при лечении оппортунистических инфекций у больных иммунодефицитами.
Практически все макролиды подавляют возбудителя токсоплазмоза. Наиболее высокой активностью обладают новые макролиды [16].
Природной устойчивостью к макролидам обладают многие грамотрицательные бактерии, так как антибиотик не проникает через клеточную стенку. Однако кларитромицин показал значительную in vitro и in vivo активность против таких грамотрицательных возбудителей инфекции дыхательных путей, как Legionella pneumophiia, Moraxella catarrhalis, Bordetella pertussis [7, 15].
Однако на грамотрицательные бактерии семейства Enterobacteriaceae, Pseudomonas и Acinetobacter макролиды не действуют. Эти бактерии часто являются возбудителями при хронических заболеваниях дыхательных путей и внутрибольничных инфекциях, вот почему в этом случае макролиды будут менее эффективны в качестве эмпирической терапии и меньше используются как препараты первого выбора [50].
Кларитромицин эффективен против риккетсий, возбудителей раневой инфекции вследствие укусов животных, активен против некоторых анаэробов, включая Bacteroidesfragilis, а также бактерий рода Campylobacter [16].
Показания
Учитывая спектр антибактериальной активности, а также хорошую переносимость кларитромицина, его можно рекомендовать как препарат первого выбора для лечения следующих инфекций у детей [29-32, 34, 52]:
Накоплен значительный мировой опыт применения кларитромицина в педиатрии и показана его высокая эффективность при лечении этих заболеваний.
Кларитромицин также эффективен при лечении одонтогенных инфекций, болезни Лайма, риккетсиях, лепры, болезни кошачьих царапин, оппортунистических инфекций, развивающихся при СПИДе и вызванных атипичными микобактериями, а также некоторых других инфекций.
Противовоспалительный эффект
Резистентность
Против бактерий, резистентных к эритромицину, кларитромицин, как и другие 14-членные макролиды и азитромицин, будет неэффективен [1, 8], потому что эти штаммы, как правило, вырабатывают фермент метилазу, которая видоизменяет саму мишень действия препаратов. Резистентность к макролидам вырабатывается быстро, но резистентные штаммы после удаления препарата из среды обитания через некоторое время утрачивают способность вырабатывать метилазы.
Следует отметить, что метициллин-резистентные штаммы стафилококков всегда устойчивы к макролидам, в том числе и к кларитромицину [6, 16]. Другие грамположительные бактерии, продуцирующие β-лактамазу, могут сохранять чувствительность к кларитромицину. Так, ампициллин-резистентная гемофильная палочка остается чувствительна к кларитромицину и азитромицину [33]. В то же время пенициллин-резистентные пневмококки скорее всего будут резистентны и к макролидам [21, 25].
Легче всего резистентность к макролидам развивается у таких возбудителей, как пневмококк, стрептококки группы А, гемофильная палочка [20]. В некоторых странах, например на Тайване, у госпитальных штаммов пенициллин-резистентных пневмококков устойчивость к макролидам встречается в 90-95% [21, 35]. В связи с этим макролиды являются препаратами выбора только для лечения внебольничных инфекций, при которых резистентность к ним не столь существенна.
Фармакокинетика
Кларитромицин относится к группе 14-членных макролидов и представляет собой метилированное производное эритромицина. Благодаря этой небольшой химической модификации кларитромицин является наиболее устойчивым макролидом к гидролизу в кислой среде. Это значительно повысило его биодоступность (до 68%), снизило число нежелательный явлений со стороны желудочно-кишечного тракта (ЖКТ) и сделало независимым от приема пищи.
Пища может оказать существенное влияние на биодоступность макролидов. Кларитромицин можно назначать независимо от еды [8, 41], тогда как эритромицин лучше принимать только натощак из-за гидролиза в кислой среде желудка. Пища также замедляет скорость всасывания рокситромицина и азитромицина, поэтому эти препараты не следует принимать меньше чем за 1 ч до еды и раньше чем через 2 ч после приема пищи [9].
Приблизительно 1/2 дозы кларитромицина метаболизируется микросомальными ферментами печени с образованием активного метаболита 14-гидроксикларитромицина [8, 41]. Антибактериальная активность 14-гидроксикларитромицина мало уступает предшественнику, поэтому эффект первого прохождения через печень практически не влияет на активность лекарства и парентеральное введение имеет мало преимуществ. Благодаря синергизму со своим активным метаболитом кларитромицин все равно будет сохранять высокую активность, даже если уровень препарата в крови несколько ниже минимальной подавляющей концентрации. Метаболиты других макролидов антибактериальной активностью не обладают.
Связывание с гликопротеинами плазмы у макролидов различается. Наибольшим связыванием характеризуется рокситромицин (до 96%). Это может создавать трудности при назначении детям, склонным к гипопротеинемиям (недоношенные, дети с паренхиматозными заболеваниями печени, нефротическим синдромом, гипотрофией, кахексией, ферментопатиями), из-за опасности развития токсических реакций [10]. Кларитромицин значительно меньше связывается с белками (приблизительно на 50%) [11] и может назначаться всем детям независимо от состояния белкового обмена.
Максимальная сывороточная концентрация препарата достигается уже через 2 ч после перорального приема. Время полувыведения кларитромицина при приеме 2 раза в день составляет около 5 ч.
Таблица 1. Концентрации кларитромицина (в мкг/мл) в плазме и в тканях легкого на 5-й день лечения (доза 500 мг 2 раза в день)
| Время проведения бронхоальвеолярного лаважа после последней дозы, ч | Плазма | Альвеолярная жидкость | Альвеолярные макрофаги |
| 4 | 2,00±0,6 | 34,5±29 | 480±533 |
| 8 | 1,55±0,4 | 26,1±7 | 220±86 |
| 12 | 1,22±0,3 | 15,1±11 | 181±79 |
| 24 | 0,23±0,1 | 4,6±3 | 99,4±50 |
Тканевое накопление кларитромицина обеспечивает постоянное присутствие препарата в высоких концентрациях в очаге инфекции во время интервала между его приемами и некоторое время после окончания курса лечения (табл. 1). Это также позволило получить хорошие терапевтические результаты при попытке принимать кларитромицин 1 раз в день и укороченным курсом [52-54,73, 74, 78].
Выведение кларитромицина осуществляется печенью, почками и трансинтестинальным путем. При почечной недостаточности необходимо снижать дозу препарата. При печеночной недостаточности дозу уменьшать не следует [41].
Применяемая в педиатрии суспензия кларитромицина не имеет существенных отличий по фармакокинетическим характеристикам от таблетированной формы препарата. После приема суспензии образуется несколько меньшее количество метаболита 14-гидроксикларитромицина, но средняя сывороточная концентрация препарата выше [36].
Резистентность и фармакокинетика
При лечении инфекционного процесса антибиотики воздействуют не только на непосредственных возбудителей, но и на все чувствительные микроорганизмы микрофлоры. При этом возможна селекция резистентных штаммов и флора становится резервуаром для устойчивых микроорганизмов и детерминант резистентности. Это может затруднить лечение инфекций у пациента в будущем. Длительное действие препарата способствует развитию резистентности, особенно если концентрации антибиотика на слизистых оболочках долго держатся на субингибиторном уровне [3]. Это наиболее важно для макролидов, так как резистентность к ним развивается быстро и нерациональное их применение сегодня может сделать эти хорошие препараты неэффективными в дальнейшем [20].
ALeach сообщает о том, что дети с трахомой через 2 мес после успешного лечения азитромицином были колонизированы азитромицин-резистентным S. pneumoniae в 21% случаев, тогда как до лечения только в 1,3% [2].
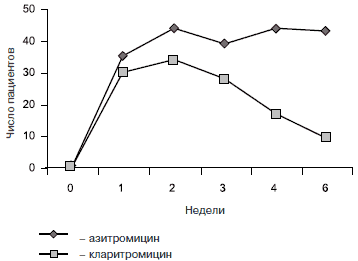
Частота выявления штаммов бактерий, резистентных к макролидам, после лечения азитромицином и кларитромицином [18].
Для снижения развития резистентности следует выбирать препараты, которые наименьшим образом воздействуют на естественную микрофлору человека, а также назначать адекватную суточную дозу и режим применения. Из антибиотиков группы новых макролидов наиболее щадящей фармакокинетикой обладает кларитромицин, который значительно меньше способствует селекции резистентности, чем азитромицин.
Кларитромицин при лечении инфекций нижних дыхательных путей у детей
Долгое время основными возбудителями инфекций нижних дыхательных путей у детей были пневмококк и гемофильная палочка и традиционные препараты вполне справлялись с этими возбудителями. В настоящее время эти бактерии остаются основными возбудителями пневмоний у новорожденных [40]. В последнее десятилетие на фоне неуклонного роста резистентности стрептококков, стафилококков и других возбудителей к препаратам пенициллинового ряда и другим широко применяемым антибиотикам наблюдается усиление значимости атипичных возбудителей, к которым относят хламидии, микоплазмы, легионеллы. Частота пневмоний, вызванных этими внутриклеточными возбудителями, постоянно увеличивается и в настоящее время варьирует в пределах 5-30%. Наиболее характерны атипичные пневмонии для детей школьного возраста [40, 52].
Кроме того, все чаще пневмония становится смешанной инфекцией, в которой могут одновременно участвовать и традиционные бактерии, и внутриклеточные микроорганизмы, и даже анаэробы. Участие нескольких возбудителей при достаточной тщательности исследования встречается почти в 1/2 случаев [24].
В этих условиях для лечения инфекций нижних дыхательных путей должны применяться препараты, обладающие активностью против всех наиболее вероятных возбудителей: стрептококков, пневмококков, стафилококков, гемофильной палочки, моракселлы, хламидий, микоплазм, легионелл, анаэробов. Кларитромицин обладает такой активностью, не уступает традиционным препаратам, а нередко и превосходит их по эффективности и имеет хорошую переносимость. Кларитромицин можно рекомендовать как препарат первого выбора для лечения внебольничных инфекций нижних дыхательных путей у детей [20, 40, 41, 46, 48, 52].
По сравнению с эритромицином кларитромицин показывает сходную эффективность, но наблюдается значительно меньше нежелательных явлений [41]. Так, в многоцентровом рандомизированном двойном слепом исследовании сравнивали эритромицин и кларитромицин при лечении пневмоний у 268 подростков [47]. Клиническая, рентгенологическая и микробиологическая эффективность препаратов была одинакова как для типичных, так и для атипичных пневмоний и составила 97% для кларитромицина и 96% для эритромицина. Однако пациенты, получавшие эритромицин, в 2 раза чаще страдали от побочных эффектов со стороны ЖКТ и в 5 раз чаще вынуждены были прервать лечение препаратом.
По клинической эффективности при лечении инфекций дыхательных путей между эритромицином и новыми макролидами нет значимых различий. Новые макролиды имеют преимущество как препараты со значительно лучшей переносимостью и более удобным режимом приема, что особенно важно для детей.
По эффективности кларитромицин не уступает не только другим макролидам, но также цефалоспоринам I и II поколений, защищенным и незащищенным пенициллинам 41. Более того, по активности против стафилококков, пневмококков и гемофильной палочки он может превосходить такие широко применяемые при лечении респираторных инфекций антибиотики, как рокситромицин, цефаклор и амоксициллин [29].
Некоторые авторы отмечают, что основные симптомы заболевания исчезают значительно быстрее при лечении кларитромицином, чем другими макролидами, а также фторхинолонами, пенициллином, амоксициллином и цефалоспоринами [28]. Возможно, это связано с высокой степенью антибактериальной активности кларитромицина. Данный факт имеет фармакоэкономическое значение, так как уменьшает затраты на симптоматическую терапию.
В последнее время появились сообщения, свидетельствующие о связи между бронхиальной астмой и инфицированием Chlamydiapneumoniae. Так, в работе U.Emre и соавт. у 11% детей с приступом удушья были обнаружены антитела к этому внутриклеточному возбудителю [43]. У 75% детей после эрадикации хламидий эритромицином или кларитромицином отмечали улучшение состояния по данным клинического и лабораторного обследования. Авторы предлагают включить макролиды в курс терапии детей с приступом бронхиальной астмы.
Кларитромицин при лечении ангин у детей
По данным крупного европейского многоцентрового исследования, при лечении тонзиллита или фарингита у 1065 детей кларитромицин был эффективен в 95% случаев [25].
Так, J.Still и соавт. провели рандомизированное исследование с участием 367 детей, страдающих стрептококковым, серологически подтвержденным фарингитом. В работе сравнивалась эффективность кларитромицина и пенициллина V. Оба препарата были высокоэффективны клинически, но по частоте эрадикации, исследуемой на 10-й день после окончания лечения, кларитромицин достоверно был эффективнее. Клиническое излечение в группе кларитромицина наблюдалось в 96%, а в группе пенициллина в 94% случаев. Эрадикация стрептококка была достигнута в 92 и 81% случаев соответственно [56]. Похожие данные, свидетельствующие о равной клинической эффективности макролида и пенициллина, но о лучшей эрадикации возбудителя в группе кларитромицина, были получены в другом контролируемом исследовании [63]. Более полная эрадикация в группе кларитромицина может быть связана с тем, что макролиды не разрушаются β-лактамазами стафилококков, гемофильных палочек и моракселл, присутствующих в ротоглотке, как это нередко происходит с препаратами пенициллинового ряда, когда стрептококк in vitro проявляет чувствительность, а эффективность in vivo существенно меньше из-за резистентной β-лактамазапродуцирующей сопутствующей микрофлоры и полной эрадикации не наблюдается [60].
Данные об одинаково высокой клинической (98 и 97% соответственно) и бактериологической (86 и 88% соответственно) эффективности кларитромицина и амоксициллина при тонзиллофарингите были получены в контролируемом британском исследовании с участием 191 ребенка [62].
Так, при сравнении кларитромицина, назначаемого в стандартной дозе в течение 5 дней, и 10-дневного курса терапии пенициллином оба препарата были высокоэффективны клинически, но частота эрадикации была значительно выше при применении кларитромицина (94 и 78% соответственно) [74].
В некоторых районах России встречаемость штаммов стрептококков, резистентных к эритромицину и другим макролидам, среди детей и взрослых достигает 13% [6]. По данным испанских педиатров, резистентные к кларитромицину штаммы были обнаружены в 7,8% из 750 наблюдений [55], в то же время в США, по данным широкомасштабного исследования, среди 700 детей резистентность пиогенного стрептококка к кларитромицину составляет меньше 2% и не является значимой клинической проблемой [58]. Ввиду быстрого развития резистентности повторное лечение макролидами в случае рецидива нежелательно, а первичное лечение лучше проводить кларитромицином, так как он благодаря своим фармакокинетическим способностям меньше способствует индукции резистентности.
Кларитромицин при лечении среднего отита у детей
При остром среднем отите макролиды можно использовать в качестве хорошей альтернативы к аминопени-циллинам и котримоксазолу, фармакокинетика которых не позволяет достигать высоких концентраций в полости среднего уха, тогда как кларитромицин обладает способностью накапливаться в очаге воспаления. Так, концентрация препарата в жидкости среднего уха у детей, страдающих острым средним отитом, была в 3-5 раз выше, чем в плазме крови [67]. Кроме того, β-лактамные антибиотики (пенициллины, цефалоспорины) могут разрушаться β-лактамазами пенициллин-резистентных штаммов пиогенного стрептококка и гемофильной палочки, которые получают все большее распространение [68, 69]. β-Лактамазы могут вырабатывать также другие бактерии, составляющие микрофлору носоглотки [68]. В России высока резистентность к котримоксазолу, поэтому макролиды можно рекомендовать использовать не как альтернативные препараты, а как лекарственные средства первого выбора и наибольшее предпочтение имеют новые макролиды, особенно кларитромицин [69].
По данным ряда многоцентровых исследований, суспензия кларитромицина высокоэффективна при среднем отите у детей. В германском исследовании с участием 102 пациентов на 5-й день терапии кларитромицином клиническое излечение было достигнуто в 99% случаев [66]. Побочные эффекты наблюдались у 3% детей. В испанском исследовании эффективности кларитромицина при респираторных инфекциях у детей [25] участвовали 310 больных острым средним отитом. Препарат показал свою эффективность в 96,1% случаев.
В большом количестве контролируемых сравнительных исследований было показано, что кларитромицин не уступает защищенным и незащищенным пенициллинам, цефалоспоринам, другим новым макролидам, а нередко и превосходит некоторые препараты, особенно пенициллины, по эффективности или безопасности 72.
Так, в рандомизированной работе с участием 736 детей кларитромицин показал одинаковую эффективность с амоксициллином/клавуланатом и цефаклором. При этом частота побочных эффектов у кларитромицина была в 2 раза меньше, чем в группе получавших амоксициллин/клавуланат, и составила 16% (36/221) для кларитромицина и 30% (74/244) для защищенного пенициллина [71].
При рандомизированном сравнении [70] суспензий кларитромицина и амоксициллина отдаленный эффект клинического излечения был получен в группе кларитромицина у 95% (20/21) детей, а в группе амоксициллина у 86% (19/22). Частота побочных эффектов не различалась и составила по 1 ребенку в каждой группе, но если в группе макролида тяжесть нежелательных явлений позволила продолжить лечение, то ребенок, получавший амоксициллин, был вынужден прервать терапию.
В слепом рандомизированном сравнительном исследовании кларитромицина и цефуроксима аксетила оказалось, что препараты одинаково высокоэффективны при лечении среднего отита, хорошо переносятся детьми и не различаются по частоте развития побочных эффектов [72].
Обычный курс лечения острого среднего отита составляет 10 дней. Более короткий 5-дневный курс терапии оказался не менее эффективным и более удобным для пациента [73, 75]. В рандомизированном слепом плацебо-контролируемом исследовании с участием 138 детей было показано, что назначение кларитромицина в течение 5 дней также эффективно и безопасно, как и 10-дневный курс лечения [75]. При сравнении кларитромицина и азитромицина, назначаемых в течение 5 дней, оба препарата были одинаково эффективны в 99% случаев при лечении детей со средним отитом; не различались они и по частоте нежелательных явлений.
Риносинуситы
Кларитромицин высокоактивен против основных возбудителей синуситов у детей и превосходит эритромицин по активности против гемофильной палочки. Кроме того, кларитромицин хорошо проникает в слизистую пазух носа и накапливается в них в концентрациях, превышающих сывороточные и минимальные подавляющие концентрации для возбудителей синусита [8, 79].
Контролируемых сравнительных исследований эффективности кларитромицина при синуситах у детей не проводилось. Однако на основании многоцентровых слепых рандомизированных сравнительных исследований, проведенных с участием взрослых, можно утверждать, что кларитромицин сопоставим по эффективности с ципрофлоксацином [82], левофлоксацином [80] и азитромицином [81].
Коклюш
У детей с коклюшем макролиды хотя и не влияют на продолжительность заболевания, но уменьшают тяжесть его клинических проявлений и вызывают быструю эрадикацию Bordetella pertussis из носоглотки [52, 76]. По этой причине макролиды, в том числе кларитромицин, могут применяться как препараты выбора для лечения коклюша у детей, а также для профилактического лечения членов семьи больного [77].
Обычно рекомендуемый курс лечения эритромицином составляет 12 дней. Однако благодаря улучшенным фармакокинетическим характеристикам новые макролиды, кларитромицин и азитромицин, могут применяться в течение 7 дней. Показано, что эффективность терапии при этом не уменьшается [78].
Дозировка
В последнее время, учитывая, что концентрации препарата в очаге воспаления намного превышают сывороточные, все чаще начинают говорить о возможности применения суточной дозы препарата однократно и о более коротком курсе терапии [41, 34]. В рандомизированном перекрестном исследовании на добровольцах было показано, что при назначении кларитромицина 1 раз в день в суточной дозе 500 мг или 2 раза в день в дозе 250 мг форма фармакокинетической кривой была одинакова [52]. При назначении 1 раз в день в тканях легкого высокие концентрации препарата сохранялись постоянно. Концентрация в альвеолярной жидкости превышала минимальную подавляющую для типичных бактериальных патогенов инфекций дыхательных путей, а концентрация в альвеолярных макрофагах превышала минимальную подавляющую концентрацию для важнейших внутриклеточных возбудителей. Таким образом, появились теоретические предпосылки для применения кларитромицина 1 раз в день, которые уже получили клиническое подтверждение.
Так, в двойном слепом рандомизированном многоцентровом исследовании эффективность кларитромицина, применяемого 2 или 1 раз в день, была одинакова при лечении обострения хронического бронхита у 265 взрослых пациентов [52]. Одинаковой также была частота побочных эффектов в целом, хотя нежелательные явления со стороны ЖКТ чаще наблюдались у получавших кларитромицин 2 раза в день.
При инфекциях дыхательных путей, особенно при тяжелых пневмониях, требующих стационарной терапии, может потребоваться внутривенное введение макролидов. К сожалению, до последнего времени парентеральные формы макролидов отсутствовали на российском рынке. У кларитромицина есть внутривенная форма, и она доступна в России.
При лечении инфекций дыхательных путей в стационаре в настоящее время популярна так называемая ступенчатая терапия, когда лечение начинается с внутривенного введения препарата, а затем через 1-3 дня переходят на пероральную форму того же лекарственного средства. Этим обеспечивается и больший комфорт для пациента, и меньше сил и средств затрачивается на лечение при равной эффективности. Благодаря наличию внутривенной формы и суспензии для перорального приема ступенчатую терапию можно использовать при лечении кларитромицином. В многоцентровом исследовании сравнивали кларитромицин и комбинацию цефуроксима и эритромицина при ступенчатой терапии внебольничных пневмоний у 235 пациентов [51]. Значимых различий между группами по частоте клинической или бактериологической эффективности не отмечено, тогда как нежелательных явлений (тошнота, рвота, диарея, боль в животе) было значительно больше среди получавших цефуроксим и эритромицин.
Переносимость и лекарственные взаимодействия
В целом макролиды, особенно представители нового поколения, относятся к препаратам с благоприятным профилем безопасности и хорошо переносятся детьми. Наиболее характерны для детей при приеме кларитромицина нежелательные явления со стороны ЖКТ, такие как тошнота (1%), рвота (6%), диарея (7%), боли в животе (2%) и головные боли (2%). Реже встречаются аллергические реакции, симптомы гепато- и ототоксичности, нежелательные явления со стороны нервной системы [65]. В целом нежелательные явления у эритромицина, кларитромицина и азитромицина не намного различаются и наблюдаются в 4-27% случаев [64]. Это сопоставимо с частотой побочных эффектов, наблюдающихся при приеме детьми суспензий β-лактамных антибиотиков (ампициллина, ампициллина/клавуланата, цефаклора и др.) [65].
Активное использование макролидов в последние годы и расширяющаяся полипрагмазия увеличили вероятность развития лекарственных взаимодействий с препаратами, подвергающимися инактивации системой микросомальных ферментов цитохрома P-450. Поскольку метаболизация кларитромицина осуществляется микросомальными ферментами печени с участием системы цитохрома P-450, то кларитромицин может оказывать влияние на метаболизм всех препаратов, проходящих через эту систему [41]. При этом кларитромицин обладает меньшей способностью, чем эритромицин, увеличивать концентрации в сыворотке таких препаратов, как циклоспорин, варфарин, теофиллин, карбамазепин, терфенадин, но совместное назначение кларитромицина с последними тремя лекарственными средствами противопоказано [64].
Заключение
В настоящее время не утихли споры относительно сравнения преимуществ и недостатков эритромицина и новых макролидов. Еще сложнее разобраться в различиях между наиболее удачными новыми макролидами, азитромицином и кларитромицином [49]. Несмотря на равную клиническую эффективность при лечении инфекций дыхательных путей и мягких тканей, эти препараты имеют существенные различия по таким показателям, как фармакокинетические характеристики, профиль безопасности, комплаентность, частота эрадикации, которые нередко недооцениваются, хотя их необходимо учитывать (табл. 2).
Таблица 2. Сравнительная характеристика эритромицина и кларитромицина
| Показатель | Эритромицин | Кларитромицин |
| Активность против гемофильной палочки | 0 | ++ |
| Активность против стафилококков, пневмококков, стрептококков, хламидий | + | ++ |
| Независимость от приема пищи | 0 | + |
| Активность метаболита | 0 | + |
| Накопление в очаге воспаления | 0 | + |
| Противовоспалительная активность | 0 | + |
| Частота приема | 4 раза в сутки | 2 раза в сутки |
| Нежелательные явления | ++ | + |
| Лекарственные взаимодействия | ++ | + |
В настоящее время выбор эмпирической терапии инфекций у детей должен основываться на таких свойствах препаратов, как эффективность, безопасность (нежелательные явления), комплаентность (возможность перорального применения, независимость от приема пищи, назначение 1-2 раза в день, приятный вкус, короткий курс терапии) [45, 48].
Кларитромицин обладает почти всеми характеристиками идеального антибиотика для лечения респираторных инфекций у детей [7, 8]: высокая биодоступность при пероральном применении, высокая эффективность при относительно низких дозах препарата, длительный интервал между приемами, сбалансированная концентрация в тканях и крови, высокая внутриклеточная концентрация, высокая активность основных метаболитов, широкий спектр антибактериальной активности, включающий всех основных возбудителей инфекций дыхательных путей, и, наконец, безопасность и хорошая переносимость.