Белая ртуть что это такое
Чем опасна ртуть и где она применяется
С детства нам твердят, что ртуть опасна, но при этом многие семьи до сих пор пользуются ртутными градусниками. В Европе их запретили из-за опасности для человека, но именно там ее добывают больше всего. Наравне с энергией атома именно ртуть является тем, опасность чего все понимают, но никак не могут от нее отказаться. Вот такая она противоречивая, но благодаря ее свойствам она до сих пор применяется в огромном количестве отраслей медицины и промышленности. Если вам интересно узнать, как ее получают, где применяют и чем она грозит человеку, кроме привычного ”очень опасно”, то вы зашли по адресу.
Ртуть красива, но опасна.
Что такое ртуть
Давайте сначала разберемся с тем, что вообще представляет из себя ртуть. На латыни ее название звучит, как Hydrargyrum. Она является элементом шестого периода периодической системы элементов, которую подарил нам Д. Менделеев. Атомный номер ртути в таблице — 80, а относится она к подгруппе цинка.
Ртуть не является газом, жидкостью или металлом — она является переходным металлом. При комнатной температуре она представляет собой тяжелую жидкость серебристо-белого цвета. Самой главной особенностью для простого человека является чрезвычайная опасность паров ртути, которые очень ядовиты.
Есть всего два химических элемента, которые при нормальных условиях находятся в жидком состоянии. Ртуть является одним из них наряду с бромом.
В чем опасность ртути
Несмотря на то, что ртуть выглядит как что-то целостное, она выделяет очень много паров, которые при попадании в организм приводят не только к поражению легких, но и к другим часто необратимым изменениям. Особенно опасна она на стадии внутриутробного развития.
При попадании в организм ртуть оказывает токсичное воздействие на пищеварительную, иммунную и нервную системы. Кроме этого, поражаются кожа, почки, легкие и даже глаза. Не зря же Всемирная организация здравоохранения (ВОЗ) относит ртуть к десятку основных веществ, которые представляют наибольшую угрозу для общественного здравоохранения.
Так лучше не делать.
Наиболее опасна ртуть в виде паров или раствора. При попадании в воду она приводит к гибели микроорганизмов и остается в ней навсегда в виде того самого раствора. В итоге, она может попасть в систему водоснабжения и нанести вред целому населенному пункту. Тем более, что для воздействия на человека достаточно даже минимального количества ртути.
Также разделяют два типа ртутных соединений — органические и неорганические. Первые (например, диметилртуть) являются намного более опасными, так как более эффективно взаимодействуют с системами организма.
Сколько таблиц химических элементов существует на самом деле?
Как добывают ртуть
Получение ртути производится промышленным способом. Для ее добычи приходится обрабатывать минерал под названием киноварь или красный камень. Извлечение металла производится путем окислительно-дистилляционного обжига. В результате образуются пары ртути. Они имеют высокую температуру и должны подвергнуться дополнительной обработке. Эти пары конденсируются и очищаются, давая на выходе привычную ртуть.
Крупные залежи ртути в настоящее время находятся в Испании и Словении.
Очень редко, но ртуть все же можно найти в виде месторождений в жидком виде. Впрочем, на современном уровне технологий это не так важно. В старые времена найти ртуть именно в ”готовом” виде действительно было важно.
Применение ртути в медицине
Продолжая тему опасности ртути, стоит отметить, что раньше люди об этом не знали и наоборот лечились ей в чистом виде. Вплоть до 60-х годов прошлого века люди не думали о возможных проблемах. Они ставили зубные пломбы, в которых были соединения ртути, принимали лекарства, в составе которых она была, и совершенно не переживали по поводу разбитого градусника. Более того, многие дети тогда специально разбивали градусники, чтобы играть с ртутью. Она интересно переливается, и если не знать о ее опасности, то все нормально. Скажете, что это так себе развлечение? Тогда вспомните, как все поголовно крутили спиннеры.
Они перетекают и сливаются, но еще и отравляют воздух.
Если взять более давние времена, то в средние века было нормой дать человеку выпить стакан ртути. Считалось, что тяжелая жидкость протолкнет все лишнее в организме, а заодно расправит кишки. Чем заканчивалось такое лечение, история умалчивает, но вряд ли пациенты жили долго и счастливо.
Вплоть до 1967 года в СССР и до конца 1970-х годов в США ртуть активно применялась для лечения сифилиса из-за его высокой устойчивости к другим препаратам. Правда, после такого ”лечения” у людей выпадали волосы и нарушались другие функции организма.
Можно сколько угодно приводить примеры антисептиков, диуретиков, слабительного и других препаратов, в состав которых входила ртуть. Сейчас она осталась только в градусниках (не во всех странах) и в качестве консерванта для некоторых вакцин, но в минимальных дозах.
Что делать, если разбил градусник
Разбитый градусник может показаться незначительной проблемой, но это все равно проблема. В нем будет минимум 2 грамма ртути, что уже не мало. Даже на государственных порталах, в частности на mos.ru, есть ответ на вопрос, как поступить в этом случае.
Если вы разлили небольшое количество ртути (разбитый градусник), первым делом выведите из помещения людей и животных, затем откройте окно и закройте дверь. Так же надо обязательно защитить органы дыхания маской или повязкой. После этого немедленно начинайте собирать ртуть.
Это выглядит очень безобидно, но расслабляться не стоит.
Два грамма ртути, которые содержаться в одном градуснике, в закрытом помещении объемом 20 кубических метров создают концентрацию паров, которая в тысячи раз превышает безопасный для человека уровень.
Как собрать ртуть
При сборе ртути ни в коем случае не сметайте ее веником, чтобы не спровоцировать образование мелкой ртутной пыли. Чем крупнее будут капли — тем лучше. Пылесос тоже плохой помощник, так как испарившаяся ртуть пройдет через фильтры и окажется в воздухе в еще более опасном виде.
Небольшое количество вытекшей из градусника ртути можно собрать с помощью обычной медицинской груши или листа бумаги и вязальной спицы или толстой иглы. Для сбора самых мелких капель можно использовать кусочки пластыря.
Все, что вы собрали и чем вы это собирали, положите в банку и плотно закройте крышкой. После этого тщательно вымойте место происшествия. Хорошим вариантом будет протереть это место раствором марганца или мыльно-содовым раствором. По окончании уборки обязательно тщательно вымойте руки с мылом.
Тщательно мойте руки после уборки ртути.
Как выкинуть разбитый градусник и ртуть из него
Ни в коем случае не выбрасывайте собранную ртуть в мусоропровод или канализацию. Это может привести к дальнейшему риску бесконтрольного заражения. Поставьте банку с собранными отходами на балкон или в гараж и при первой возможности передайте ее в демеркуризационный центр для утилизации.
Как понять, что отравился ртутью
Симптомы отравления ртутью проявляются примерно через 8-24 часа. К основным симптомам относятся общая слабость, боль при глотании, головная боль и повышение температуры. Спустя некоторое время начинают болеть десны и живот, а также проявляются желудочные расстройства и даже воспаления легких. Известны даже случаи смертельного исхода.
Крем для кожи может стать причиной отравления. Как этого избежать?
Какой градусник точнее? Электронный или ртутный?
Специалистам часто приходится отвечать на этот вопрос. Обычно они говорят, что точнее будет именно ртутный градусник, но дома надо иметь и электронный. Объясняют они это тем, что оба прибора могут иметь погрешности и их показания надо перепроверять.
При обычных условиях ртуть всегда жидкая.
Погрешность ртутного градусника составляет примерно 0,1 градуса. Для электронного отклонения, как правило, находятся в диапазоне от 0,2 до 0,4 градуса. Самая большая погрешность у бесконтактных градусников — до 0,5 градуса. Если датчик бесконтактного градусника не протереть, то отклонения могут и вовсе составить 1,5-2 градуса.
Надо помнить, что особенностью ртутного градусника является то, что он показывает максимальную за время измерения температуру, в то время, как электронный обычно дает средние показания, а бесконтактный и вовсе сиюминутные. Температура тела может за 5 минут меняться в пределах одного градуса. Это тоже надо иметь в виду.
Применение бесконтактного термометра наиболее целесообразно для измерения температуры посетителей общественных мест или пассажиров самолетов, а также детей. В этих случаях не получится задержать человека на 5 минут для более точного измерения температуры
Ртуть в промышленности
В промышленности ртуть применяется куда чаще, чем в медицине. В том числе нашла она применение и в высокоточных термометрах благодаря широкому диапазону рабочих температур (тех, при которых она остается в жидком состоянии).
Ртуть надо не только производить, но и утилизировать.
Парами ртути до сих пор заполняются люминесцентные лампы. Ее пары светятся в тлеющем разряде, а в спектре испускания много ультрафиолетового света. Чтобы свет стал видимым, изнутри лампу покрывают люминофором. Без такого покрытия лампа будет источником жесткого ультрафилетового излучения. В таком виде их используют для обеззараживания поверхностей и помещений. Например, в вагонах метро (в депо) или при обработке поручней эскалатора, когда они находятся внизу.
Так ультрафиолетом обрабатывают вагоны метро.
Алхимики прошлого верили, что ртуть является основой любого вещества, и если вернуть ей твердое состояние при помощи серы или мышьяка, то она станет золотом, но у них естественно ничего не получилось
Ртуть применяется в некоторых частях электросхем с высокой средней силой тока (сотни ампер), в датчиках положения, в некоторых химических источниках тока, в полупроводниковых детекторах радиоактивного излучения и даже в качестве рабочего тела некоторых гидродинамических подшипников, работающих под большой нагрузкой.
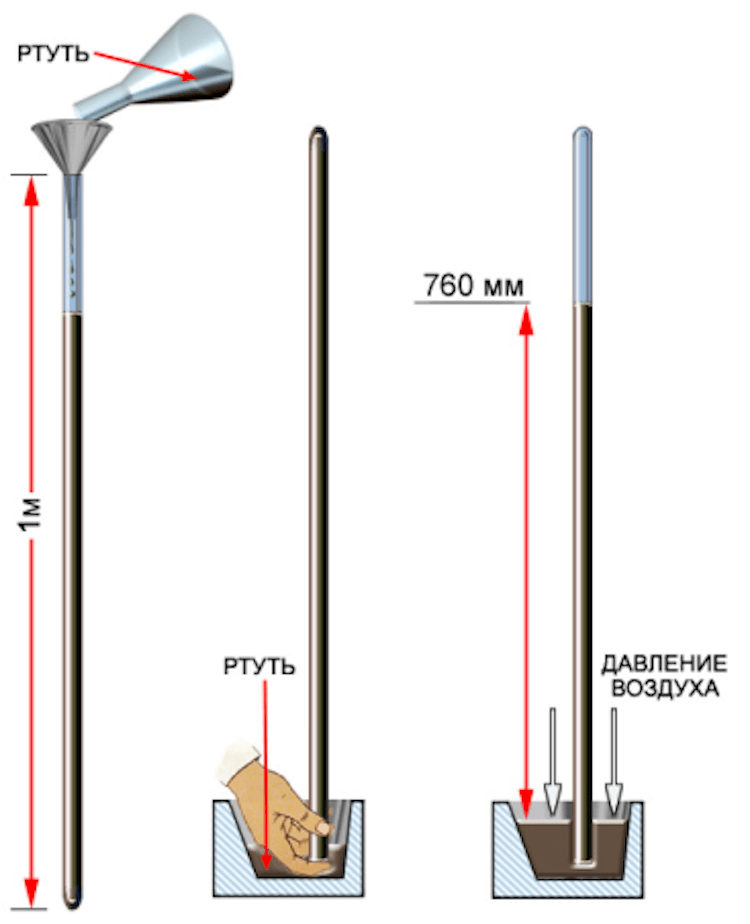
Раньше ртуть также применялась при производстве краски, покрывающей подводную часть кораблей, чтобы избежать ее обрастания. До середины XX века ртуть активно применялась в манометрах, барометрах и других погодных приборах. Отсюда и пошла традиция измерять давление в миллиметрах ртутного столба.
Принцип работы ртутного столба.
Нашла ртуть свое применение и в модной индустрии. Например, раньше ее использовали в шляпном производстве для выделки фетра и для амальгамирования поверхностей при производстве зеркал.
Если не знаете, где читать самые интересные новости из мира науки, то заходите в наш новостной Telegram-канал. Там очень много крутых статей!
Сейчас ртути стараются находить аналоги, чтобы снизить зависимость от этого опасного элемента, но пока до конца это сделать не получилось. Нам же остается только относиться к ней с осторожностью и не пренебрегать нормами безопасности.
Новости, статьи и анонсы публикаций
Свободное общение и обсуждение материалов
Говорят, что самые тяжелые для исполнения музыкальные партии зачастую являются самыми простыми. То же самое и с наукой: простейшие вопросы вроде «из чего сос…
Каждый раз, когда два атома соединяются вместе, они образуют молекулу. На самом деле все, что нас окружает – да и мы сами – состоит из триллионов различных т…
Черные дыры — пожалуй, самые загадочные объекты во Вселенной. Они настолько плотные, что сила тяготения не позволяет ничему, даже свету, покинуть пределы чер…
Ртуть
(молярная масса)
(первый электрон)
Содержание
История
Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
В окружающей среде
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Природная ртуть состоит из смеси 7 стабильных изотопов: 196 Hg (распространённость 0,155 %), 198 Hg (10,04 %), 199 Hg (16,94 %), 200 Hg (23,14 %), 201 Hg (13,17 %), 202 Hg (29,74 %), 204 Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
HgS + O2 ⟶ Hg + SO2↑ HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
p_i_f
ДЛЯ ВСЕХ И ОБО ВСЕМ
В 1886 году в Горловке (ныне Донецкая область Украины) была произведена первая в России ртуть. Этот необычный металл отличается благородным серебристо-белым цветом, и его пары чрезвычайно ядовиты. Хотя ртуть не столь активно применяется в промышленности как железо, золото или серебро, в народе о ней сложилось множество мифов. Мы расскажем о пяти самых распространенных из них…
СМЕРТЕЛЬНЫЕ ШАРИКИ
Существует миф о том, что шарики ртути, которые образуются, например, после того, как разбивается градусник, крайне опасны для здоровья человека. Это не совсем так, сама по себе ртуть опасности не представляет. Вред наносят пары ртути. Поэтому попадание шариков ртути на кожу не вызовет такой реакции, как длительное вдыхание ее паров.
Пары ртути приводят к нарушениям центральной нервной системы человека. Первые симптомы не особенно красноречивы, их легко спутать с обычным недомоганием. Первичное поражение организма парами ртути характеризуется повышенной утомляемостью, слабостью, головными болями, чуть позже начинаются головокружения.
Позже развивается ртутный тремор. Именно на этой стадии, как правило, обращаются к врачу. Ртутный тремор сопровождается дрожанием рук, век, губ, нередко появляется металлический привкус во рту, слезотечения, проблемы с желудком.
САМОСТОЯТЕЛЬНОЕ УСТРАНЕНИЕ РТУТНОЙ УГРОЗЫ
Многие считают, что можно самостоятельно собрать ртуть и устранить опасность отравления. Однако на практике таких результатов достигают немногие. Ртуть очень мобильна и легко распадается на мелкие частички, которые трудно обнаружить «на глаз».
В связи с этим для устранения ртутной угрозы необходимо воспользоваться помощью профессионалов, которые установят экологическое состояние квартиры. Экологическая служба должна провести мероприятия по очистке помещения, предоставить экспертную информацию по профилактике отравления.
Если вы все-таки пытаетесь справиться с ртутной угрозой своими силами, то необходимо хорошо проветрить помещение. Например, если не проветривать комнату площадью 16 кв. м. с потолком высотой 3 м, в которой находится 4 грамма ртути (объем, содержащийся в медицинском градуснике), то концентрация паров ртути на данной площади превысит норму в 27 667 раз.
КРАСНАЯ РТУТЬ
В начале 1990-х годов распространились слухи о создании новой разновидности ртути — красной ртути или вещества RM 20/20, якобы производимого в секретных научных лабораториях СССР.
Красная ртуть, как утверждалось, обладала фантастическими свойствами — от сверхплотности (свыше 20 г/см3) и суперрадиоактивности до космического происхождения и возможности излечивать любые недуги.
Продавцы запрашивали за 1 килограмм ртути от 300 до 400 тыс. долларов. Причем покупатели, в том числе и западные, находились. Покупателю под видом красной ртути подсовывали что угодно — от ртутной амальгамы до обычной ртути, окрашенной красителями или кирпичным порошком.
Многие советские физики-ядерщики неоднократно опровергали возможность создания подобного вещества, объясняя, что это не только противоречит законам природы, но и невозможно на современном технологическом уровне.
Слухи о веществе RM 20/20 через несколько лет утихли сами собой. Нынешние исследователи считают, что ажиотаж был создан намеренно, во имя денежных интересов многих высокопоставленных людей. Впрочем, статьи о реальности научных разработок по созданию красной ртути появляются и сегодня.
МИФ О ДОРОГОВИЗНЕ
Сотрудники милиции регулярно изымают ртуть у граждан, которые пытаются ее продавать. Законодательно такие сделки запрещены. Специалисты утверждают, что в реальности ртуть мало кому нужна и продажи держатся только на заблуждениях граждан о дороговизне ртути.
На самом деле, ртуть не является ценным и востребованным веществом. Ее используют крайне редко, в частности, при изготовлении люминесцентных ламп.
Добычу ртути в России прекратили еще в 1991 году. Но, по данным специалистов, ее запасов хватит еще на десять лет работы промышленности. По словам экспертов, примерно столько же будут процветать незаконные продажи этого тяжелого токсичного металла.
Некоторые умельцы все же умудряются применять ртуть в личных целях. В частности, металл могут использовать при очищении золота от окисей.
ПОЛЕЗНОСТЬ РТУТИ
Многие убеждены, что ртуть имеет целительные свойства и она необходима организму для полноценного функционирования. Появляются статьи о том, что ртуть обладает определенным биотическим эффектом и оказывает стимулирующее действие на процессы жизнедеятельности.
В организме среднего человека массой тела 70 килограмм содержится примерно 13 миллиграмм ртути, однако она, по-видимому, не выполняет никакой физиологической роли. По крайней мере, жизненная необходимость этого металла для человека и других организмов не доказана.
При этом научно доказано, что ртуть, в дозах, превышающих физиологическую потребность, токсична для всех форм жизни, причем практически в любом своем состоянии.
Врач-реаниматолог Рафаєль В. Макаров:
Действительно, опасна не ртуть, а её пары приводящие к хроническому отравлению. И ещё. В старину считалось, что ртуть обладает магическим действием и спасает от нечистой силы и ядов.
Жертвой подобного мифа был Иван Грозный, державший под кроватью чан со ртутью. Длительное вдыхание паров ртути и объясняет психические нарушения царя и его необъяснимую агрессию. А также тот факт, что он в конце жизни практически «сгнил заживо».