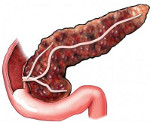
Склероз поджелудочной железы что это такое
Другие уточненные болезни поджелудочной железы (K86.8)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
К данной подрубрике отнесены состояния, различающиеся как по морфологическим признакам, так и по этиологии и патогенезу. Чаще всего они связаны с острым или хроническим панкреатитом (включая алкогольный хронический панкреатит), но не ограничиваются ими.
* Образный термин, введенный в 1887 г. по визуальной аналогии поражения поджелудочной железы с циррозом печени.
** Термин «панкреатонекроз» является скорее патологоанатомическим, нежели клиническим, ввиду чего использовать его в качестве клинического диагноза не совсем верно. Под термином «тотально-субтотальный панкреонекроз» понимается деструкция поджелудочной железы с поражением всех отделов (головка, тело, хвост). Абсолютно тотальный панкреонекроз не встречается.
Этиология и патогенез
Атрофия поджелудочной железы является следствием (стадией) хронического панкреатита (в том числе обструктивного, некалькулезного и калькулезного хронического панкреатита). Атрофия может сочетаться с фиброзом ПЖ.
Также атрофия или фиброз ПЖ могут возникать вследствие следующих причин:
— атеросклероз;
— старческие изменения ПЖ;
— сахарный диабет;
— оперативные вмешательства на ПЖ;
— нарушения питания.
Патологическая и физиологическая атрофия отличаются по этиологии и качественным особенностям. В основе атрофии лежит преобладание процессов диссимиляции над процессами ассимиляции, что связано со снижением активности цитоплазматических ферментов.
Недоразвитие (инфантилизм) поджелудочной железы (клинический синдром Кларка-Хэдфилда) является врожденной формой недостаточности секреции гормонов ПЖ, включая инсулин. Этиология доподлинно неизвестна. Страдают дети младшего возраста.
Панкреонекроз протекает в нескольких видах:
Фиброз поджелудочной железы
Фиброз поджелудочной железы – это диффузное пери- и интралобулярное замещение здоровой функционирующей ткани поджелудочной железы соединительнотканными очагами. Основными симптомами являются выраженная экзокринная (нарушение пищеварения, снижение веса, диарея) и эндокринная недостаточность органа (нарушение углеводного обмена). Диагностика включает проведение лабораторных исследований, УЗИ поджелудочной железы, КТ, биопсии. Лечение направлено на коррекцию внешнесекреторной недостаточности (ферментные препараты), гипергликемии. Прогноз неблагоприятный: полное излечение невозможно, при адекватной терапии достижима компенсация панкреатической недостаточности.
МКБ-10
Общие сведения
Фиброз поджелудочной железы – клинико-морфологическая форма хронического воспалительного процесса панкреас, являющаяся исходом, завершающим этапом течения основного заболевания. Распространенность фиброза поджелудочной железы неуклонно растет в связи с увеличивающейся частотой острых и хронических панкреатитов; данная патология диагностируется более чем у 40% пациентов с заболеваниями панкреас.
При злоупотреблении спиртными напитками полное замещение паренхимы поджелудочной железы фиброзной тканью развивается в течение 15-20 лет, что приводит к инвалидизации и летальному исходу. Росту заболеваемости способствует неэффективное лечение основной патологии, несоблюдение пациентами рекомендаций, зачастую – продолжение алкоголизации. Лечением фиброза поджелудочной железы занимаются специалисты в области клинической гастроэнтерологии, терапии, хирургии.
Причины
Основной причиной развития фиброза поджелудочной железы является хронический панкреатит. Специалистами доказано, что очаги замещения функционирующих элементов соединительной тканью формируются в периоды обострения воспаления, и их распространенность зависит от стажа заболевания.
Фиброз поджелудочной железы также может развиваться при заболеваниях, сопровождающихся повышением давления в протоковой системе панкреас (при патологии желчевыводящих путей и желчного пузыря): панкреатическая гипертензия приводит к нарушению целостности протоков, повреждению паренхимы, воспалению. К редким причинам фиброза поджелудочной железы относят гиперлипидемию, муковисцидоз, воздействие токсических веществ (в том числе лекарственных препаратов: гипотиазида, ацетилсалициловой кислоты и других), травмы.
Факторы риска
К рецидивированию основной патологии и прогрессированию фиброза поджелудочной железы чаще всего приводит:
Патогенез
Независимо от провоцирующих факторов, фиброз поджелудочной железы является следствием аутолиза ее паренхимы при активации протеолитических ферментов, отека, некроза и инфильтрации. Патогенез заболевания при воздействии алкоголя имеет особенности: в результате алкогольного повреждения снижается содержание в панкреатическом соке бикарбонатов и повышается уровень белка, вследствие чего белковые преципитаты в виде пробок обтурируют мелкие протоки, создавая условия для формирования фиброза поджелудочной железы.
Симптомы
Клиническая картина фиброза поджелудочной железы определяется внешнесекреторной недостаточностью (снижением секреции ферментов, бикарбонатов и уменьшением объема панкреатического сока) и нарушением углеводного обмена. Объем продуцируемых ферментов снижается на 80-90% и более, поэтому симптомы экзокринной недостаточности при фиброзе поджелудочной железы выражены существенно: снижается масса тела, имеет место диарея до восьми раз в сутки (при приеме ферментных препаратов и соблюдении пациентом диеты данный признак может быть менее выраженным или даже отсутствовать), стеаторея.
Вследствие нарушения секреции бикарбонатов снижается интрадуоденальный уровень рН, что приводит к активации цАМФ клеток кишечной стенки и секреторной диарее: наблюдается водянистый стул. Снижение массы тела вызвано не только нарушением переваривания пищи и ее всасывания в кишечнике, но и ограничением ее объема при болевом синдроме.
Осложнения
Длительная стеаторея при фиброзе поджелудочной железы приводит к дефициту жирорастворимых витаминов (К, А, Е, D), что проявляется нарушением адаптации зрения в условиях темноты, повышенной кровоточивостью, развитием остеопороза. У подавляющего большинства пациентов имеет место нарушение углеводного обмена, а у двух третей – признаки сахарного диабета (сухость во рту, жажда, общая слабость, кожный зуд, сонливость). Поскольку фиброзные изменения затрагивают все клетки островкового аппарата железы, снижается секреция и инсулина, и глюкагона. Диабет при фиброзе поджелудочной железы редко сопровождается гипогликемическими состояниями, кетоацидозом, ангиопатией.
Диагностика
Консультация гастроэнтеролога при фиброзе поджелудочной железы позволяет выявить некоторые объективные признаки патологии: дистрофические изменения (вплоть до кахексии), сухость кожи, языка, цианоз, покраснение лица, атрофию подкожной клетчатки в области проекции панкреас. Поджелудочная железа пальпируется в виде плотного тяжа. Лабораторно-инструментальная диагностика:
Лечение фиброза поджелудочной железы
Лечение фиброза поджелудочной железы направлено на восполнение внешне- и внутрисекреторной недостаточности. Назначается диета № 5п, включающая стимулирующие секрецию ферментов блюда, продукты с высоким содержанием белка. Ограничиваются легкоусвояемые углеводы. При выраженной кахексии питание парентеральное. Этиотропное лечение заключается в устранении причин патологии (исключение употребления алкоголя, проведение холецистэктомии при желчнокаменной болезни, хирургическое лечение папиллостеноза и т. д.).
С целью замещения экзокринной недостаточности назначаются ферментные препараты: панкреатин, липаза и другие. При абсолютной недостаточности поджелудочной железы данные препараты применяются постоянно в максимальных дозировках. Критериями эффективности заместительной терапии являются прекращение снижения массы тела, снижение диспепсических явлений, устранение диареи. Коррекция нарушений углеводного обмена проводится пероральными сахароснижающими препаратами; крайне редко требуется инсулинотерапия. Вне эпизодов обострения основного заболевания показано санаторно-курортное лечение.
При выраженном болевом синдроме, неэффективности консервативной терапии, стремительном снижении веса, частых рецидивах панкреатита проводится хирургическое лечение фиброза (резекция поджелудочной железы в различных объемах).
Прогноз и профилактика
Прогноз при фиброзе поджелудочной железы определяется объемом функционирующей ткани, а также соблюдением пациентом рекомендованного лечения. При полном пожизненном отказе от алкоголя, правильном применении ферментных препаратов возможно длительное течение заболевания без существенного прогрессирования. Однако не существует методов, позволяющих устранить фиброз.
Профилактика патологии заключается в отказе от алкоголя, своевременном лечении заболеваний, которые могут стать причиной фиброза поджелудочной железы. Пациенты с диагностированным фиброзом подлежат диспансеризации. Дважды в год необходимо профилактическое обследование с оценкой наличия или отсутствия прогрессирования и проведением коррекции терапии (при необходимости).
Склероз поджелудочной железы что это такое
Курс хирургической гепатологии кафедры хирургии ФППОВ и отдел хирургии печени Московской медицинской академии им. И.М. Сеченова, ГКБ №7, Москва
Отдел гепатопанкреатобилиарной и регенеративной хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова Минздрава РФ
Фиброз поджелудочной железы при хроническом панкреатите
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(12): 96-102
Гальперин Э. И., Семененко И. А. Фиброз поджелудочной железы при хроническом панкреатите. Хирургия. Журнал им. Н.И. Пирогова. 2015;(12):96-102.
Gal’perin É I, Semenenko I A. Fibrosis of pancreas in chronic pancreatitis. Khirurgiya. 2015;(12):96-102.
https://doi.org/10.17116/hirurgia20151296-102
Курс хирургической гепатологии кафедры хирургии ФППОВ и отдел хирургии печени Московской медицинской академии им. И.М. Сеченова, ГКБ №7, Москва
Курс хирургической гепатологии кафедры хирургии ФППОВ и отдел хирургии печени Московской медицинской академии им. И.М. Сеченова, ГКБ №7, Москва
Отдел гепатопанкреатобилиарной и регенеративной хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова Минздрава РФ
Хронический панкреатит (ХП) — воспалительное заболевание, сопровождающееся прогрессирующими морфологическими повреждениями ткани и функциональной недостаточностью поджелудочной железы (ПЖ). С каждой атакой острого панкреатита паренхима ПЖ необратимо замещается рубцовой фиброзной тканью [31]. Злоупотребление алкоголем продолжает оставаться основной причиной ХП [20]. В мире первичная ежегодная заболеваемость ХП составляет 8 новых пациентов на 100 000 населения [41], общая заболеваемость ХП — 26,4 на 100 000 популяции [52].
Основной морфологической характеристикой ХП является развитие фиброза и фиброзно-кистозное перерождение ПЖ [13]. При этом фиброзные ткани постепенно замещают паренхиму ПЖ, а выраженность и типы фиброзно-рубцовых изменений определяются длительностью воздействия и видом этиологического фактора [31].
В настоящее время для диагностики ХП используется около 90 различных методов исследования, однако большинство из них не позволяет установить диагноз ХП на ранней стадии заболевания [8], что приводит к прогрессированию процесса и необходимости проведения хирургического вмешательства.
Операции при ХП в основном имеют резекционный характер (резекция головки ПЖ, корытообразное иссечение стенок главного панкреатического протока и др.) [56], так как в настоящее время показано, что основная жалоба больных на боли в области ПЖ связана не только с панкреатической протоковой гипертензией, но и с прорастанием нервных путей фиброзной тканью [37]. Выраженность фиброза при таких операциях имеет принципиальное значение, так как вмешательства на «мягкой» железе сопровождаются кровотечением и послеоперационными осложнениями, среди которых панкреонекроз служит одной из причин высокой летальности [27, 28, 47, 54, 57]. В связи с этим сведения о развитии фиброза, его морфогенезе, возможности рассасывания и диагностики приобретают особую значимость.
Морфофиброгенез ПЖ
В развитии фиброза решающую роль играет продукция коллагена. В настоящее время насчитывают 28 типов коллагена, которые различаются аминокислотной последовательностью, органной и тканевой принадлежностью, а также интенсивностью гидроксилирования или гликозилирования. Различают коллаген I типа (в соединительной ткани, костях и других тканях), коллаген II типа (в хрящах, стекловидном теле и роговице глаза), коллаген III типа (в стенках крупных кровеносных сосудов), коллаген IV типа (в базальных мембранах, капсуле хрусталика), коллаген V типа (в хорионе, амнионе, эндо- и перимизии, коже и других тканях), а также коллагены VI—XVI типов — интерстициальные и нефибриллярные коллагены [5]. Основными продуцентами коллагена являются фибробласты, а также звездчатые клетки (pancreatic stellate cells — PSC, клетки Ито), которые мигрируют в область некроза и трансформируются в миофибробласты. Типы коллагена сменяют друг друга, начиная с III и заканчивая I, обусловливая фазы фиброзного процесса [9], при этом коллаген I типа содержит большое число поперечных сшивок. Он характерен для плотной рубцовой соединительной ткани, плохо расщепляющейся протеазами.
При исследовании морфологического состояния нормальной ПЖ фибробласты соединительнотканных междольковых перегородок характеризуются слабой экспрессией коллагена III типа. В состав базальных мембран ацинусов входит коллаген IV типа. Экспрессия гладкомышечного актина-α отмечается только в гладкомышечных оболочках стенок сосудов и полностью отсутствует в строме ПЖ [9].
Фиброз при ХП является, как правило, результатом некроза клеток ПЖ, а также следствием дисбаланса между синтезом и деградацией белкового экстрацеллюлярного матрикса (ЭМ) [49]. Панкреатический фиброз инициируется, как уже было указано, путем активации различными факторами панкреатических матрикспродуцирующих ретиноидсодержащих звездчатых клеток, которые при этом видоизменяют свое морфологическое строение и приобретают способность продуцирования коллагеновых волокон, приводя к избыточному их скоплению в ткани ПЖ [21, 26, 45]. Панкреатические звездчатые клетки (ПЗК), выделенные культурально впервые в 1998 г. [16, 18], являются постоянно присутствующими в ПЖ клетками, которые располагаются в ее периацинарных, перидуктальных и периваскулярных пространствах и составляют около 4—7% клеток этой железы в норме [45].
Введение в культуру этих клеток витамина, А приводит к их дифференцировке в миофибробластоподобные клетки, экспрессирующие мышечный актин-α, коллагены I и III типов, ламинин и фибронектин (рис. 1 и далее) [21, 24].

В 2010 г. M. Erkan и соавт. [25] показали, что панкреатические и печеночные звездчатые клетки (ключевые медиаторы фиброза печени) имеют сходный геномный рисунок транскрипции, при этом ПЗК отличаются продукцией специфического коллагена I типа 11α1 — COLL11α1. В исследовании О.В. Паклиной [9] показано, что при прогрессировании фиброза ПЖ у больных ХП происходит накопление во внеклеточном матриксе коллагенов III и V типов и их последующая необратимая трансформация в коллаген I типа, который характерен для цирротических изменений, старых рубцов и плохо расщепляется протеазами. Дисбаланс между продукцией коллагенов и их естественными ингибиторами приводит в итоге к развитию фиброза ПЖ [23, 44].
В исследовании B. Muehling и соавт. [38] при сравнении выраженности фиброза головки и тела ПЖ у оперированных больных с ХП выявлено, что в случае алкогольного ХП выраженность фиброза в головке ПЖ, определяемая компьютерным методом с помощью Adobe Photo Shop, составляла в среднем 64% при 47% в теле ПЖ, при идиопатическом ХП — 40 и 32% соответственно. При этом в головке ПЖ среди компонентов ЭМ, помимо коллагена I, III типов, в большем по сравнению с телом ПЖ количестве присутствует коллаген IV типа (в протоковом эпителии) и ламинин (в базальных мембранах). Авторы подчеркивают, что этот факт также свидетельствует о роли головки ПЖ как «пейсмекера» хронического панкреатита, а коллаген IV типа и ламинин играют важную роль в фиброгенезе хронического панкреатита [38].
После перенесенного острого некротического панкреатита ПЗК и их последующие формы — активированные миофибробласты, как показывают исследования A. Zimmermann и соавт. [58], могут участвовать не только в процессах фиброза ПЖ, но и ее ремоделировании путем формирования регенераторных центров, тубулярных комплексов, исходящих из оставшихся после панкреонекроза долек ПЖ [58]. Это явление представляет собой компенсаторную реакцию на гипоксию и повреждение паренхимы ПЖ в виде метаплазии ацинарной ткани в более примитивный протоковый эпителий [9, 58].
Зависимость между эпизодом острого панкреатита (ОП) и развитием ХП в течение нескольких последних десятилетий является предметом ряда исследований, в которых предпринимались попытки определения возможных патогенетических механизмов такой взаимосвязи [32]. Потенциальная возможность трансформации ОП в ХП впервые была сформулирована еще в 1946 г. М. Comfort и соавт. [19] в виде «теории соотношения некроза и фиброза», которая в настоящее время занимает лидирующую позицию [53]. Механизм развития ХП реализуется посредством повторных эпизодов О.П. Научное обоснование этой теории базируется прежде всего на морфологических исследованиях, проведенных G. Kloppel и B. Maillet [32]. Авторы показали, что перипанкреатические некрозы не являются причиной развития ХП, в то время как интрапанкреатический некроз приводит вначале к перилобулярному фиброзу, а в дальнейшем к интралобулярным протоковым изменениям. В настоящее время теория развития ХП в результате рецидивов ОП находит подтверждение в большинстве клинических и экспериментальных исследований [12]. Важная роль в пусковом механизме необратимых рубцово-фиброзных изменений по-прежнему отводится активации ПЗК [36].
Среди факторов повреждения ПЖ, являющихся триггерными в механизме прямой и опосредованной активации ПЗК с последующей гиперпродукцией ЭМ и развитием фиброза ПЖ, выделяют этанол и его метаболиты (ацетальдегиды), оксидативный стресс, паренхиматозную и протоковую панкреатическую гипертензию, гипергликемию, циклооксигеназу-2, активируемый G-пептидом рецептор-2 и инфекционный фактор [17, 48].
Большое значение в резорбции фиброза в настоящее время придается стволовым клеткам, в частности мезенхимальным стромальным клеткам костного мозга. В процессе культивирования in vitro можно получить линию стволовых клеток, специфически органонаправленную, которая при трансплантации превращается в функционально активные клетки органа. На этом пути стволовые клетки подавляют главные клеточные источники, экспрессирующие коллаген и матричные белки, а также секретируют ММП, резорбирующие коллагеновые волокна. Имеются экспериментальные и единичные клинические наблюдения, указывающие на возможность резорбции соединительной ткани при циррозе печени и некоторых других органов [7].
Лабораторная диагностика фиброза
Поиск различных лабораторных критериев ранней диагностики фиброза ПЖ привел к изучению семейства металлопротеиназ плазмы крови, а именно MMП-9 (желатиназа В, участвующая в биодеградации коллагена I, III и IV типов во внеклеточном матриксе). A. Venkateshwari и соавт. [55], исследуя 112 больных с ХП, показали достоверную значимость повышения уровня ММП-9, что приводит к активации панкреатических звездчатых клеток, а также к избыточному разрушению коллагена IV типа, участвующего в норме в межклеточных связях.
При исследовании уровня ММП-1 (коллагеназа) и ММП-3 (стромелизин), а также трансформирующего фактора роста β1 (TGF-β1) у 71 больного ХП по сравнению с контрольной группой (100 здоровых) выявлено достоверное повышение уровня ММП-1 и TGF-β1 (р 

Среди инструментальных методов определения плотности ткани с 1995 г. применяется МР-эластография, которая включает визуализацию распространения поперечной составляющей колебаний акустического диапазона частот в тканях, что позволяет рассчитать количественные значения для механических параметров ткани [39].
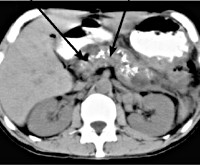
Среди лучевых методов диагностики фиброза ПЖ применяется определение коэффициента соотношения КТ-плотности в разные фазы болюсного контрастирования. При этом Y. Hashimoto и соавт. [28] определяли соотношение L/E ratio — «поздней» (печеночная паренхиматозная фаза на 60—70-й секунде от момента введения контрастного вещества) и «ранней» (панкреатическая паренхиматозная фаза — на 40—45-й секунде) фаз болюсного контрастирования за вычетом из каждого показателя в единицах Хаунсфилда величины плотности каждого из отделов ПЖ в нативную фазу до контрастирования. Авторы показали достоверную положительную корреляцию коэффициента L/E ratio с гистологической степенью фиброза.
Оценка перфузионных свойств ткани ПЖ при хроническом панкреатите в исследовании российского автора Н.И. Яшиной [10] косвенно показала, что при увеличении степени выраженности фиброза ПЖ коэффициент изменения плотности в артериальную фазу снижается, а в отсроченную фазу исследования повышается, однако в данном исследовании статистически достоверный корреляционный анализ гистологических и КТ-данных не проводился.
Предикторы фиброза ПЖ
Существуют различные предикторы наличия фиброзно-измененной ПЖ, косвенно указывающие на выраженность ее фиброза. Так, одним из маркеров выраженности фиброза ПЖ может служить наличие кальцинатов в ее паренхиме. R. Ammann и соавт. [13] и G. Kloppel и соавт. [31] выявляли их у 88,4% больных при выраженном фиброзе по 12-балльной шкале (Fibrosis Scale — FS) более 7 баллов, у 44,5% больных при умеренно выраженном фиброзе менее 6 баллов. Y. Hashimoto и соавт. [28] установили достоверную корреляционную связь между выраженностью фиброза ПЖ и расширением главного панкреатического протока (р
Консервативное лечение хронического панкреатита в амбулаторных условиях
Хронический панкреатит объединяет гетерогенную группу заболеваний, характеризующихся структурными (морфологическими) и/или функциональными изменениями, несмотря на прекращение воздействия этиологического фактора, с дальнейшим прогрессированием поражения
Хронический панкреатит объединяет гетерогенную группу заболеваний, характеризующихся структурными (морфологическими) и/или функциональными изменениями, несмотря на прекращение воздействия этиологического фактора, с дальнейшим прогрессированием поражения поджелудочной железы и развитием экзокринной и/или эндокринной недостаточности. Морфологическим субстратом хронического панкреатита являются различной степени отек, воспаление и очаговые некрозы ацинарной ткани, развивающиеся на фоне стриктур по ходу панкреатических протоков, белковых пробок и кальцинатов в мелких протоках; псевдокисты, возникающие в период атаки острого панкреатита. Все это приводит к нарушению тока панкреатического сока, внутрипротоковой гипертензии, прогрессированию некроза ацинарной ткани с последующей атрофией ацинусов; интралобулярному и перилобулярному фиброзу поджелудочной железы. При потере 90% функционирующей паренхимы развивается панкреатическая недостаточность, обусловленная синдромом нарушенного переваривания пищи (maldigestion).
На поздних стадиях болезни при очевидной экзокринной недостаточности поджелудочной железы или развитии сахарного диабета диагностика хронического панкреатита не вызывает серьезных затруднений; определенные препятствия возникают на ранних стадиях болезни, когда превалируют функциональные изменения, проявляющиеся наиболее отчетливо в период действия этиологического фактора. Диагностика хронического панкреатита основывается на изучении факторов риска его развития, уточнении возможных этиологических факторов, оценке клинической картины заболевания. Нередко диагноз хронического панкреатита формируется после длительного наблюдения за больным, у которого имеются клинические признаки, позволяющие предположить наличие хронического панкреатита.
В качестве этиологических факторов хронического панкреатита наиболее часто выступают 2 основные причины — алкоголизм и желчнокаменная болезнь, причем 60–70% всех случаев хронического панкреатита обусловлены систематическим, длительным (6–18 лет) приемом алкоголя в дозе более 150 г в день до развития явных признаков заболевания (табл. 1). Частота выявления хронического панкреатита при аутопсии у интенсивно пьющих людей достигает 45–50%. Высокобелковая диета, курение усугубляют повреждающее действие алкоголя. Алкогользависимый панкреатит развивается преимущественно у мужчин и наиболее часто приходится на возраст 35–45 лет. Проведенный ретроспективный анализ историй болезни и последующее проспективное наблюдение за 372 больными позволили оценить течение хронического панкреатита при идиопатическом и алкогольном панкреатитах в зависимости от доз потребляемого алкоголя (менее 50 г/сут и более 50 г/сут) [1]. Показано, что в группе пациентов с алкогольным панкреатитом превалируют абдоминальные боли в начале заболевания. У больных из этой группы чаще развивались осложнения хронического панкреатита: фистулы, псевдокисты, абсцессы, обструктивная желтуха. Отмечено, что у пациентов с дебютом проявлений хронического панкреатита в возрасте старше 35 лет употребление алкоголя даже в небольших дозах (менее 50 г в день) приводит к раннему развитию заболевания, характеризующегося более частыми и интенсивными болями в животе, кальцификацией поджелудочной железы и наличием осложнений. Прием больших количеств алкоголя (50 и более граммов в день) ускоряет формирование кальцифицирующего панкреатита и повышает частоту фатального исхода при хроническом панкреатите.
Хронический панкреатит, развивающийся при желчнокаменной болезни (ЖКБ), холедохолитиазе, чаще встречается у женщин в возрасте 50–60 лет. Как правило, такие больные демонстрируют признаки метаболического синдрома: ожирение, гиперлипидемию, склонность к артериальной гипертензии, ИБС, нарушение толерантности углеводов, гиперурикемию и/или гиперурикозурию и т. д. У части пациентов с хроническим панкреатитом не удается уточнить этиологию заболевания — такой панкреатит относят к группе идиопатического панкреатита.
В зависимости от морфологических изменений в поджелудочной железе выделяют следующие формы хронического панкреатита (1989): кальцифицирующий, обструктивный, фиброзно-индуративный панкреатит, а также кисты и псевдокисты поджелудочной железы. Группу кальцифицирующих панкреатитов представляют алкогольный панкреатит, панкреатит, развивающийся при воздействии органических растворителей, некоторых химических соединений, лекарств, а также панкреатиты, начавшиеся вследствие гиперлипидемии, гиперкальциемии при гиперпаратиреозе, хронических вирусных инфекций (в том числе при хронической HCV- и HBV-инфекции), врожденных изменений протоков поджелудочной железы (удвоение панкреатического протока — pancreas divisum). Наследственный панкреатит с аутосомно-доминантным типом наследования с неполной пенетрацией также относится к группе кальцифицирующего панкреатита и развивается у детей 10–12 лет или в возрасте 30–40 лет. Он неотличим от обычных форм панкреатита, сопровождается рецидивирующими атаками абдоминальной боли, через 8–10 лет у 20% больных присоединяется сахарный диабет и у 15–20% пациентов — выраженная стеаторея. Отсутствие других этиологических факторов и указание на случаи панкреатита в семье делают обоснованным подозрение на наследственную форму хронического панкреатита.
Хронический обструктивный панкреатит развивается при обструкции главного панкреатического протока опухолью поджелудочной железы, воспалении дуоденального сосочка или его стенозе, дуодените вследствие болезни Крона, закрытой травме живота и хирургических операциях в пилородуоденальной зоне, наличии псевдокист поджелудочной железы, врожденной аномалии (pancreas divisum). Желчнокаменная болезнь и холедохолитиаз, дисфункция сфинктера Одди билиарного и панкреатического типов являются основными причинами формирования хронического обструктивного панкреатита.
Уточнение этиологического фактора в развитии хронического панкреатита позволяет более эффективно проводить профилактику и лечение, чем и обусловлено появление следующей классификации хронического панкреатита по этиологическому принципу, с учетом морфологического варианта:
Клинические признаки хронического панкреатита наиболее ярко представлены в период обострения (табл. 2).
 |
| Клинические признаки хронического панкреатита |
Нередко развитию болевой формы хронического панкреатита предшествует безболевая, латентная стадия различной продолжительности, маскирующаяся дискомфортом в эпигастрии, метеоризмом, неустойчивым стулом со склонностью к диарее с наличием непереваренной клетчатки в стуле или стеатореей. Повторные атаки болевой формы хронического панкреатита формируют панкреатическую недостаточность с преимущественным поражением экзокринной или эндокринной функций с развитием сахарного диабета 2 типа.
Болевой синдром — наиболее постоянный признак острого и хронического панкреатита — отмечается в 70–80% случаев и имеет типичные признаки: локализацию в эпигастрии, «опоясывающий» характер с иррадиацией в спину, провоцирующийся и быстро усиливающийся после приема пищи; боли облегчаются в положении сидя с наклоном вперед. Часто сопровождаются тошнотой, рвотой, лихорадкой. У 3–6% больных атаки болевого синдрома могут продолжаться несколько дней; у 70–90% эпизоды болевого синдрома перемежаются безболевым периодом. У части пациентов эквивалентом болей в эпигастрии могут быть боли в спине, иногда сопоставимые с интенсивностью болей в животе. В генезе болевого абдоминального синдрома при хроническом панкреатите основное внимание уделяется внутрипротоковой гипертензии за счет сохраняющейся секреции панкреатических ферментов воспаленной железой в условиях обструкции главных или мелких протоков. Другие факторы — воспаление внутрипанкреатических нервных стволов, перипанкреатическое воспаление с вовлечением двенадцатиперстной кишки, ретроперитонеального пространства, стенозом дистального отдела общего желчного протока — также играют определенную роль в развитии болевого синдрома. У 15% пациентов отмечается безболевая форма заболевания, проявляющаяся у 1/3 больных стеатореей, чаще всего это бывает при хроническом кальцифицирующем панкреатите алкогольной этиологии. Эндокринная функция наиболее чувствительна к воспалительному процессу при хроническом панкреатите и проявляется у 2/3 пациентов нарушением толерантности к глюкозе и сахарным диабетом. В большинстве случаев страдают обе — и экзокринная, и эндокринная — функции, признаки панкреатической недостаточности развиваются при потере 80–90% функционирующей паренхимы поджелудочной железы. В ряде случаев прогрессирующее снижение экзокринной функции приводит к снижению и даже полному исчезновению болевого синдрома.
Данные об эффекте абстиненции на течение алкогольного панкреатита противоречивы: у части пациентов отказ от алкоголя приводит к уменьшению выраженности и частоты болевых атак, признаков экзо- и эндокринной недостаточности, у других отмечается усиление болей через 12–24 ч абстиненции. Течение хронического панкреатита может быть непредсказуемым — прогрессирующим, несмотря на строгую абстиненцию, и довольно стабильным, независимо от того, что прием алкоголя продолжается. В одном наблюдении у 45% пациентов, злоупотребляющих алкоголем, не было клинических симптомов панкреатита, но имелись признаки хронического панкреатита при аутопсии.
Тошнота, рвота, анорексия и потеря массы тела часто отмечаются при хроническом панкреатите. Одной из основных причин снижения веса является уменьшение каллоража принимаемой пищи из-за усиления болей в животе, а также развивающийся синдром нарушенного всасывания вследствие maldigestion и некомпенсированный сахарный диабет. В течении хронического панкреатита синдром нарушенного всасывания с диареей и стеатореей развивается относительно поздно, как правило, на фоне менее 20% функционирующей ацинарной ткани. У части пациентов синдром нарушенного всасывания может протекать с оформленным стулом, что объясняется хорошей всасываемостью воды неизмененной слизистой тонкого кишечника и малым количеством воды в кале. Иногда пациенты отмечают жирные пятна на поверхности воды в унитазе, «жирный», блестящий кал, трудно смываемый со стенок унитаза, что обычно свидетельствует о панкреатической стеаторее. Абсорбция жирорастворимых витаминов A, D, E, K страдает мало, значительный дефицит их редко выявляется при панкреатической недостаточности.
Хотя нарушение толерантности глюкозы случается часто и при хроническом панкреатите проявляется рано, клинически очевидный сахарный диабет встречается относительно поздно. У большинства пациентов диагноз хронического панкреатита устанавливается задолго до развития гипергликемии, однако у части из них, страдающих безболевой формой панкреатита, сахарный диабет может быть первой и единственной манифестацией заболевания. Особенностью течения сахарного диабета при хроническом панкреатите следует считать редкое развитие кетоацидоза, диабетической нефропатии и хорошую переносимость уровня гипергликемии до 200 мг/дл, однако при длительном течении диабета ретинопатия и полинейропатия встречаются с одинаковой для разных вариантов диабета частотой.
Другие клинические проявления хронического панкреатита включают желтуху, обусловленную сдавлением общего желчного протока увеличенной головкой поджелудочной железы, асцит или плевральный выпот в связи с подтеканием панкреатического секрета из разрушенных протоков; псевдокисты. Редко встречаются атипичные варианты хронического панкреатита с развитием липонекрозов подкожной клетчатки или «химического» полиартрита мелких суставов кистей.
Уровень смертности при хроническом панкреатите достигает 50% при 20–25-летнем сроке заболевания. 15–20% пациентов погибают от осложнений, связанных с обострениями панкреатита, другие варианты смерти обусловлены травмой, нарушением питания, инфекцией, курением, которые часто отмечаются у больных хроническим панкреатитом.
Осложнения хронического панкреатита включают синдром нарушенного всасывания, сахарный диабет, псевдокисты, тромбоз портальной или селезеночной вены, стеноз привратника, обструкцию общего желчного протока и опухоль. Аденокарцинома поджелудочной железы развивается в 4% случаев у лиц с более чем 20-летним анамнезом хронического панкреатита.
Диагностика хронического панкреатита достаточно сложна и базируется на 3 основных признаках: характерном анамнезе (болевые приступы, злоупотребление алкоголем), наличии экзокринной и/или эндокринной недостаточности и выявлении структурных изменений поджелудочной железы.
Уровень амилазы, липазы сыворотки чаще остается нормальным или сниженным в период атаки панкреатита, что объясняется уменьшением числа ацинарных клеток, продуцирующих эти ферменты. При сочетании алкогольного панкреатита с алкогольной болезнью печени могут быть выявлены нарушенные функциональные печеночные тесты. В 5–10% случаев хронического панкреатита имеются признаки компрессии внутрипанкреатической части желчного протока, обусловленные отеком или фиброзом головки поджелудочной железы, что сопровождается желтухой, повышением уровня прямого билирубина и щелочной фосфатазы сыворотки.
Нарушение толерантности глюкозы развивается у 2/3 пациентов, сахарный диабет — у 30% больных хроническим панкреатитом.
Экзокринная недостаточность становится явной и легко обнаруживается при развитии синдрома нарушенного всасывания, при котором жир в кале можно определить качественным (окраска по Судану) или количественным методом. Секреторная недостаточность на более ранних этапах выявляется с помощью панкреатических функциональных тестов.
В последние годы в клиническую практику для диагностики хронического панкреатита внедряется иммуноферментный метод определения эластазы-1 в сыворотке крови и кале больных, позволяющий оценить внешнесекреторную функцию поджелудочной железы [4].
Инструментальные данные для подтверждения предположения о наличии хронического панкреатита можно считать довольно информативными. Используются ультразвуковое исследование органов брюшной полости; эндоскопическое ультразвуковое исследование, спиральная компьютерная и магнитно-резонансная томография поджелудочной железы. ЭРХПГ позволяет выявить стеноз протока, локализацию обструкции, структурные изменения мелких протоков, внутрипротоковые кальцинаты и белковые пробки, однако при этом имеется высокий риск развития острого панкреатита [5, 6].
Целью лечения хронического панкреатита можно считать решение нескольких задач: исключение провоцирующих факторов (алкоголь, лекарства, обструкция); облегчение боли; коррекция экзо- и эндокринной недостаточности; лечение сопутствующих расстройств. Основными целями консервативного лечения являются прекращение или замедление прогрессирования хронического панкреатита и борьба с его осложнениями. В зависимости от степени выраженности болевого абдоминального синдрома, используется поэтапное лечение хронического панкреатита, включающее следующие составляющие (модификация Ihse et al.,1993).
При слабом болевом синдроме успеха можно достичь благодаря строгой диете, дробному (каждые 3 ч) приему пищи и ограничению жира до 60 г в день, что способствует снижению панкреатической секреции при низкокалорийной диете. Учитывая тот факт, что основной причиной боли является внутрипротоковая гипертензия, целесообразно использовать лекарства, блокирующие стимулированную панкреатическую секрецию. В норме высвобождение холецистокинина — основного стимулятора экзогенной функции поджелудочной железы — регулируется холецистокинин-релизинг пептидом в проксимальном отделе тонкой кишки, который чувствителен к трипсину и активен в просвете кишки. Назначением панкреатических ферментов (мезим форте, панкреатина, панзинорма, панцитрата ликреазы) обеспечивается значительное облегчение болевого синдрома у части больных за счет включения механизма обратной связи: повышение уровня протеаз в просвете двенадцатиперстной кишки снижает высвобождение и синтез гастроинтестинальных гормонов (холецистокинина), что приводит к снижению стимуляции экзокринной функции поджелудочной железы, уменьшению внутрипротокового и тканевого давления и облегчению боли [7, 8].
Следует помнить о возможности инактивации экзогенных пищеварительных ферментов кислотой желудка и панкреатическими протеазами. Для предотвращения данного эффекта широко используется комбинация ферментов (панкреатин, креон, мезим, панзинорм, фестал, пензитал, энзистал) с H2-гистаминоблокаторами (фамотидин, ранитидин, циметидин, низатидин). Дозы ферментных препаратов для купирования боли должны быть адекватны; в плацебо-контролируемом двойным слепым методом исследовании панкреолипаза в дозе 6 таблеток 4 раза в день в течение 1 мес значительно снижала боль у 75% больных с умеренным и выраженным панкреатитом. Панкреатические ферменты в капсулированной форме, содержащей кислотоустойчивые мини-микросферы (креон), являются в настоящее время препаратами первого выбора в лечении абдоминальной боли в экзокринной недостаточности поджелудочной железы. Микрогранулированные лекарственные формы (креон 10000 или 25000) характеризуются быстрым (через 45 мин) высвобождением более 90% ферментов при pH дуоденального и тонкокишечного содержимого 5,5 и выше. При очень низких значениях pH в желудочно-кишечном тракте используется адъювантная терапия H2-антагонистами или ингибиторами протонной помпы (ланзопразол, омепразол, пантопразол, рабепрозол). Кроме того, показано, что ферментозаместительная терапия улучшает транзит пищи по желудочно-кишечному тракту, воздействуя на моторную функцию ЖКТ и способствуя тем самым снижению нарушений всасывания. Ферменты поджелудочной железы назначают во всех случаях хронического панкреатита для коррекции экзокринной функции поджелудочной железы. Прием этих препаратов уменьшает растяжение кишечника и диарею, обусловленную нарушением всасывания жиров, в связи с чем уменьшаются боли. Ферментные препараты снижают интенсивность болей при хроническом панкреатите средней тяжести, особенно у женщин с обструктивным панкреатитом; на фоне pancreas divisum. У мужчин с алкогольным кальцифицирующим панкреатитом эти препараты значительно менее эффективны. Для купирования стеатореи при хроническом панкреатите показаны препараты с высоким содержанием липазы, покрытые оболочкой; для купирования болей — препараты с высоким содержанием протеаз без оболочки.
При отсутствии эффекта ферментнозаместительной терапии в сочетании с H2-гистаминоблокаторами необходимо назначение анальгетиков, с этой целью могут использоваться также парацетамол (далерон, проходол, эффералган), нестероидные противовоспалительные препараты: диклофенак (апо-дикло, вольтарен, диклофенак, ортофен), ибупрофен (апо-ибупрофен, ибупрофен, ибуфен, солпафлекс), пироксикам (пироксикам, пироксифер, фельден, эразон), целекоксиб (целебрекс), лорноксикам (ксефокам), мелоксикам (мелоксикам, мовалис), нимесулид (месулид, найз, никулид), напроксен (апо-напроксен, налгезин, напроксен). Для купирования болевого синдрома при хроническом панкреатите назначают октреотид (сандостатин). Являясь мощным ингибитором нейроэндокринных гормонов желудочно-кишечного тракта, сандостатин угнетает экзогенностимулированную и эндогенностимулированную экзокринную секрецию поджелудочной железы путем прямого действия на экзокринную ткань и снижает высвобождение секретина и холецистокинина. В многоцентровом исследовании сандостатин в дозе 200 мкг подкожно 3 раза в день в течение 4 нед уменьшал выраженность болевого синдрома у 65% пациентов с хроническим панкреатитом. Препарат также эффективен в лечении псевдокист, панкреатического асцита и плеврита. Мы используем небольшие дозы: 50–100 мкг подкожно 2 раза в день в течение 1 нед для лечения болевой формы хронического панкреатита.
При сохранении болевого синдрома необходимо провести ЭРПХГ для морфологического уточнения характера поражения протоков, исключения дисфункции сфинктера Одди. В этом случае обсуждается возможность использования инвазивных методов лечения: эндоскопического дренирования и шунтирования, блокады солнечного сплетения стероидами, панкреатикоеюностомия и панкреатическая резекция.
Наибольшие трудности связаны с лечением дисфункции сфинктера Одди, одной из причин развития хронического панкреатита, трудной для диагностики. При дисфункции сфинктера Одди отмечается повышенная чувствительность стенки панкреатического и желчного протоков к изменениям объема и давления. Необходимо исключить лекарственные препараты, обладающие холеретическим действием (желчные кислоты, в том числе в составе ферментных препаратов — фестал, энзистал и т. д.; отвары желчегонных трав, синтетические желчегонные средства). Для снятия спазма гладкой мускулатуры сфинктеров Одди и пузырного протока используются нитраты: нитроглицерин — для быстрого купирования болей, нитросорбит — для курсового лечения (под контролем переносимости препаратов).
Миотропные спазмолитики (бендазол, бенциклан, дротаверин, мебеверин, папаверин) снижают тонус и двигательную активность гладкой мускулатуры. Основными представителями данной группы являются папаверин, дротаверин (но-шпа, но-шпа форте, веро-дротаверин, спазмол, спаковин), бенциклан (галидор).
Наиболее эффективным миотропным спазмолитиком является дюспаталин (мебеверин) — мышечнотропный, антиспастический препарат, оказывающий прямое действие на гладкую мускулатуру. Избирательно действуя в отношении сфинктера Одди, он оказывается в 20–40 раз эффективнее папаверина в том, что касается способности релаксировать сфинктер Одди.
Важно то, что дюспаталин не влияет на холинергическую систему и поэтому не вызывает таких побочных эффектов, как сухость во рту, нарушение зрения, тахикардия, задержка мочи, запор и слабость. Он активно метаболизируется при прохождении через печень, все метаболиты быстро выводятся с мочой. Полная экскреция препарата происходит в течение 24 ч после приема однократной дозы, в результате он не накапливается в организме, даже пожилым пациентам не требуется коррекция дозы. Дюспаталин назначают по 1 капсуле (200 мг) 2 раза в день, лучше принимать его за 20 мин до еды.
Другим миотропным спазмолитиком, обладающим селективными свойствами, является гимекромон (одестон) — фенольное производное кумарина, не имеющее свойств антикоагулянтов и оказывающее выраженное спазмолитическое и желчегонное действие. Гимекромон — синтетический аналог умбеллиферона, обнаруженного в плодах аниса и фенхеля, которые применялись как спазмолитические средства. Препарат обеспечивает тот или иной эффект в зависимости от особенностей его действия на различных уровнях билиарного тракта. Одестон вызывает дилатацию желчного пузыря, снижает внутрипротоковое давление и, таким образом, является антагонистом холецистокинина. На уровне сфинктера Одди он действует синергично с холецистокинином, снижает базальное давление и увеличивает длительность открытия сфинктера Одди, увеличивая тем самым пассаж желчи по желчным путям. Будучи высокоселективным спазмолитиком, одестон обладает также желчегонными свойствами. Холеретический его эффект обусловлен ускорением и увеличением поступления желчи в тонкую кишку. Увеличение поступления желчи в просвет двенадцатиперстной кишки способствует улучшению процессов пищеварения, активизации кишечной перистальтики и нормализации стула.
Одестон назначают по 400 мг (2 таблетки) 3 раза в день за 30 мин до приема пищи, что обеспечивает относительно постоянную концентрацию препарата в сыворотке, превышающую 1,0 мкг/мл. Продолжительность лечения индивидуальная — от 1 до 3 нед. Одестон малотоксичен, переносимость его обычно хорошая.
При отсутствии эффекта от консервативной терапии дисфункции сфинктера Одди и наличии данных о его стенозе восстановление проходимости сфинктера Одди проводят оперативным путем (сфинктеротомия).
Заместительная терапия экзокринной панкреатической недостаточности в исходе хронического панкреатита проводится при наличии стеатореи более 15 г жира в сутки, прогрессирующей потере массы тела и диспепсических нарушениях. Разовая доза ферментов должна содержать не менее 20 000–40 000 ед липазы, поэтому его назначают по 2–4 капсулы при основных приемах пищи и по 1–2 капсулы при дополнительных приемах небольшого количества пищи. При клинически выраженной панкреатической недостаточности часто не удается устранить стеаторею полностью. Увеличение массы тела, нормализация стула, снижение метеоризма свидетельствуют об адекватности подобранной дозы пищеварительных ферментов. Неэффективность заместительной терапии требует исключения других причин синдрома нарушенного всасывания — болезни Крона, целиакии, тиреотоксикоза. С целью коррекции питательной недостаточности назначают среднецепочечные триглицериды (трисорбон) и жирорастворимые витамины A, D, E, K.
По вопросам литературы обращайтесь в редакцию.
Т. Н. Лопаткина, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва