Скрининг сатурации у новорожденных что это
Тактика педиатра при критических врожденных пороках сердца у новорожденных детей
В структуре младенческой смертности аномалии развития занимают третье место, и половину случаев летальности определяют врожденные пороки сердца (ВПС).

Масштаб проблемы подчеркивает высокая частота ВПС: в разных странах этот показатель варьирует от 0,6% до 2,4% в год у детей, родившихся живыми, с учетом внутриутробной гибели плода и ранних выкидышей общая частота ВПС составляет 7,3% [1, 3].
Пренатальная диагностика. С целью снижения младенческой смертности используется пренатальный ультразвуковой скрининг, позволяющий выявить большинство ВПС до 24-й недели гестации. При подозрении на порок проводится прицельное УЗИ плода на аппарате экспертного класса. Основная задача — предотвратить рождение детей с неоперабельными пороками — синдромом гипоплазии левого сердца (СГЛС), гипертрофической кардиомиопатией с признаками органического поражения миокарда, множественными пороками развития плода. Пренатальный консилиум должен предложить прерывание беременности только при условии точной диагностики некурабельного порока [2, 4].
Учитывая высокую летальность новорожденных детей и младенцев от ВПС, для данной возрастной группы пациентов создана классификация, основанная на определении ведущего клинического синдрома, эффективности терапевтической тактики и определяющая сроки хирургического вмешательства [3, 4].
Синдромальная классификация ВПС у новорожденных и детей первого года жизни (Шарыкин А. С., 2005)
Данные состояния могут сочетаться, усугубляя тяжесть состояния детей, 50% этих детей требуют хирургического или терапевтического вмешательства на первом году жизни.
Гемодинамика. Критические пороки характеризуются дуктус-зависимым легочным или системным кровообращением, их объединяет внезапное резкое ухудшение внешне благополучного при рождении ребенка, связанное с уменьшением кровотока через артериальный проток. Дуктус-зависимое легочное кровообращение при ТМС, атрезии (или критическом стенозе легочной артерии) с интактной МЖП обеспечивает кровоток через проток в малый круг кровообращения, и при его ограничении или прекращении развивается тяжелая артериальная гипоксемия, острая гипоксия органов и тканей.
Клиника ВПС с легочным дуктус-зависимым кровообращением
Анатомия одного из самых частых критических пороков — транспозиции магистральных сосудов — заключается в неправильном отхождении аорты — из правого и легочной артерии — из левого желудочка, что способствует разобщению кругов кровообращения: в системе малого круга циркулирует артериальная кровь, в системе большого круга — венозная.
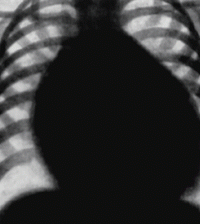
Естественное течение порока очень тяжелое. Ребенок рождается в срок с нормальной массой тела, но в первые часы после рождения появляется диффузный цианоз кожи, особенно выраженный на периферии — цианоз лица, кистей, стоп. Состояние крайней степени тяжести обусловлено тяжелой артериальной гипоксемией. Одышка, тахикардия появляются через 1–2 часа после пережатия пуповины. Отмечается прогрессирующее ухудшение состояния. Ребенок вялый, заторможенный, легко охлаждается.
При закрытии фетальных коммуникаций острая гипоксия приводит к развитию полиорганной недостаточности и гибели новорожденного в течение нескольких часов. При выживании ребенка в течение нескольких недель нарастает сердечная недостаточность. Быстро развивается тяжелая гипотрофия. Необходимо отметить, что в случае адекватной тактики наблюдения и лечения, а также своевременной — до месяца — хирургической коррекции порока у ребенка (так как только в этот период возможна радикальная коррекция методом артериального переключения магистральных сосудов) полностью восстанавливается физиологическая гемодинамика, темпы роста и развития, физическая и в последующем социальная адаптация. Если коррекция порока проводится позже — исходы менее благоприятны.
Диагностические критерии ТМС включают:
Схема обследования новорожденного ребенка с подозрением на ВПС:
Кроме того, наблюдение ребенка предполагает мониторинг газов крови (рО2, рСО2), сатурации кислорода (SatO2) с помощью пульсоксиметрии и метаболических показателей — рН, ВЕ. Газообмен в легких не нарушен, если РаО2 находится в пределах 60–80 мм рт. ст., SаО2 — 96–98%. Артериальная гипоксемия развивается при РаО2 менее 60 мм рт. ст. и уровне насыщения гемоглобина 85–75%.
Задачи педиатра (неонатолога):
Транспортировка в кардиохирургический центр оптимальна в течение первых недель, первого месяца жизни. Предварительно необходимо сообщить в кардиохирургический стационар о больном с врожденным пороком сердца с дуктус-зависимым кровообращением. Период наблюдения до момента перевода и транспортировка в центр проводится на фоне инфузии препарата простагландина Е (Алпростан, Вазапростан).
Клиника ВПС с системным дуктус-зависимым кровообращением (группа пороков включает СГЛС, выраженную коарктацию аорты, перерыв дуги аорты). Наиболее позитивным примером пороков данной группы является выраженная предуктальная коарктация, занимающая от 1% до 10% среди критических ВПС. При данном пороке резко ограничен или полностью отсутствует кровоток из проксимальной ее части (ниже места отхождения артериального протока) к дистальной. Нарушение гемодинамики, соответственно, заключается в том, что в нисходящую аорту (в большой круг) небольшой объем крови поступает только из легочной артерии через артериальный проток. При закрывающемся артериальном протоке остро развивается гипоперфузия органов и тканей и полиорганная недостаточность. Клиника: доношенный новорожденный с резким ухудшением в первые несколько дней жизни — адинамия, холодные конечности, симптом гипоперфузии периферических тканей («белого пятна»), пульс малого наполнения, высокое АД на руках и низкое или не определяется на ногах, одышка, тахикардия, олигоурия с нарастающей азотемией, гепатомегалия с ростом трансаминаз, некротизирующий энтероколит.
Рассмотрим диагностику и оптимальную терапевтическую тактику в отношении пациента с выраженной коарктацией аорты на конкретном клиническом примере.
Из анамнеза: состояние ухудшилось внезапно на 14-е сутки жизни, когда ребенок стал вялым, появилась выраженная одышка, госпитализирован машиной «скорой помощи». Мальчик от второй, нормально протекавшей беременности, срочных родов с массой 3220 г, оценкой по шкале Апгар 5 (9) баллов. Выписан из родильного дома в удовлетворительном состоянии, находился на естественном вскармливании. Периодически отмечались эпизоды беспокойства, метеоризм.
При поступлении ребенок интубирован, проводится ИВЛ с низким содержанием кислорода во вдыхаемой смеси. Обследование в стационаре выявило кардиомегалию (кардиоторакальный индекс — 80%), обеднение легочного рисунка, по данным электрокардиографии — сочетанную перегрузку обоих желудочков. Эхокардиография установила гипоплазию аорты ниже места отхождения левой подключичной артерии (и выше локализации артериального протока), в типичном для артериального протока месте — точечный кровоток (закрывающийся артериальный проток). Через 6 часов состояние ребенка ухудшилось: развилась олигурия, отмечен рост креатинина до 213 ммоль/л, трансаминаз в 4–5 раз от уровня лабораторной нормы. Гуморальная активность не установлена.
Обоснование диагноза и тактики: учитывая клинику выраженной дыхательной и в последующем — полиорганной недостаточности в сочетании с кардиомегалией, системной артериальной гипертензией, почечной и печеночной недостаточностью, по клиническим данным следовало заподозрить коарктацию аорты. Внезапное ухудшение состояния ребенка в отсутствие признаков инфекции позволяет думать о дуктус-зависимом системном кровообращении, с учетом данных визуализации сердца и сосудов имеет место диагноз: «ВПС, предуктальная коарктация аорты, артериальная гипертензия 2 ст., вторичная, полиорганная недостаточность».
С момента подтверждения диагноза по данным ЭхоКГ необходимо начать терапию Вазапростаном 0,02 (с увеличением дозы до 0,05 мкг/кг/мин) с целью восстановления кровотока через артериальный проток. При данном пороке шунт направлен из легочной артерии в нисходящую аорту, и только эта небольшая порция крови обеспечивает весь большой круг кровообращения.
Расчет дозы и методика введения. Вес ребенка при поступлении — 3220 г. В 1 ампуле содержится 20 мкг Вазапростана. В данном случае введение препарата начали с дозы 0,02 мкг/кг/мин, то есть потребовалось 0,02 ´ 3,2 = 0,064 мкг/кг/мин. За час доза препарата составила 0,064 ´ 60 = 3,8 мкг/час. Для введения препарата 1 ампулу (20 мкг Вазапростана) развели в 20 мл физиологического р-ра (в 1 мл — 1 мкг). При отсутствии эффекта в течение двух часов доза была увеличена до 0,04–0,05 мкг/кг/мин: соответственно скорость введения препарата увеличилась до 7,6–9,5 мл/час. В данном случае был очень показателен контроль терапии — через 6 часов инфузии отмечено улучшение состояния, усиление дующего систолического шума во втором межреберье слева, увеличение размеров потока через артериальный проток по данным ЭхоКГ. Переведен на поддерживающую дозу Вазапростана — 0,01 и затем 0,005 мкг/кг/мин, которая сохранялась в течение всего периода наблюдения в педиатрическом стационаре и в ходе транспортировки при переводе в кардиохирургический стационар. В данном клиническом случае полностью отойти от ИВЛ было невозможно (учитывая тяжесть дыхательной недостаточности), на 5-й день госпитализации (19-е сутки жизни) ребенок на фоне терапии переведен в клинику им. Мешалкина, где была успешно проведена коррекция порока — формирование аортолегочного шунта.
В случаях развития сердечной недостаточности у новорожденных при пороках, сопровождающихся массивным сбросом крови в малый круг кровообращения, применяется тот же принцип мониторинга основных показателей и симптоматическая терапия:
При появлении симптомов перегрузки малого круга (аускультативно — усиление, расщепление 2-го тона на легочной артерии, на ЭхоКГ — увеличение давления в легочной артерии более 30 мм рт. ст. после шести суток жизни), а также признаков нарушения диастолической функции сердца рекомендуется применять препараты из группы ингибиторов ангиотензин-превращающего фермента (иАПФ). Используется Капотен (каптоприл) в дозе 0,5–1 мг/кг при условии контроля системного АД. Терапевтическое действие иАПФ связано со снижением периферического сопротивления сосудов и частичным депонированием крови, в результате чего уменьшается объем крови, возвращаемой в правые отделы сердца. Соответственно уменьшается объем шунта и нагрузка на левые камеры и сосуды малого круга. Кроме того, известно, что иАПФ являются ингибитором апоптоза, стимулированного гипоксией, что объясняет ангио- и кардиопротективный эффект препаратов.
Таким образом, тактика педиатра, включающая раннюю диагностику критических ВПС и терапию, управляющую внутрисердечной, центральной и периферической гемодинамикой, а также по возможности ранняя координация действий с кардиохирургическим центром способны существенно улучшить прогноз больных и уменьшить показатели младенческой смертности.
Литература
Е. Ю. Емельянчик*, доктор медицинских наук, профессор
Д. Б. Дробот*, доктор медицинских наук, профессор
Е. П. Кириллова*, кандидат медицинских наук, доцент
В. А. Сакович*, доктор медицинских наук, профессор
Е. В. Басалова**
А. Ю. Черемисина*
*ГОУ ВПО Красноярский ГМУ им. профессора В. Ф. Войно-Ясенецкого,
**Краевая клиническая детская больница, Красноярск
Скрининг сатурации у новорожденных что это
Пульсоксиметрия, как скрининговый метод выявления критических врожденных пороков сердца у новорожденных
Предпосылки для обобщения научных данных о критических врожденных пороках сердца
Европейский офис Всемирной организации здравоохранения (ВОЗ) готовит к публикации новое практическое руководство для врачей первичного звена медико-санитарной помощи детям и подросткам в Европе. С целю включения в данное руководство, специалисты Барселонского института глобального здравоохранения (Испания) проанализировали имеющиеся научные данные об эффективности пульсоксиметрии в выявлении критических врожденных пороков сердца у новорожденных.
Определение критических врожденных пороках сердца
Критический врожденный порок сердца (critical congenital heart defects, CCHDs) определяется, как любое поражение сердца, от которого младенцы или умирают, или, для предотвращения смерти или необратимых повреждений внутренних органов, нуждаются в хирургическом вмешательстве в течение первых 28 дней жизни. Ранее выявление CCHDs способствует улучшению сердечно-легочных и неврологических исходов. В связи с тем, что многие CCHDs в первые часы жизни ребенка протекают бессимптомно, скрининг новорожденных на CCHDs обеспечит быструю диагностику и поможет предотвратить летальный исход.
Согласно опубликованным данным, рутинное предродовое ультразвуковое исследование (УЗИ) и клинический осмотр новорожденного приводят к отправке домой до 30% случаев CCHDs до постановки диагноза, при этом смертность достигает 50%. В ряде исследований сообщалось, что добавление антенатальной пульсоксиметрии (ПО) может помочь выявлять такие CCHDs, как синдром гипоплазии левого сердца, атрезия легких, тетрада Фалло, тотальный аномальный дренаж легочных вен, транспозиция магистральных артерий, атрезия трехстворчатого клапана и клапана аорты.
Пульсоксиметрия в диагностике критических врожденных пороках сердца
В Кокрейновском обзоре, оценивалась диагностическая точность скрининга с ПО по сравнению с эхокардиографией или клиническим наблюдением в первые 28 дней жизни для выявления CCHDs у 457 202 бессимптомных новорожденных. Было показано, что ПО для обнаружения CCHDs имело чувствительность 76.3% и специфичность на уровне 99,9%.
Основные результаты пилотного мультицентрового исследования в Англии показали, что среди 32 836 обследованных новорожденных было 239 новорожденных (0,73%) с показателем порогового значения ПО ≤95%, из которых восемь были случаями CCHDs. Авторы сделали вывод, что пилотный проект продемонстрировал положительный эффект внедрение скрининга ПО для раннего выявления CCHDs.
Сроки проведения пульсоксиметрии с целью диагностики критических врожденных пороках сердца
Испанское национальное неонатальное общество считает, что: “Сроки скрининга влияют на его чувствительность, причем чем раньше он проводится, тем выше чувствительность”, при этом уровень доказательств оценивается как «A». Действительно, в Великобритании ранний скрининг около 26 000 новорожденных привел к положительному показателю скрининга в 0,8%, при этом было выявлено девять случаев CCHDs. Частота ложноположительных результатов была значительно ниже среди новорожденных, обследованных после 24 часов жизни, по сравнению с новорожденными, обследованными в течение первых 24 часов жизни.
Таким образом, авторы настоящего обзора делают выводы, что ранняя диагностика критических врожденных пороков сердца с помощью пульсоксиметрии является полезной и экономически эффективной. Ранний скрининг, ведущий к раннему выявлению CCHDs, позволяет своевременно проводить соответствующее медицинское вмешательство и, следовательно, снижает риск возникновения тяжелых осложнений и летальных исходов.
Источник: Jullien S. Newborn pulse oximetry screening for critical congenital heart defects. BMC Pediatr. 2021 Sep 8;21(Suppl 1):305. doi: 10.1186/s12887-021-02520-7. PMID: 34496777; PMCID: PMC8424789.
Критические врожденные пороки сердца у новорожденных
Общая информация
Краткое описание
Название протокола: Критические врожденные пороки сердца у новорожденных
Критический порок сердца – ВПС, сопровождающийся развитием критического состояния [3].
Характерная особенность критических ВПС – отсутствие или слабая выраженность компенсаторных реакций. Если не проводится экстренная терапия (например введение простогландинов) или не выполняется оперативная коррекция, ребенок погибает в течение 1-ых дней или недель жизни [8].
Критическое состояние – это состояние, сопровождающееся острым дефицитом сердечного выброса, быстрым прогрессированием сердечно-сосудистой недостаточности, тканевой гипоксией с развитием декомпенсированного метаболического ацидоза [4].
Код протокола:
Сокращения, используемы в протоколе:
| АВСД – атриовентрикулярный септальный дефект АД – артериальное давление АК – аортальный клапан АТК – атрезия трикуспидального клапана ВИЧ – вирус иммунодефицита человека ВПС – врожденный порок сердца ДМЖП – дефект межжелудочковой перегородки ДМПП – дефект межпредсердной перегородки ИФА – иммуноферментный анализ МКК – малый круг кровообращения ОАП – открытый артериальный проток ООО – открытое овальное окно ПЦР – полимеразная цепная реакция СГЛС – синдром гипоплазии левого сердца СДР – синдром дыхательных расстройств СЛА – стеноз легочной артерии ТАДЛВ – тотальный аномальный дренаж легочных вен ТМС – транспозиция магистральных сосудов ТФ – Тетрада Фалло ЭКГ – электрокардиография |
Дата разработки/пересмотра протокола: 2015 год.
Категория пациентов: новорожденные, дети.
Пользователи протокола: детские кардиологи, неонатологи, детские кардиохирурги, детские анестезиологи-реаниматологи, педиатры, врачи общей практики.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Клиническая классификация:
Клиническая классификация врожденных пороков сердца у новорожденных и грудных детей:
Анатомо-физиологическая классификация ВПС:
· ВПС с артериовенозным сбросом, бледного типа, сопровождающиеся перегрузкой малого круга кровообращения (ДМЖП, ДМПП, ОАП, АВСД);
· Пороки с веноартериальным сбросом – пороки синего типа (тетрада Фалло (ТФ), атрезия трикуспидального клапана (АТК));
· ВПС, сопровождающий обструкцией кровотоку (стеноз аортального клапана (САК), стеноз легочной артерии (СЛА), коарктация аорты).
Синдромальная классификация ВПС у новорожденных и детей первого года жизни [3,4]:
· ВПС, сопровождающиеся артериальной гипоксемией (хроническая гипоксемия, гипоксемический приступ, гипоксемический статус);
· ВПС, проявляющиеся преимущественно сердечной недостаточностью (острая сердечная недостаточность, застойная сердечная недостаточность, кардиогенный шок);
· ВПС, проявляющееся нарушениями ритма сердца (постоянная тахикардия, полная атриовентрикулярная блокада, пароксизмальная тахикардия).
У новорожденных и детей первого года жизни целесообразно выделять состояния, зависящие от функционирования фетальных коммуникаций – ВПС, при которых гемодинамика, обеспечение адекватного кровотока, оксигенация тканей возможны только при сохранении функционирующих фетальных коммуникаций (открытое овальное окно (ООО), ОАП, аранциев проток) [1,2,3]. При естественном закрытии указанных коммуникаций возникает критическая ситуация, которая реализуется либо через синдром прогрессирующей артериальной гипоксемии, либо через синдром сердечной недостаточности.
Классификация критических состояний:
Классификацией, объединяющей патофизиологические аспекты и клинические проявления ВПС, является схема прогноза критических состояний, предложенная Л.М. Миролюбовым [3].
Рисунок № 1: Прогноз критических состояний при ВПС у новорожденных
Классификации ВПС по возможности радикальной коррекции (Turley K. et al., 1980):
1 группа – пороки, при которых возможна только радикальная коррекция: стеноз аорты, стеноз лёгочной артерии, ТАДЛВ, трёхпредсердное сердце, коарктация аорты, открытый артериальный проток, дефект аортолёгочной перегородки, ДМПП, стеноз или недостаточность митрального клапана;
3 группа – пороки, при которых в грудном возрасте возможны только паллиативные операции: единственный желудочек сердца, некоторые варианты отхождения магистральных сосудов от правого или левого желудочка со стенозом лёгочной артерии, атрезия трёхстворчатого клапана, атрезия митрального клапана, гипоплазия желудочков сердца.
Этиология и патогенез
Клиническая картина
Cимптомы, течение
Диагностические критерии постановки диагноза:
Сроки манифестации клинических проявлений ВПС напрямую зависят от гемодинамики порока и физиологических изменений кровотока, происходящих в организме ребенка после рождения, и представлены в таблице № 1 (приложение № 1) [3,6].
Диагностика
Перечень основных и дополнительных диагностических мероприятий:
Основные (обязательные) диагностические обследования, проводимые на амбулаторном уровне:
· физикальный осмотр;
· определение наличия цианоза;
· подсчет ЧД в минуту;
· подсчет ЧСС в минуту;
Дополнительные диагностические обследования, проводимые на амбулаторном уровне (в счучае обращения в поликлинику):
· пульсоксиметрия;
· ЭКГ.
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: (роды на дому, ранняя выписка из родильного дома)
Госпитализация проводится в экстренном порядке без проведения исследований в кардиохирургический центр (в случае нахождения в учреждении родовспоможения):
· ОАК;
· ОАМ;
· Биохимия крови: АЛТ, АСТ, билирубин, мочевина, креатинин, общий белок, СРБ;
· ЭКГ;
· Рентгенография органов грудной клетки;
· ЭХОКГ;
· кал на патологическую флору;
· ИФА на маркеры гепатитов В и С;
· ИФА на ВИЧ.
Основные (обязательные) диагностические обследования, проводимые на стационарном уровне (родильный дом, перинатальный центр):
· измерение артериального давления на руках и ногах с определением градиента давления между верхними и нижними конечностями;
· суточный баланс жидкости;
· пульсоксиметрия (с определением сатурации кислорода на всех конечностях и расчетом градиента между правой руками и ногами) – в качестве скрининга всем новорожденным;
· ОАК;
· ОАМ;
· биохимический анализ крови: АЛТ, АСТ, билирубин, мочевина, креатинин, общий белок, СРБ;
· коагулограмма;
· определение КЩС крови;
· ЭКГ;
· рентгенография органов грудной клетки;
· ЭХОКГ;
Дополнительные диагностические обследования, проводимые на стационарном уровне (родильный дом, перинатальный центр):
· микробиологическое исследование (мазок из зева, носа, пупочной раны и т.д.);
· кал на патологическую флору;
· Кровь на стерильность.
· ИФА на ВУИ (вирус простого герпеса, цитомегаловирус, токсоплазмоз, хламидии, микоплазмы) с определением Ig G, Ig M;
· ПЦР на ВУИ (вирус простого герпеса, цитомегаловирус, токсоплазмоз, хламидии, микоплазмы) с определением Ig G, Ig M
· НСГ;
· УЗИ органов брюшной полости;
· УЗИ плевральной полости;
· Осмотр глазного дна.
· КТ-ангиография сердца и магистральных сосудов.
Кратность проведения исследований и сроки проведения представлены в таблице № 2.
Таблица № 2. Основные мероприятия/дополнительные мероприятия:
| № | вид исследования | кратность проведения | сроки проведения |
| Основные исследования | |||
| 1. | Ежедневный осмотр | каждый день | в утренние часы, повторно при изменении состояния |
| 2. | контроль температуры тела | каждый день | постоянно (мониторирование жизненно-важных параметров) |
| 3. | контроль АД | каждый день | постоянно (мониторирование жизненно-важных параметров) |
| 4. | контроль Sat O2 | каждый день | постоянно (мониторирование жизненно-важных параметров) |
| 5. | контроль диуреза | ежедневно | в течение суток |
| 5. | ОАК | 7 раз | с интервалом 2-3 дня, дополнительно при изменении состояния, либо в случае необходимости контроля выявленных изменений; |
| 6. | ОАМ | 7 раз | с интервалом 2-3 дня, дополнительно при изменении состояния, либо в случае необходимости контроля выявленных изменений; |
| 7. | Биохимия крови (определение уровня белка, электролитов, АЛТ, АСТ, билирубин общий и прямой, мочевина, креатинин, глюкоза) | 4 раза | с интервалом 3-4 дня, дополнительно при изменении состояния, либо в случае необходимости контроля выявленных изменений с интервалом 5 дней; |
| 8. | КЩС крови | ежедневно | в случае необходимости несколько раз в день в зависимости от состояния, проведения терапии кардиотоническими препаратами |
| 9. | определение коагуляционного статуса: коагуляционный профиль (ПВ – ПО – МНО, фибриноген, АЧТВ, ПТИ), агрегация тромбоцитов | 1 раз | 1 раз при поступлении, дополнительно в случае наличия патологических изменений либо изменения состояния |
| 11 | контроль МНО | – | по необходимости |
| 12. | ЭКГ | 3 раза | с интервалом 5 дней, дополнительно при изменении состояния, либо в случае необходимости контроля выявленных изменений с интервалом 1 день; |
| 13. | ЭХОКГ | 2 раза | с интервалом 7-10 дней, дополнительно при изменении состояния, либо в случае необходимости контроля выявленных изменений с интервалом 5 дней; |
| 14. | рентгенография органов грудной клетки | 1 раз | при поступлении, дополнительно в случае наличия патологических изменений либо изменения состояния, в случае проведения ИВЛ по необходимости. |
| Дополнительные исследования | |||
| 1. | ИФА на ВУИ (вирус простого герпеса, цитомегаловирус, токсоплазмоз, хламидии, микоплазмы) с определением Ig G, Ig M | 1 раз | после рождения в случае наличия подозрения на возможное инфицирование, повторно через 10 дней в парных сыворотках при положительном результате 1-го скрининга |
| 2. | ПЦР на ВУИ (вирус простого герпеса, цитомегаловирус, токсоплазмоз, хламидии, микоплазмы) с определением Ig G, Ig M | 1 раз | при положительных результатах ИФА скрининга для определения активности процесса |
| 3. | Мазок из зева и носа, посев биологических жидкостей на чувств. к антибиотикам | 1 раз | при поступлении, дополнительно в случае наличия патологических изменений либо изменения состояния, либо в случае необходимости мониторинга проводимой антибактериальной терапии |
| 4. | кал на патологическую флору | 1 раз | в случае планируемого перевода в другие стационары |
| 5. | кровь на стерильность | по показаниям | |
| 6. | УЗИ плевральной полости | 1 раз | при поступлении, дополнительно в случае наличия патологических изменений либо изменения состояния. |
| 7. | УЗИ органов брюшной полости и почек | 1 раз | при поступлении, дополнительно в случае наличия патологических изменений либо изменения состояния. |
| 8. | НСГ | 1-2 раза | при поступлении, дополнительно при изменении состояния, контроля выявленных изменений |
| 21. | осмотр глазного дна | 2 раза | при поступлении и через 10 дней, дополнительно при изменении состояния |
Диагностические мероприятия, проводимые на этапе скорой неотложной помощи ( в случае родов на дому, ранней выписки):
· Физикальный осмотр;
· Определение наличия цианоза;
· Подсчет ЧД в минуту;
· Подсчет ЧСС в минуту;
· Пульсоксиметрия;
· ЭКГ.
Показания для консультации специалистов:
· Консультация детского кардиолога: наличие симптомов, либо синдромов (артериальной гипоксемии, легочной гипертензии, сердечной недостаточности), позволяющих заподозрить ВПС у новорожденного;
· Консультация кардиохирурга: наличие ВПС, подтвержденного по данным ЭХОКГ и других лабораторно-интсрументальных методов исследования, требующего проведения оперативной коррекции в экстренном/срочном порядке, либо в ближайшие месяцы жизни;
· Консультация аритмолога:наличие нарушений ритма сердца (пароксизмальная предсердная тахикардия, фибрилляция и трепетание предсердий, синдром слабости синусового узла), диагностированные клинически, по данным ЭКГ и ХМЭКГ.
· Консультация невропатолога: наличие эпизодов судорог, наличие парезов, гемипарезов и других неврологических нарушений;
· Консультация инфекциониста: наличие признаков инфекционного заболевания (выраженные катаральные явления, диарея, рвота, сыпь, изменение биохимических показателей крови, положительные результаты ИФА исследований на внутриутробные инфекции, маркеры гепатитов);
· Консультация оториноларинголога: носовые кровотечения, признаки инфекции верхних дыхательных путей, тонзиллиты, синуситы;
· Консультация гематолога: наличие анемии, тромброцитоза, тромбоцитопении, нарушение свертываемости, другие отклонения гемостаза;
· Консультация нефролога: наличие данных за ИМВП, признаки почечной недостаточности, снижение диуреза, протеинурия.
· Консультация пульмонолога: наличие сопутствующей патологии легких, снижение функции легких;
· Консультация офтальмолога: воспалительные заболевания органов зрения, нарушения зрения, плановый осмотр глазного дна.
· Консультация генетика: при наличии фенотипических признаков генетической/хромосомной патологии.
Лабораторная диагностика
Дифференциальный диагноз
Чаще всего у новорожденных в критическом состоянии приходится проводить дифференциальную диагностику между патологией сердечно-сосудистой и дыхательной систем, и в том и в другом случае главными симптомами являются наличие цианоза, одышка. При наличие у новорожденного выраженного цианоза для дифференцировки его генеза (легочный или сердечный) проводится проба с вдыханием 100% кислорода (nitrogen washout test, гипероксидный тест).
Методика выполнения пробы:
На правой руке (предуктально) производится забор артериальной (лучевая артерия) или капиллярной крови на газовый состав и КЩС. Назначается инсуффляция кислорода (100%) через маску в течение 10-15 минут, затем вновь производится контрольный забор артериальной или капиллярной крови на газовый состав и КЩС.
Признается, что гипероксидный тест не приводит к закрытию ОАП и его проведение не противопоказано при подозрении на наличие дуктусзависимой патологии. Однако отсутствие эффективности кислородотерапии указывает на вероятность дуктусзависимого кровообращения. Поэтому после проведения гипероксидного теста у новорожденного с подозрением на дуктусзависимое кровообращение необходимо тотчас прекратить подачу кислорода. Такие дети нуждаются в незамедлительной внутривенной инфузии простагландина Е1 [3,7].
Дифференциальные признаки патологии сердечно-сосудистой и дыхательной систем представлены в таблице № 2 [3,7].
Таблица № 2: Критерии дифференциальной диагностики патологии дыхательной и сердечно-сосудистой систем у новорожденных.
| Симптом | патология дыхательной системы | патология ССС |
| цианоз | умеренной степени выраженности | · возможен дифференцированный цианоз; · тотальный выраженный цианоз. |
| кислородная проба при наличии цианоза | артериальное значение Pa02 после инсуффляции О2 обычно становится выше 150 мм рт.ст. | Pa02 не повышается выше 100 мм рт.ст. (и не повышается более чем на 10-30 мм рт.ст. от исходных значений) |
| улучшение состояния, уменьшение цианоза, повышение сатурации О2 до 90-100% | · ухудшение состояния, нарастание цианоза – легочная дуктус-зависимая гемодинамика; · снижение системного давления – дуктусзависимая системная гемодинамика. | |
| одышка | ЧСС в пределах возрастной нормы, Либо учащение незначительно | тахикардия |
Для облегчения дифференциальной диагностики ВПС предлагается алгоритм, представленный на рисунке № 2, приложение №4.
Кроме того, у этой группы пациентов необходимо проведение дифференциальной диагностики между ВПС и персистирующей легочной гипертензией новорожденных. В таблице № 3 указаны факторы, свидетельствующие о вероятном наличие у новорожденного персистирующей легочной гипертензии (ПЛГН) [1,2,7].
Таблица № 3: Признаки вероятной персистирующей гипертензии новорожденных.
| Беременность | • Пренатально диагностированная гипоплазия легких • Наличие признаков амнионита |
| Роды | • Перинатальная асфиксия • Аспирация меконием • Септицемия • Респираторный дистресс-синдром |
| Обзорная рентгенография органов грудной клетки | • Признаки РДС • Пневмоторакс • Пневмония |
| Течение | Фазы временного повышения сатурации >95%, paO2 >100 мм рт.ст. на фоне подачи кислорода |
| Лабораторные параметры | Признаки ВУИ: • Лейкоцитоз • Лейкопения • Тромбоцитопения • ↑ С-реактивный белок |
Лечение
· обеспечение стабильной гемодинамики;
· обеспечение адекватного системного кровотока;
· обеспечение адекватного легочного кровотока;
· обеспечение адекватной оксигенации;
· достижение значений сатурации 75-85% при цианотических ВПС;
· появление пульсации на бедренных артериях при пороках с обструкцией системного кровотока.
Тактика лечения:
Немедикаментозное лечение:
Базовые принципы лечения: температурный, лечебно-охранительный режимы, принципы вскармливания) соответствуют общим принципам, принятым в отделениях реанимации новорожденных.
Следует обеспечить:
· Комфортный температурный режим, при необходимости – седация для снижения метаболических потребностей организма.
· Регулярное удаление слизи из дыхательных путей.
· При необходимости – пункция периферической или центральной вены.
Следует избегать:
· Использования пупочного катетера более 4 дней (риск тромбоза).
Мониторинг:
Следует обеспечить:
· Мониторинг ЧСС, ЧДД, АД, оксигенации крови, температуры;
· Ежедневное взвешивание пациента.
· Мониторинг баланса жидкости.
· Мониторинг лабораторных параметров: общего анализа крови и мочи, глюкозы в крови, электролитов, мочевины и креатинина, КЩС. Кратность забора анализов зависит от стабильности состояния пациента.
Коррекция объема циркулирующей крови (ОЦК):
Следует обеспечить:
· Ограничение поступающей в организм жидкости и/или стимуляцию диуреза. При наличии сердечной недостаточности общий объем жидкости (включая кормление) не должен превышать 70% от суточной возрастной нормы.
· При внутривенном введении простагландина Е1 необходимо аккуратное восполнение дефицита ОЦК, возникающего вследствие вазодилатации.
Следует избегать:
· Объемной перегрузки.
Питание:
Следует обеспечить:
· Щадящий режим кормления (сцеженным грудным молоком или смесями) – частыми малыми дозами через зонд;
· Расчет килокалорий в сутки: 140-200 ккал/кг/сутки.
· Следует избегать:
· Парентерального вместо энтерального питания.
· У пациентов с дуктус-зависимой легочной циркуляцией при наличии большого ОАП (сатурация > 85% на фоне введения простагландина Е1) следует крайне осторожно наращивать объем кормления из-за риска развития НЭК вследствие обкрадывания системной перфузии.
Респираторная поддержка и ИВЛ:
У пациентов с подозрением на дуктус-зависимую гемодинамику
Следует обеспечить:
· Насыщение крови кислородом на уровне 75-85% на фоне адекватной механики дыхания и отсутствия метаболического ацидоза.
Следует избегать:
· Инсуффляции кислорода у пациента с дуктус-зависимой гемодинамикой;
· Искусственной вентиляции легких и значений pCO2 85%.
Медикаментозная терапия:
Медикаментозное лечение, оказываемое на амбулаторном уровне: не проводится. Избегать подачи кислорода до установления диагноза.
Медикаментозное лечение, оказываемое на стационарном уровне: (родильный дом, перинатальный центр).
Принципы адекватной терапии критических ВПС на основании имеющейся у пациента гемодинамики [1,2,7] отражены в таблице №3:
Таблица № 3: Адекватная медикаментозная терапия в зависимости от типа гемодинамики критического ВПС.
| Гемодинамика | Адекватная терапия |
| Дуктус-зависимая легочная циркуляция | • Кислородотерапия не показана • Титрование простагландина Е1 • Коррекция КЩС • При необходимости ИВЛ – ее проведение воздухом |
| Дуктус-зависимая системная циркуляция | • Кислородотерапия не показана • Соблюдение точного гидробаланса с ограничением поступления жидкости. • Титрование простагландина Е1 • Коррекция КЩС • При необходимости ИВЛ – ее проведение воздухом • Необходимость поддержания нормокапнии (pCO2 35‐45 мм рт.ст., особенно при проведении ИВЛ). Оптимальные параметры газов крови и КЩС: рН 7,4; pCO2 40 мм рт.ст.; PO2 40 мм рт.ст. • Кардиотоники • Диуретики • Исключение применения вазодилятаторов |
| Форамен-зависимая циркуляция | • Кислородотерапия • Кардиотоники • Диуретики • Вазодилататоры • Ограничение инфузионной терапии |
| Легочная гиперволемия | • Кардиотоники • Диуретики • Ограничение инфузионной терапии • При ОАП большого диаметра – индометацин в/в или ибупрофен внутрь |
Медикаментозное лечение, оказываемое на уровне родильного дома/перинатального центра:
Основным препаратом терапии критических ВПС до поступления в кардиохирургический центр является простагландин Е1.
| 4. | Антибактериальные препараты | ||
| Цефазолин | 100 мг/кг в сутки В 2-4 приема в/в | 10 дней | 20% |
| Цефуроксим | 100 мг/кг в сутки в 2-4 приема в/в | 10 дней | 50% |
| Цефтазидим | 100 мг/кг/сутки | 10 дней | 20% |
| Амикацин | 10-15 мг/кг/сутки В 2 введения в/в | 7-10 дней | 10% |
| 5. | Диуретики | ||
| Фуросемид | 0,5 – 1 мг/кг разовая доза 3-4 раза в сутки | 14 дней | 80% |
| спиронолактон | 2-4 мг/кг в сутки в 2 приема перорально в 8.00, в 12.00 | 14 дней | 100% |
| 6. | Ингибиторы АПФ | ||
| каптоприл | 0,1-0,5 мг/кг в сутки в 3 приема | 14 дней | 30% |
| эналаприл | 0,1-0,5 мг/кг/сутки | 14 дней | 50% |
| 7. | блокаторы – β-адренорецепторов | ||
| карведилол | 0,1-0,8 мг/кг в сутки в 2 приема | 14 дней | 30% |
| анаприлин | 1 мг/кг/сутки в 3 приема | 14 дней | 20% |
| метопролол | 5 мг/кг/сутки в 2 приема | 14 дней | 10% |
| 8. | Растворы для в/венных инфузий | ||
| натрия хлорид 0,9% | 10 мл/кг | 14 дней | 100% |
| глюкоза раствор для инфузий 10% | 10 мл/кг | 14 дней | 100% |
| Комплекс аминокислот для парентерального питания | 14 дней; | 10% | |
| Гидрокарбонат натрия | Расчет на основании показателей КЩС | По потребности | 30% |
Таблица № 6: Дозы дигоксина в зависимости от возраста.
| возраст | ежедневная поддерживающая доза мкг/кг/сутки | |
| PO | IV | |
| недоношенные новорожденные | 5 | 3-4 |
| доношенные новорожденные | 8-10 | 6-8 |
Медикаментозное лечение, оказываемое на этапе скорой неотложной помощи: не проводится. Избегать подачи кислорода до установления диагноза.
Другие виды лечения:
Другие виды лечения, оказываемые на амбулаторном уровне: не проводится.
Другие виды лечения, оказываемые на стационарном уровне: не проводится.
Другие виды лечения, оказываемые на стационарном уровне: не проводится.
Хирургическое вмешательство:
Хирургическое лечение, оказываемое в амбулаторных условиях: не проводится.
Хирургическое лечение, оказываемое в стационарных условиях:
Хирургическая коррекция критических ВПС осуществляется в условиях высокоспециализированных кардиохирургических центрах республиканского уровня. Вид коррекции определяется анатомией порока и тяжестью состояния пациента.
В случае выявления у новорожденного критического ВПС, осуществляется перевод его в специализированный кардиохирургический стационар для проведения оперативной коррекции. Порядок перевода пациента представлен ниже.
Особенности транспортировки пациентов с критическими ВПС:
Транспортировка пациента на фоне внутривенной инфузии простагландина Е1:
· Новорожденные с тяжелой гипоксемией, ацидозом и сердечно-сосудистой недостаточностью нуждаются в ИВЛ во время транспортировки.
· Простагландин Е1 является препаратом выбора для обеспечения стабильной транспортировки новорожденных с дуктусзависимыми ВПС, поэтому следует обеспечить его непрерывное внутривенное введение с помощью перфузора. Необходимо иметь запасные источники питания для перфузора (заряженные аккумуляторы, батарейки).
· Во время транспортировки у пациента должно быть 2 венозных доступа.
· Сопровождающий врач должен владеть техникой интубации трахеи у новорожденных и иметь при себе необходимые инструменты (интубационные трубки, ларингоскоп, мешок Амбу, лейкопластырь и т.д.).
Показания к ИВЛ во время транспортировки:
· Тяжелая гипоксемия, ацидоз, тяжелая сердечно-сосудистая и дыхательная недостаточность;
· Продолжающиеся эпизоды апноэ во время введения простагландина Е1;
· Плановый перевод на ИВЛ для транспортировки, если доза простагландина Е1 превышает 0,025 мкг/кг/мин.
Индикаторы эффективности лечения:
· Пациент не требует подачи кислорода;
· Пациент не нуждается в инотропной поддержке;
· Отсутствуют жизнеугрожающие нарушения ритма;
· Уровень артериального давления соответствует возрастной норме;
· Нормальные параметры КЩС;
· Сатурация кислорода в периферической крови не ниже 75%;
Препараты (действующие вещества), применяющиеся при лечении
| Алпростадил (Alprostadil) |
| Амикацин (Amikacin) |
| Декстроза (Dextrose) |
| Дигоксин (Digoxin) |
| Добутамин (Dobutamine) |
| Допамин (Dopamine) |
| Каптоприл (Captopril) |
| Карведилол (Carvedilol) |
| Комплекс аминокислот для парентерального питания (Complex of amino acids for parenteral nutrition) |
| Левосимендан (Levosimendan) |
| Метопролол (Metoprolol) |
| Натрия гидрокарбонат (Sodium hydrocarbonate) |
| Натрия хлорид (Sodium chloride) |
| Пропранолол (Propranolol) |
| Силденафил (Sildenafil) |
| Спиронолактон (Spironolactone) |
| Фуросемид (Furosemide) |
| Цефазолин (Cefazolin) |
| Цефтазидим (Ceftazidime) |
| Цефтриаксон (Ceftriaxone) |
| Цефуроксим (Cefuroxime) |
| Эналаприл (Enalapril) |
Госпитализация
Показания для госпитализации с указанием типа госпитализации**
Показания для госпитализации в стационар амбулаторного пациента (роды на дому, ранняя выписка из родильного дома):
· Наличие цианоза у новорожденного;
· Наличие признаков сердечно-сосудистой недостаточности (отказ от груди, тахикардия, одышка);
· Рекомендуется следовать принципам ИВБДВ.
Показания для плановой/экстренной госпитализации в кардиохирургический стационар в случае нахождения ребенка в учреждении родовспоможения:
· наличие у ребенка ВПС с гемодинамикой, зависящей от функционирования фетальных коммуникаций (ООО, ОАП, аранциев проток);
· нарастающая сердечно-сосудистая недостаточность.
Профилактика
Профилактические мероприятия:
Профилактика ВПС осуществляется на этапе планирования беременности, а так в первом триместре беременности согласно протоколу ведения беременных женщин.
Дальнейшей ведение:
Дальнейшей ведение будет определяться анатомией порока и видом выполненной оперативной коррекции.
Информация
Источники и литература
Информация
1) Горбунов Дмитрий Валерьевич – кандидат медицинских наук АО «Национальный научный кардиохирургический центр» заведующий детским кардиохирургическим отделением.
2) Иванова-Разумова Татьяна Владимировна – кандидат медицинских наук АО «Национальный научный кардиохирургический центр» заведующий отделением детской реабилитации.
3) Жубанышева Карлыгаш Биржановна – кандидат медицинских наук АО «Национальный научный центр материнства и детства» главный внештатный неонатолог МЗСР РК.
4) Ибраев Талгат Ергалиевич – АО «Национальный научный кардиохирургический центр» заведующий отделением детской анестезиологии, реанимации и интенсивной терапии.
5) Тулеутаева Райхан Есенжановна – кандидат медицинских наук РГП на ПХВ «Государственный медицинский университет города Семей», заведующая курсом клинической фармакологии, врач – клинический фармаколог.
Конфликт интересов: отсутствует.
Рецензенты: Куатбеков Кайрат Ниеталиевич – кандидат медицинских наук, ГКП на ПХВ «Центр перинатологии и детской кардиохирургии» Управления здравоохранения города Алматы, заведующий отделением детской кардиохирургии, врач – кардиохирург высшей квалификационной кардиохирургии, главный специалист по детской кардиохирургии Управление здравоохранения города Алматы.
Условия пересмотра протокола: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1.
| Время манифестации | варианты ВПС |
| шок в родильном доме | · Синдром гипоплазии левого сердца с интактной МПП; · Транспозиция магистральных сосудов с интактной МЖП и интактной МПП/рестриктивным ООО; |
| первые 3 дня жизни | · Критический стеноз аорты; · Тяжелая форма аномалии Эбштейна; · Синдром гипоплазии левого сердца; · Транспозиция магистральных сосудов с интактной МЖП; · Атрезия легочной артерии с интактной МЖП; · Перерыв дуги аорты; · Обструктивные форма тотального аномального дренажа; Легочных вен (ТАДЛВ); · Тетрада Фалло с отсутствующим клапаном легочной артерии |
| 4-14 дней | · Тетрада Фалло; · Атрезия трикуспидального клапана; · Транспозиция магистральных сосудов с ДМЖП; · Дефект межжелудочковой перегородки; · Стенозлегочной артерии; · Коарктация аорты; · Большой открытый артериальный проток; · Дефект аортолегочной перегородки; · Общий артериальный ствол; · Единственный желудочек со стенозом легочной артерии; |
| 3-18 неделя | · Полная форма атриовентрикулярного септального дефекта; · Тетрада Фалло с невыраженным СЛА; · Большой дефект межжелудочковой перегородки; · Тотальный аномальный дренаж легочных вен; · Аномальноеотхождениелевойкоронарнойартерии; · Транспозициямагистральныхсосудов с ДМЖП и без СЛА; · Единственный желудочек без стеноза легочной артерии; |
| 4-12 месяцев | · Небольшой дефект межжелудочковой перегородки; · Небольшой открытый артериальный проток; · Дефект межпредсердной перегородки · Некритическая коарктация аорты; · Некритический стеноз легочной артерии; · Некритический стеноз аорты; |
Рисунок 1. Алгоритм проведения скрининговой пульсоксиметрии новорожденным
Методика проведения пульсоксиметрии у новорожденных.
Сатурацию кислорода в периферической крови необходимо определять портативным пульсоксиметром либо при помощи монитора на обеих верхних и обеих нижних конечностях при первичном измерении, при повторном на правой руке и правой ноге, если не выявлены дополнительные особенности.
Таблица № 2: Методика проведения пульсоксиметрии новорожденных (23).



