Дексаметазон уколы при онкологии головного мозга
Гормональная терапия в лечении онкологии
Гормональная терапия является эффективным методом лечения онкологии, однако обладает рядом серьезных побочных эффектов. Онколог медицинского центра «Анадолу», профессор Сердар Турхал рассказал, что это за новый метод и на что пациентам стоит обращать внимание перед началом гормонотерапии.
Что такое гормонотерапия?
Гормоны — это биологически активные вещества, вырабатываемые организмом, которые контролируют рост клеток. Некоторые органы нашего тела нуждаются в половых гормонах, таких как эстроген и тестостерон, для нормального функционирования и развития. Кроме того, существуют гормоны щитовидной железы, а также гормон инсулина, которые выполняют различные функции. Развитие некоторых видов онкологии также может быть обусловлено действием гормонов. Поэтому в их лечении применяются препараты, которые нарушают, блокируют и прекращают их работу. Такой вид лечения называется «гормональной терапией».
При каких видах рака может применяться гормонотерапия?
Гормональная или антигормональная терапия применяется при раке предстательной железы, раке молочной железы, гинекологических онкологических заболеваний. Но она является неэффективной в лечении таких видов онкологии, как рак легких, рак толстой кишки и желудка, потому что они не зависят от гормонов.
Имеются ли побочные эффекты при гормонотерапии?
Гормонотерапия имеет побочные эффекты, и некоторые из них могут быть достаточно серьезными. При раке простаты она может привести к снижению сексуального влечения, возникновению эректильной дисфункции, появлению остеопороза, усталости, набору веса и потере внимания. При раке молочной железы гормональная терапия может вызвать сухость во влагалище, воспаление, привести к снижению сексуального желания, вызвать усталость, тошноту, боль в мышцах и суставах, ломкость костей, остеопороз, реже — свертывание крови, что может стать причиной паралича. Количество побочных эффектов может разным. В связи с этим перед тем, как начинать гормонотерапию, очень важно знать, какие могут возникнуть побочные эффекты, и соотнести их с эффективностью лечения.
Подавляется ли иммунитет при гормонотерапии?
Несмотря на то, что гормонотерапия имеет много побочных эффектов, на иммунную систему она не влияет. Поэтому нет необходимости принимать дополнительные препараты для укрепления иммунитета. Тем не менее перед началом лечения следует тщательно изучить побочные эффекты, а также проконсультироваться со своим лечащим врачом о том, как с ними бороться. Если они усиливаются или продолжаются длительное время, несмотря на все предпринимаемые меры, необходимо снова обратиться к врачу. Лечение побочных эффектов не ограничивается приемом лекарственных средств. Например, при ослаблении костной ткани (остеопорозе) определенные упражнения могут тоже быть полезны. Также может быть рекомендован прием кальция и витаминно-минеральных добавок.
Дексаметазон уколы при онкологии головного мозга
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Дексаметазон уколы при онкологии головного мозга
Тошнота и рвота, обусловленная химиотерапией, относится к числу наиболее тяжело переносимых осложнений для больного. К высокоэметогенным режимам относятся комбинации на основе цисплатина и доксорубицина (АС или FAC), которые широко используются при проведении адъювантной терапии у больных раком молочной железы. Для профилактики острой тошноты и рвоты (в первые 24 часа после введения препаратов) рекомендуется использовать комбинацию антагонистов рецепторов серотонина (например, ондансетрон) и нейрокинина-1 (апрепитант) совместно с дексаметазоном. Эта тройная комбинация успешно справляется с острой тошнотой и рвотой у большинства больных. Проблемой остается отсроченная тошнота и рвота, возникающая на вторые сутки и далее после введения препаратов.
Исторически для купирования отсроченной тошноты и рвоты использовали дексаметазон. В 2006 году Международная организация по сопроводительной терапии при злокачественных опухолях (MASCC) рекомендовала назначение дексаметазона или апрепитанта для купирования отсроченной тошноты и рвоты. Включение апрепитанта было обосновано его способностью уменьшать частоту развития отсроченной тошноты и рвоты по сравнению с ондансетроном при профилактике острой рвоты у больных, получавших цисплатин-содержащие режимы. С учетом того, что ондансетрон оказывает минимальное влияние на профилактику отсроченной тошноты и рвоты, реальная эффективность апрепитанта не была установлена.
Это послужило основанием для проведения исследования для оценки способности апрепитанта в сравнении с дексаметазоном предотвращать развитие отсроченной тошноты и рвоты у больных раком молочной железы, которые получали комбинацию доксорубицина и циклофосфамида (60/600 мг/м 2 ). Все больные получали одинаковую профилактику острой тошноты и рвоты, которая подразумевала назначение апрепитанта в дозе 125 мг внутрь за час до введения химиотерапии, палоносетрона 0,25 мг в/в струйно и дексаметазон 8 мг в/в капельно за 30 минут до введения. В дальнейшем пациенты были рандомизированы в две группы, одна из которых получала дексаметазон 4 мг внутрь 3 раза в день 2-3 дни, а другая апрепитант 80 мг внутрь на 2 и 3 дни. Лечение было двойным слепым. Основным критерием эффективности была частота отсутствия тошноты и рвоты на 2-5 дни после проведения терапии.
В исследование была включена 551 больная, из которых 273 получали дексаметазон, а 278 – апрепитант. Частота полного контроля острой тошноты и рвоты составила 87,6% и 84,9% в группе дексаметазона и апрепитанта соответственно. Частота отсутствия тошноты и рвоты в период 2-5 дней лечения составила 79,5% для обеих групп. Одновременно отмечена тенденция возникновения более выраженной тошноты и рвоты большей продолжительностью с большим числом эпизодов рвоты в группе апрепитанта по сравнению с дексаметазоном. В группе дексаметазона достоверно чаще отмечали развитие бессонницы и сердцебиений, а в группе апрепитанта – потерю аппетита и сонливость. Качество жизни в обеих группах существенно не отличалось.
Результаты исследования убедительно демонстрируют равную эффективность дексаметазона и апрепитанта для профилактики отсроченной тошноты и рвоты у больных, получивших комбинацию доксорубицина и циклофосфамида. Важным итогом данного исследования является изменение рекомендаций MASCC по профилактике отсроченной тошноты и рвоты. Вместо прежней рекомендации использовать дексаметазон либо апрепитант следует использовать дексаметазон. Несмотря на равную частоту полного контроля тошноты и рвоты в обеих группах, в группе дексаметазона отмечено меньшее число эпизодов рвоты с меньшей продолжительностью. Другим преимуществом дексаметазона является цена, которая примерно в 10 раз ниже, чем у апрепитанта. Остается неизвестным, способна ли комбинация дексаметазона и апрепитанта улучшить частоту контроля отсроченной тошноты и рвоты по сравнению с только дексаметазоном.
Ключевые слова: тошнота и рвота, дексаметазон, апрепитант, рак молочной железы.
Дексаметазон уколы при онкологии головного мозга
Форма выпуска Ампулы для инъекций
ATC категория Глюкокортикоидные средства (ГКС)
ATC подкатегория ГКС для инъекций
Торговое название Дексаметазон
Международное название препарата Dexamethasone
Наименование препарата Дексаметазон, 4 мг/ мл, раствор для инъекций (далее именуемый “Дексаметазон” в листке-вкладыше).
Дексаметазон принадлежит к группе препаратов, именуемого кортикостероидами. Кортикостероиды – гормоны, которые вырабатываются в организме, которые помогают сохранить здоровье и хорошее самочувствие. Применение дополнительного количества кортикостероидов, таких как Дексаметазон — эффективный способ лечения различных заболеваний, включая воспаление. Дексаметазон устраняет воспаление, в противном случае, могло бы ухудшить состояние Вашего организма.
Вы должны принимать это лекарство регулярно, чтобы получить максимальный эффект от его приема.
Дексаметазон принимают в виде инъекций пациенты, которые не могут принимать лекарство в таблетированной форме. При внутривенном или внутримышечном введении дексаметазон уменьшает воспаление и подавляет иммунную систему и обычно используется пациентами при следующих состояниях:
Первичная или вторичная недостаточность коры надпочечников (при этом препаратами первого ряда являются гидрокортизон или кортизон; в случае необходимости синтетические аналоги можно применять в сочетании с минералкортикоидами; одновременное применение минералкортикоидов особенно важно для лечения детей)
Раствор дексаметазона для инъекций можно использовать также при лечении неэндокринных заболеваний:
Аллергия и анафилаксия
Ангионевротический отек и анафилаксия
Болезнь Крона и язвенный колит
Инфекция (совместно с соответствующей химиотерапии)
Милиарный туберкулез и эндотоксический шок
Повышенное внутричерепное давление вследствие опухолей головного мозга и младенческих спазмов. Кроме того, Дексаметазон используется в качестве вспомогательной терапии для контроля отека головного мозга, вызванного опухолью головного мозга или после нейрохирургического вмешательства, но не в случае получения травмы головы.
Бронхиальная астма и аспирационный пневмонит.
Токсический эпидермальный некролиз
Следует отметить, что терапия Дексаметазоном является дополнением, а не замещением основной общепринятой терапии. Было доказано, что применение Дексаметазона при раннем лечении шоковых состояний имеет более высокий терапевтический эффект, однако, это не влияет на общую выживаемость пациента
Раствор Дексаметазона для инъекций подходит для внутрисуставных инъекций или инъекций в мягкие ткани в качестве вспомогательной терапии для кратковременного применения при:
Поражении мягких тканей
Синдром запястного (карпального) канала и теносиновит
Ревматоидный артрит и остеоартрит с воспалительным элементом.
При определенных кожных заболеваниях, таких как кистозные акне, простой лишай и келоидные рубцы, раствор Дексаметазона для инъекций можно вводить непосредственно в очаг поражения.
Не следует принимать Дексаметазон
Перед применением Дексаметазона проконсультируйтесь с врачом или фармацевтом:
Это также включает депрессию, которая наблюдалась до приема кортикостероидных лекарств, таких как Дексаметазон.
Если из вышеперечисленного что-либо относится к Вам, поговорите со своим врачом, прежде чем принимать Дексаметазон.
Психические расстройства, наблюдаемые при использовании Дексаметазона
Психические расстройства наблюдаются при использовании кортикостероидов, таких как Дексаметазон (см. раздел 4: Возможные побочные эффекты).
Обратитесь к врачу, если Вы (или тот, кто принимает лекарство) испытываете психические расстройства. Это особенно важно, если Вы находитесь в депрессии или у Вас появятся суицидальные мысли.
В редких случаях психические расстройства наблюдаются даже при снижении дозы или прекращении приема препарата.
Проконсультируйтесь с Вашим врачом, прежде чем использовать Дексаметазон, если:
Если у Вас есть сомнения, если что-либо из вышеуказанного относится к Вам, поговорите с Вашим врачом или фармацевтом перед использованием Дексаметазона.
Если у Вас развивается инфекция, когда Вы принимаете данный лекарственный препарат, следует обратиться к врачу. Пожалуйста, сообщите врачу, стоматологу или специалисту, который проводит Ваше лечение, что Вы в данный момент принимаете кортикостероиды или принимали их в недавнем прошлом.
Не используйте Дексаметазон для лечения острого респираторного дистресс-синдрома (ОРДС, серьезное заболевание легких), если у Вас было диагностировано это состояние более 2 недель назад.
Дексаметазон и вирусные инфекции
При приеме данного препарата следует избегать контакта с людьми болеющими ветряной оспой, опоясывающим лишаем или корью, особенно если Вы никогда не болели данными заболеваниями, потому что потребуется специализированное лечение, если Вы заболеете или если Вы считаете, что у Вас есть риск развиться какого-либо из этих заболеваний, Вам следует немедленно обратиться к врачу. Вы также должны сообщить своему врачу, если Вы когда-либо болели корью или ветряной оспой, и если Вы прививались от этих инфекционных заболеваний в прошлом.
Пожалуйста, обратитесь к врачу или специалисту, который проводит Ваше лечение, в стационаре если:
Если что-либо из вышеуказанного относится к Вам, обратитесь к врачу или лечащему специалисту, даже если Вы прекратили прием препарата.
Дети
Если препарат используется в детском возрасте, важно, чтобы врач регулярно контролировал рост и развитие ребенка.
Дексаметазон не следует эмпирически назначать недоношенным детям при заболеваниях дыхательных путей.
Проинформируйте своего врача, если Вы принимаете, недавно принимали или должны принимать любые другие препараты. Другие лекарственные препараты и Дексаметазон могут взаимодействовать друг с другом, в особенности:
Дексаметазон натрия фосфат физически несовместим с даунорубицином, доксорубицином и ванкомицином, и его нельзя смешивать с растворами, содержащими эти препараты. Также несовместим с доксапрамом HCl и гликопирролатом в шприце.
Если Вы беременны или, думаете, что можете быть беременны или при планировании беременности, проконсультируйтесь со своим лечащим врачом перед тем, как принимать Дексаметазон.
Дексаметазон не влияет на способность управления автомобилем и пользования механизмами.
Важная информация об ингредиентах, входящих в состав Дексаметазона
Препарат содержит метилпарабен и пропилпарабен, которые могут вызывать аллергические реакции (отсроченного характера) и в редких случаях, бронхоспазм. Метабисульфит натрия в редких случаях может вызывать тяжелые реакции гиперчувствительности и бронхоспазм.
Это лекарство содержит менее 1 ммоль (23 мг) натрия в расчете на 1 дозу, т.е. практически не содержит натрия.
Дексаметазон следует принимать в точности так, как предписано врачом.
Препарат вводят внутримышечно, внутрисуставно или в сухожилие. Возможно также внутривенное введение. Доза зависит от тяжести заболевания и состояния больного. Правильную дозировку, а также когда и как будет введена инъекция определит Ваш врач,
Если Вы приняли больше Дексаметазона, чем Вам рекомендовано
Если Вы думаете, что приняли больше Дексаметазона, чем рекомендовано, немедленно сообщите Вашему лечащему врачу. В случае передозировки Вы можете почувствовать следующие симптомы:
Поскольку инъекцию должен сделать врач или медсестра, маловероятно, что Вам введут слишком высокую дозу или же, что вы пропустите очередную дозу. Если Вы считаете, что вам ввели слишком высокую дозы или вы пропустили очередную дозу, немедленно обратитесь к врачу.
Если Вы прекращаете прием Дексаметазона
Резкое прекращение приема Дексаметазона опасно. После продолжительной терапии, возможно, ваш организм привыкнет к приему этого лекарственного препарата и, возможно, снизит нормальную выработку гормона, который содержится в этом лекарственном препарате. Ваше лечение будет прекращено в зависимости от заболевания, от которого вы лечитесь, и от того, сколько инъекции Дексаметазона Вам будет сделано. Если Вы планируете завершить курс лечения, следуйте рекомендациям лечащего врача.
Если Вы резко прекращаете прием препарата, Ваше состояние может ухудшиться.
Возможно, Вам потребуется постепенно снижать дозу принимаемого лекарства, до полной отмены. Ваш врач должен убедиться, что после лечения рецидива не будет. Если Вы подвергаетесь сильному стрессу (например, другое заболевание, травма или хирургическое вмешательство), необходимо изменить дозировку.
При резком прекращенни лечения у Вас может развиться «синдром отмены». Симптомы: головная боль, проблемы со зрением (включая боль или отечность глаз), тошнота или рвота, лихорадка, боли в мышцах и суставах, отечность в носу, снижение веса, зуд кожи и конъюнктивит.
Слишком быстрое снижение дозы после длительного лечения может привести к недостаточности выработки гормонов надпочечниками и пониженному артериальному давлению (симптомы: усталость, головокружение, головная боль, сердцебиение). В крайнем случае это может привести к летальному исходу. В некоторых случаях возникали проблемы с психическим состоянием при снижении или прекращении дозы — см. Раздел 4 ниже.
Если у Вас возникнут какие-либо дополнительные вопросы по применению препарата, следует обратиться к лечащему врачу или фармацевту.
Как и другие лекарственные препараты, Дексаметазон может вызывать побочные эффекты, хотя они проявляются не у каждого.
Дексаметазон может вызвать побочные эффекты, когда Вы прекращаете использовать его (см. раздел 3 “ Если Вы прекратите прием Дексаметазона”).
Серьезные побочные эффекты: следует немедленно обратиться к врачу: Кортикостероиды, включая Дексаметазон, могут вызывать серьезные психические расстройства. Они могут встречаться как у взрослых, так и у детей.
Могут встречаться у 5 из 100, принимающих Дексаметазон. Расстройства следующие:
Если у Вас наблюдается данные расстройства, следует немедленно обратиться к врачу.
Если у Вас аллергия к Дексаметазону, немедленно обратитесь к врачу.
Аллергические реакции включают:
Если у Вас возникают любые из следующих побочных эффектов, немедленно обратитесь к врачу:
Отчетность о побочных эффектах:
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕКАРСТВЕННОМУ ЛЕЧЕНИЮ ПЕРВИЧНЫХ ОПУХОЛЕЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Коллектив авторов: Кобяков Г. Л., Бекяшев А.Х., Голанов А.В., Коновалов А.Н., Насхлеташвили Д.Р., Потапов А.А., Рзаев Д.А., Рыжова М.В., Смолин А.В., Трунин Ю.Ю., Улитин А.Ю.
DOI: 10.18 027/2224–5057–2018–8–3s2–83–99
Ключевые слова: опухоли центральной нервной системы, коделеция 1p/19q, IDH-1 мутация, метилирование MGMT, первичная лимфома ЦНС, эпендимома, герминома ЦНС, медуллобластома
Цитирование: Кобяков Г. Л., Бекяшев А. Х., Голанов А. В., Коновалов А. Н., Насхлеташвили Д. Р., Потапов А. А. и соавт. Практические рекомендации по лекарственному лечению первичных опухолей центральной нервной системы // Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 83–99
ISSN 2587-6813 (электронное издание)
Злокачественные опухоли. Том 8, #3, 2018, спецвыпуск 2
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
TNM классификация в отношении первичных опухолей центральной нервной системы не применяется. Основным классификационным критерием, определяющим тактику лечения, является морфологическая классификация; рекомендуется использование классификации ВОЗ опухолей ЦНС 2016 г. (см. раздел 2.2. «Морфологический диагноз»).
2. ДИАГНОСТИКА
2.1. Обследование
сбор анамнеза, оценка неврологического и соматического статуса, а также функционального статуса по шкале Карновского;
МРТ головного и/или спинного мозга:
МРТ головного мозга в трёх проекциях в стандартных режимах (Т1, Т2, FLAIR, Т1 + контраст);
в случаях, когда МРТ не может быть выполнена (например, при наличии кардиостимуляторов или ферромагнитных имплантов), выполняется КТ с контрастным усилением и без него;
анализы: клинический, биохимический крови, общий анализ мочи, анализ свёртывающей системы крови, ВИЧ, гепатиты;
при показаниях (опухоль пинеальной области) — анализ крови на опухолевые маркёры АФП, β-ХГЧ, ЛДГ;
УЗИ вен нижних конечностей;
консультация офтальмолога (оценка глазодвигательных, зрительных нарушений, а также признаков внутричерепной гипертензии на глазном дне);
в процессе лечения регулярно должен проводиться контроль эффективности: МРТ с контрастным усилением и без него в трёх проекциях (или в одной проекции с режимом SPGR с последующей реконструкцией) и в стандартных режимах (Т1, Т2, FLAIR, Т1 + контраст). Частота выполнения зависит от гистологического диагноза и этапа лечения (см. Алгоритмы лечения). Оценка динамики опухоли проводится согласно критериям RANO.
функциональная МРТ двигательных и речевых зон; и МР-трактография; МР-ангиография, МР-спектроскопия, МР-перфузия;
при подозрении на опухоль с риском диссеминации по оболочкам головного и спинного мозга (медуллобластома, пинеобластома, первичные герминативно-клеточные опухоли ЦНС и пр.) выполняется МРТ всего спинного мозга с контрастным усилением;
ПЭТ/КТ головного мозга с аминокислотами (метионином, тирозином);
КТ головного мозга выполняется также в дополнение к МРТ в случаях костных опухолей, при показаниях — КТ-перфузия, КТ-ангиография;
консультация нейрохирурга (в специализированном нейрохирургическом центре или отделении), при необходимости — в федеральном нейрохирургическом центре;
консилиум с участием нейрохирурга, рентгенолога, радиолога, онколога.
2.2. Морфологический диагноз
Во всех случаях следует стремиться к гистологической верификации опухоли; диагноз формулируется в соответствии с классификацией ВОЗ опухолей ЦНС 2016 г. В дополнение к основному диагнозу указывается степень злокачественности опухоли G (от I до IV ст.).
У пациентов с глиальными опухолями определяются также мутация генов IDH‑1,2, метилирование гена MGMT, коделеция 1p/19q. При отсутствии технической возможности определения данных мутаций, используется аббревиатура «NOS».
Морфологическая верификация может не проводиться, если получение диагностического материала сопряжено с высоким риском осложнений, например, при диффузных опухолях ствола головного мозга.
3. ЛЕЧЕНИЕ
Стандартными методами лечения первичных опухолей ЦНС являются хирургический, лучевой и лекарственный.
3.1. Хирургическое лечение
Хирургическое удаление производится для максимально возможного уменьшения объёма опухоли с целью разрешения внутричерепной гипертензии, уменьшения неврологического дефицита и получения достаточного количества морфологического материала. В послеоперационном периоде после удаления опухоли обязательно выполнение КТ с контрастированием и без него, а также выполнение МРТ с контрастным усилением и без него в течение 24–72 часов.
СТБ или навигационная биопсия должны быть использованы в случаях, когда хирургическое удаление невозможно или нецелесообразно, а также при подозрении на первичную лимфому ЦНС.
В исключительных случаях, например, у пациентов пожилого возраста, пациентов с грубой неврологической симптоматикой, при расположении опухоли в жизненно важных структурах (в том числе в стволе мозга) ХТ и/или ЛТ могут применяться на основании данных нейровизуализации и клинической картины по решению консилиума.
3.2. Лучевая терапия
Дистанционные методы ЛТ являются основным компонентом лечения большинства пациентов с опухолями ЦНС.
Лучевое лечение используется у первичных больных после хирургического удаления/биопсии опухоли, а также при возникновении рецидива/продолженного роста опухоли. ЛТ может проводиться как на область опухоли (на остаточную опухоль или на ложе опухоли), так и на пути возможного метастазирования (например — краниоспинальное облучение в лечении эпендимомы). Золотым стандартом лучевого лечения является применение стереотаксической техники облучения.
3.2.1. Режимы фракционирования
Режим стандартного фракционирования: 1 сеанс в день РОД 1,8–2,2 Гр до СОД 24–70 Гр; используется у пациентов с крупными и/или диффузно-растущими опухолям и различной гистологической природы (в основном — глиомы G I–IV), а также при облучении путей возможного метастазирования опухоли (краниоспинальное облучение).
Радиохирургическое лечение — одномоментное подведение высокой дозы (12 Гр и более) с использованием стереотаксической техники. Используется у пациентов с небольшими опухолями (до 3 см в максимальном измерении), имеющими чёткие границы (пилоидные астроцитомы, эпендимомы, менингиомы, невриномы, аденомы гипофиза, краниофарингиомы и пр.).
Режим гипофрационирования (РОД ≥ 2,5 Гр, СОД ≥ 15 Гр) используется у пациентов с опухолями, имеющими чёткие границы, либо с минимальной зоной возможной инфильтрации тканей (до 3–5 мм), а также у пациентов с образованиями более 3 см и/или с опухолями, располагающимися вблизи критических структур мозга.
При лечении злокачественных опухолей (G III–IV) ЛТ следует начинать в сроки от 2 до 6 нед. после операции, в ряде случаев в комбинации с ХТ (см. раздел «Химиотерапия»).
После ЛТ возможно возникновение постлучевых повреждений вещества головного мозга, в том числе лучевого некроза. Для дифференциации постлучевых осложнений и рецидива опухоли целесообразно использование дополнительного МРТ с контрастированием, ПЭТ головного мозга с метионином (тирозином), МР-спектроскопии, КТ-перфузии и др. В лечении лучевого некроза может использоваться бевацизумаб.
3.3. Лекарственная противоопухолевая терапия в комплексном лечении первичных опухолей ЦНС
Показания и выбор схемы противоопухолевой лекарственной терапии зависят от гистологического диагноза. Основные режимы ХТ первичных опухолей ЦНС приведены в табл. 1, 2, 3. В настоящем разделе представлены алгоритмы выбора тактики лечения в зависимости от нозологической группы.
3.3.1. Злокачественные глиомы
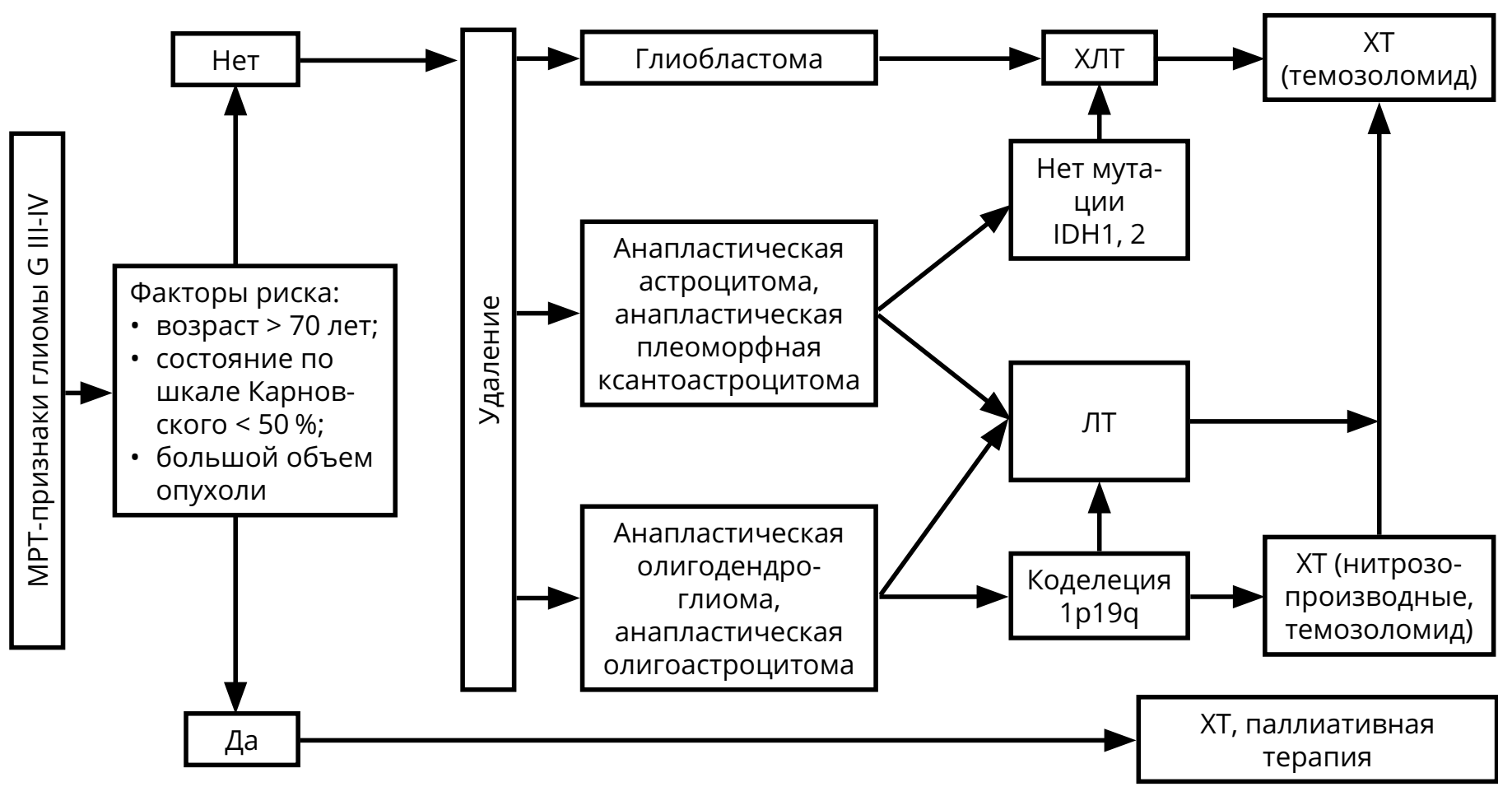
Подход к лечению зависит от степени злокачественности опухоли. Выделяют злокачественные (G III–IV) глиомы (анапластическая астроцитома, анапластическая олигодендроглиома, анапластическая олигоастроцитома, глиобластома, в том числе глиосаркома) и низкой степени злокачественности (G I–II), включающие в себя астроцитому, олигодендроглиому, олигоастроцитому, а также редкие типы опухолей — плеоморфную ксантоастроцитому, субэпендимарную гигантоклеточную астроцитому, пилоидную астроцитому.
МРТ признаками злокачественной глиомы являются гипоинтенсивная в Т1 режиме, гиперинтенсивная в режимах Т2 и FLAIR, сливающаяся с зоной перифокального отёка опухоль. Клинические признаки: короткий анамнез, быстрое нарастание симптомов, относительно редко наблюдается судорожный синдром. Если по данным МРТ нельзя исключить лимфому ЦНС, пациенту необходимо сначала выполнить СТБ.
После хирургического вмешательства с верификацией диагноза астроцитарной глиомы G III–IV показано продолжение лечения в виде ЛТ и ХТ (рис. 1). Молекулярно-генетические факторы, определяющие прогноз — IDH-1,2 мутации, метилирование гена MGMT, коделеция 1p/19q (все — благоприятные).
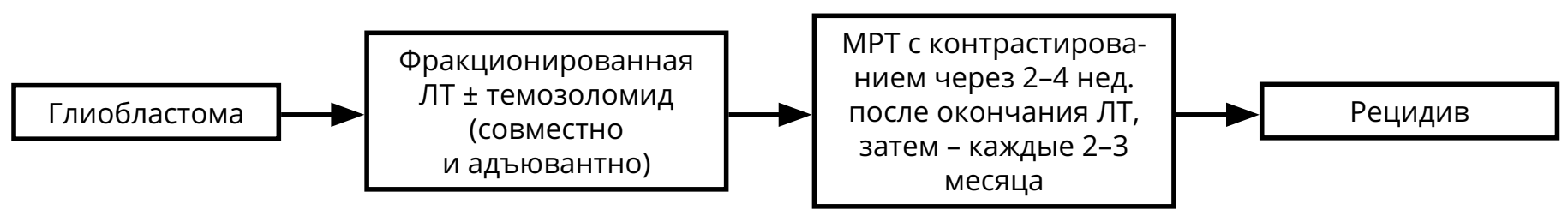
Для пациентов с глиобластомой режимом выбора послеоперационного лечения является ХЛТ с ежедневным приёмом темозоломида (75 мг/м 2 ) (в течение всего курса ЛТ — 30 фракций по 2 Гр на фракцию), с последующими 6–10 курсами темозоломида 5/23 (см. раздел 4).
Проведение ЛТ (30 фракций по 2 Гр на фракцию) показано для пациентов с анапластической астроцитомой, анапластической олигодендроглиомой, анапластической олигоастроцитомой.
При первом контроле после комбинированной ХЛТ глиомы (в течение 1 мес. после окончания ЛТ) можно наблюдать феномен псевдопрогрессии: увеличение контрастируемой части опухоли при отсутствии нарастания неврологических симптомов на фоне стабильных доз ГКС. В таком случае рекомендован МРТ-контроль через 1–3 мес. (то есть через 2–3 мес. после завершения ЛТ) с целью окончательной оценки динамики болезни.
ХТ (режим PCV или монотерапия ломустином или темозоломидом) должна быть назначена после ЛТ больным анапластической астроцитомой, анапластической олигодендроглиомой, анапластической олигоастроцитомой (см. раздел 4).
При коделеции 1p/19q у больных анапластической олигоастроцитомой и анапластической олигодендроглиомой в послеоперационном периоде могут быть назначены как ЛТ, так и ХТ (режим PCV или монотерапия темозоломидом 5/23). В случае полного ответа на химиотерапию ЛТ может быть отложена до рецидива заболевания.
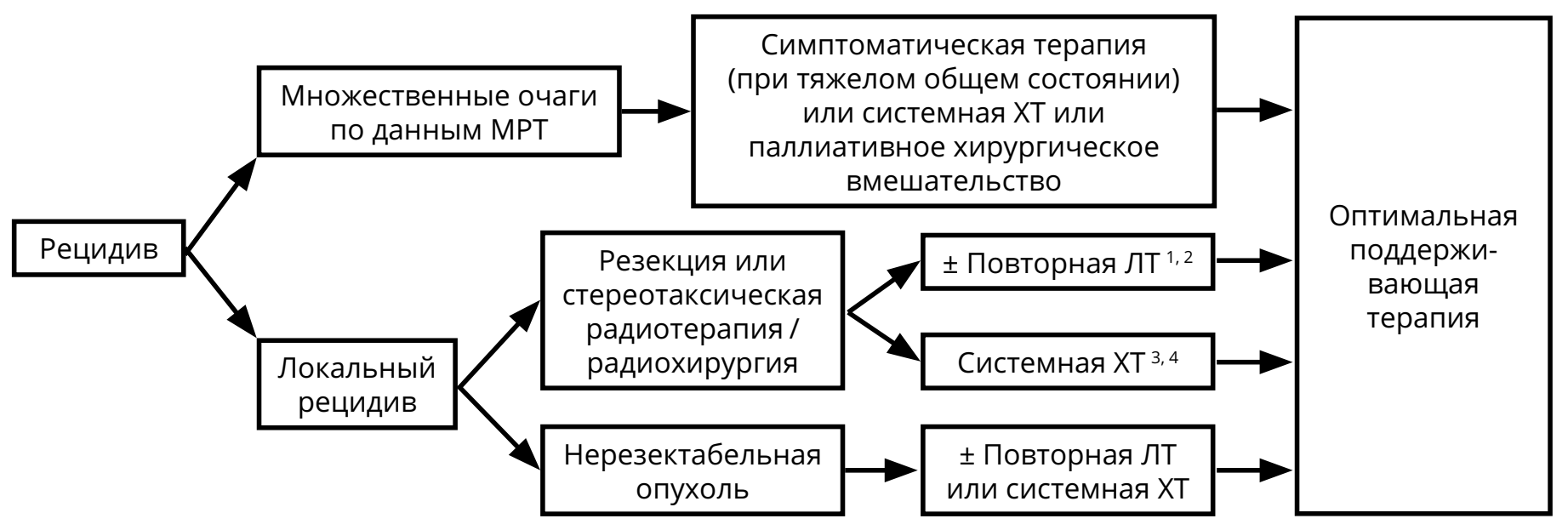
Методами лечения рецидивов глиом являются повторное хирургическое вмешательство, системная ХТ, повторная ЛТ и паллиативная терапия. Показания к назначению любого из этих методов лечения должны обсуждаться мультидисциплинарно. В некоторых случаях может быть предложена повторная ЛТ (если с момента предшествующей ЛТ прошло не менее 8 мес.). При небольших локальных рецидивах могут рассматриваться радиохирургические методики или гипофракционированная ЛТ.
2 Необходима МР-спектроскопия, МР-КТ перфузия, ПЭТ (с метионином) для исключения лучевого некроза, особенно, если интервал от первой ЛТ 18 мес.
3 При анапластической олигодендроглиоме и анапластической олигоастроцитоме предпочтительна ХТ.
4 Ответ после двух последовательных неэффективных режимов ХТ маловероятен.
В качестве ХТ рецидивов анапластических астроцитарных и олигодендроглиальных опухолей G III показано назначение темозоломида (если ранее не использовался или, если использовался, но был достаточно длительный — не менее 6 мес. — контроль болезни). Нитрозопроизводные могут также быть назначены, если они не использовались ранее. При олигодендроглиоме и анапластических олигоастроцитомах стратегия зависит от использованной ранее схемы лечения. В случае применения радиотерапии назначается ХТ PCV; если использовались радиотерапия и химиотерапия PCV, то предпочтение отдаётся ХТ темозоломидом. В случае первичной ХТ с использованием режима PCV, прежде всего, должна обсуждаться радиотерапия. Если радиотерапия не проводилась, то пациентам пожилого возраста, с обширным опухолевым поражением может быть предложена II линия ХТ (например, темозоломид после PCV).
3.3.2. Глиомы низкой степени злокачественности (G I–II)
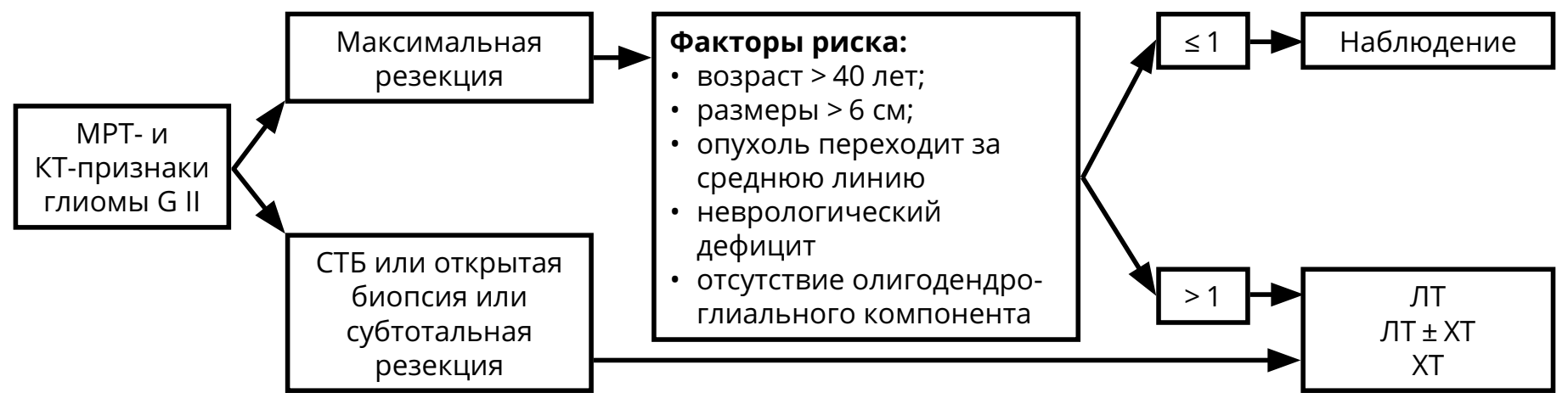
3.3.2.1. Астроцитома, олигодендроглиома, олигоастроцитома G II
Предоперационный диагноз глиомы G II основан на МРТ-признаках (гиподенсивная в Т1 режиме, гиперденсивная в режимах Т2 и FLAIR, не накапливает контраст) и клинических проявлениях (длительный анамнез, часто — судорожный синдром, медленное нарастание симптомов). Для олигоденроглиомы и олигоастроцитомы характерно наличие кальцинатов на КТ. Послеоперационное лечение (ЛТ, ХТ) зависит от радикальности удаления и/или факторов риска (рис. 4). Коделеция 1p/19q и IDH-1,2‑мутации — прогностически благоприятные факторы.
В случае полной резекции опухоли и при наличии не более одного фактора риска показано наблюдение: МРТ 1 раз в 3–6 мес. или при нарастании симптомов (см. раздел 6 «Наблюдение»). При неполном удалении/биопсии опухоли или при наличии более одного фактора риска показано назначение ЛТ и/или ХТ.
Пациентам пожилого возраста (старше 70 лет) с обширными опухолями ЛТ может не проводиться (назначается монотерапия темозоломидом 5/23). Вопрос о назначение ЛТ и ХТ ослабленным пациентам (с низким индексом Карновского и/или с признаками внутричерепной гипертензии), большой распространённостью опухоли, решается индивидуально.
После окончания курса ЛТ должны быть назначены контрольные МРТ (через 2–4 нед. после окончания ЛТ, а затем каждые 2–3 месяца в течение 2–3 лет).
3.3.2.2. Плеоморфная ксантоастроцитома G II
Плеоморфная ксантоастроцитома на МРТ — как правило, кистозная, хорошо отграниченная от окружающего мозгового вещества опухоль, сóлидная часть которой интенсивно накапливает контраст и расположена асимметрично относительно кисты. Показано удаление опухоли. Адъювантная терапия не требуется. Следует указать, что в классификацию 2016 г. внесено понятие «анапластическая плеоморфная ксантоастроцитома G III». Лечение этой опухоли осуществляется по принципам лечения злокачественных глиом. Дополнительно определяется BRAF мутация (в случаях выявления может быть назначена терапия вемурафенибом или дабрафенибом).
3.3.2.3. Субэпендимарная гигантоклеточная астроцитома
Чаще всего является одним из проявлений туберозного склероза (болезни Бурневилля). На МРТ представлена солидной опухолью, расположенной чаще всего в проекции одного или обоих отверстий Монро, гиподенсивной в Т1‑режиме и интенсивно накапливающей контраст. На КТ характерно наличие симметричных кальцинатов в проекции зрительных бугров. Стандартом лечения этих опухолей является оптимальное (тотальное) удаление. Больным с диффузным поражением показано лечение эверолимусом.
3.3.2.4. Пилоидная астроцитома G I
Обычно встречается в детском возрасте и у молодых взрослых. Оптимальным методом лечения является хирургическое удаление (при условии операбельности опухоли). Обязательным является выполнение МРТ в послеоперационном периоде для оценки радикальности операции. В случае радикального удаления опухоли больному показано наблюдение. В случае остаточной опухоли показана ЛТ.
3.3.2.5. Глиоматоз головного мозга
Глиоматоз мозга — это диффузное поражение глиомой структур головного мозга (более 3‑х анатомических областей больших полушарий, обычно с переходом через мозолистое тело и с перивентрикулярным распространением). Показана верификация диагноза путём СТБ, так как от гистологического диагноза может зависеть выбор лечебной тактики (например, при олигодендроглиальных опухолях, как обычно, показано определение коделеции 1p/19q, при её выявлении — назначение ХТ на основе нитрозопроизводных). Могут рассматриваться три подхода: наблюдение (если у больного нет клинических симптомов заболевания), ХТ (PCV/ломустин/темозоломид) и ЛТ головного мозга в зависимости от клинической ситуации, данных нейровизуализации, морфологии, ИГХ и молекулярно-генетических маркёров и мнения специалистов.
3.3.2.6. Глиомы ствола головного мозга
При узловых формах опухолей ствола мозга, экзофитном характере роста, т.е. при МР-признаках полной или частичной отграниченности от структур ствола (например, при пилоидной астроцитоме) показано удаление опухоли (или открытая биопсия). Далее, в зависимости от гистологического диагноза, возраста и радикальности удаления назначаются ЛТ и/или ХТ. При диффузном характере роста опухолей ствола (например, при диффузной глиоме моста — «диффузной понтинной глиоме») показано использование ЛТ и ХТ без обязательной верификации. При ювенильных глиомах четверохолмной пластинки после разрешения гидроцефалии осуществляется регулярное клиническое и МРТ-наблюдение (в случае прогрессирования опухоли рассматривается вопрос об удалении с последующей ЛТ).
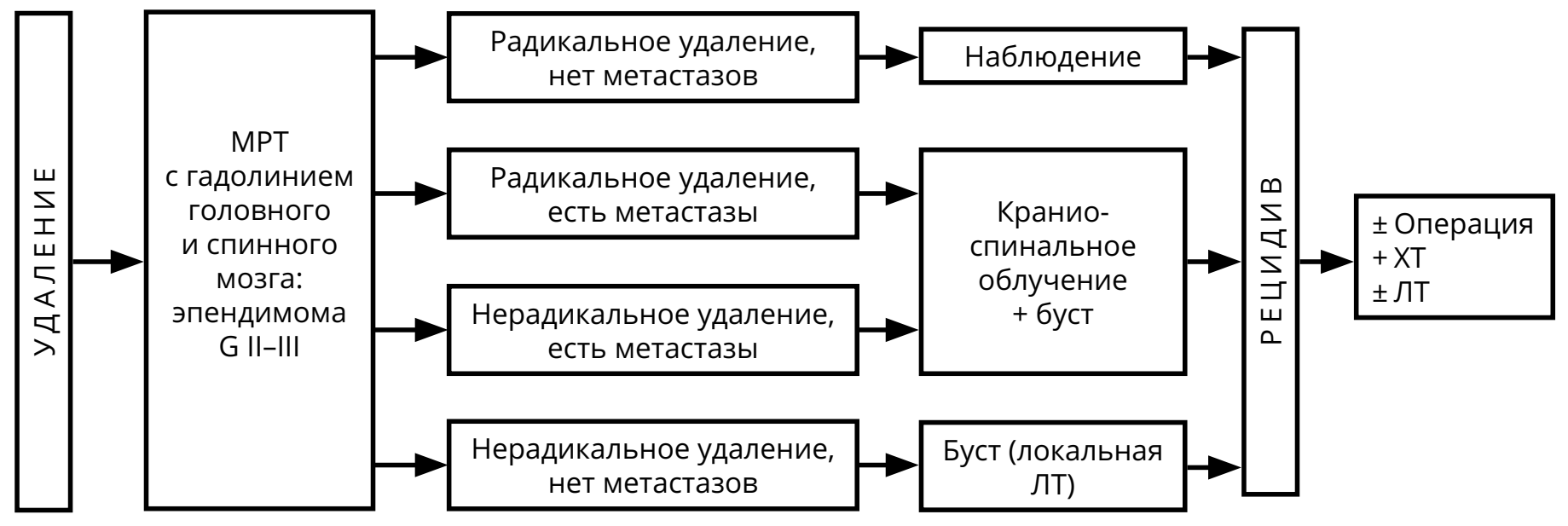
3.3.3. Эпендимомы
Редкие опухоли, возникающие из эпендимы головного мозга (чаще располагаются в пределах желудочковой системы, реже — экстравентрикулярно) или спинного мозга, примерно одинаково часто встречаются у детей и у взрослых. Приблизительно в половине случаев на КТ и МРТ выявляются признаки мелких кальцинатов. Хорошо накапливают контрастное вещество, чаще — негомогенно. По классификации ВОЗ 2016 г. выделяют эпендимому (G II) и анапластическую эпендимому (G III).
Ведущую роль в лечении эпендимомы играет хирургическое удаление опухоли. Поэтому при выполнении операции следует стремиться к максимальной резекции опухоли. При установлении гистологического диагноза эпендимомы или анапластической эпендимомы показано проведение МРТ головного и спинного мозга с контрастированием (с целью определения радикальности операции и выявления возможных спинальных метастазов) и исследование спинномозговой жидкости на опухолевые клетки.
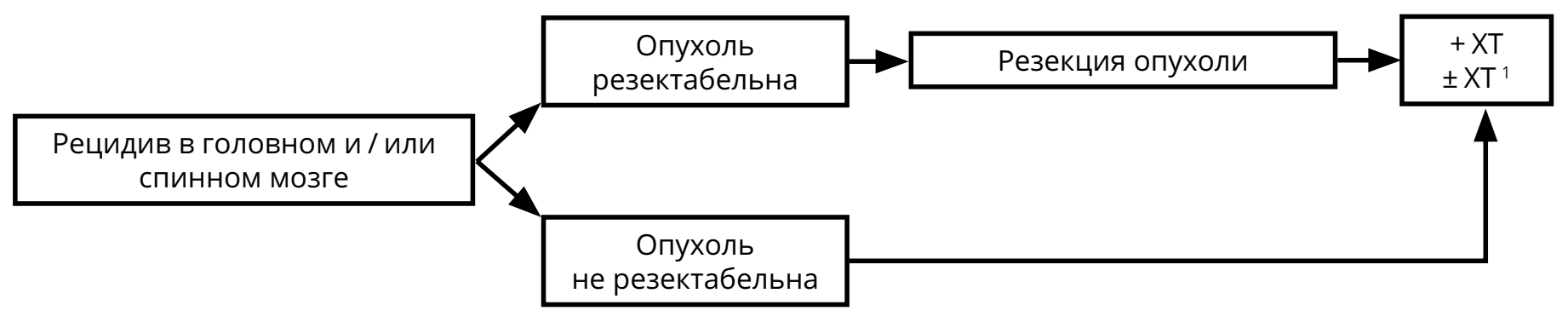
В случае выполнения максимальной резекции эпендимомы рекомендовано наблюдение (при отсутствии признаков метастазирования в виде наличия клеток опухоли в ликворе или спинальных метастазов на МРТ спинного мозга с контрастом). При невозможности радикальной операции или наличии резидуальной опухоли после хирургического вмешательства, адъювантным методом лечения является ЛТ, объём которой определяется радикальностью операции и выявленной распространённостью опухоли (рис. 5). ХТ может использоваться в случаях рецидива эпендимомы (рис. 6). Режимы ХТ при эпендимомах указаны в разделе 4.
1 Объём ЛТ зависит от объёма предшествующей ЛТ, распространённости опухоли и времени, прошедшего с момента предшествовашей ЛТ.
Контрольные обследования (МРТ с контрастированием и клиническое обследование) осуществляются не реже 1 раза в 3 мес. на протяжении первого года наблюдения, затем при отсутствии данных за прогрессирование — не реже 1 раза в 6 мес. В случае прогрессирования в виде солитарного очага рассматривается вопрос о повторной операции или, при небольших размерах рецидива, о радиохирургическом лечении.
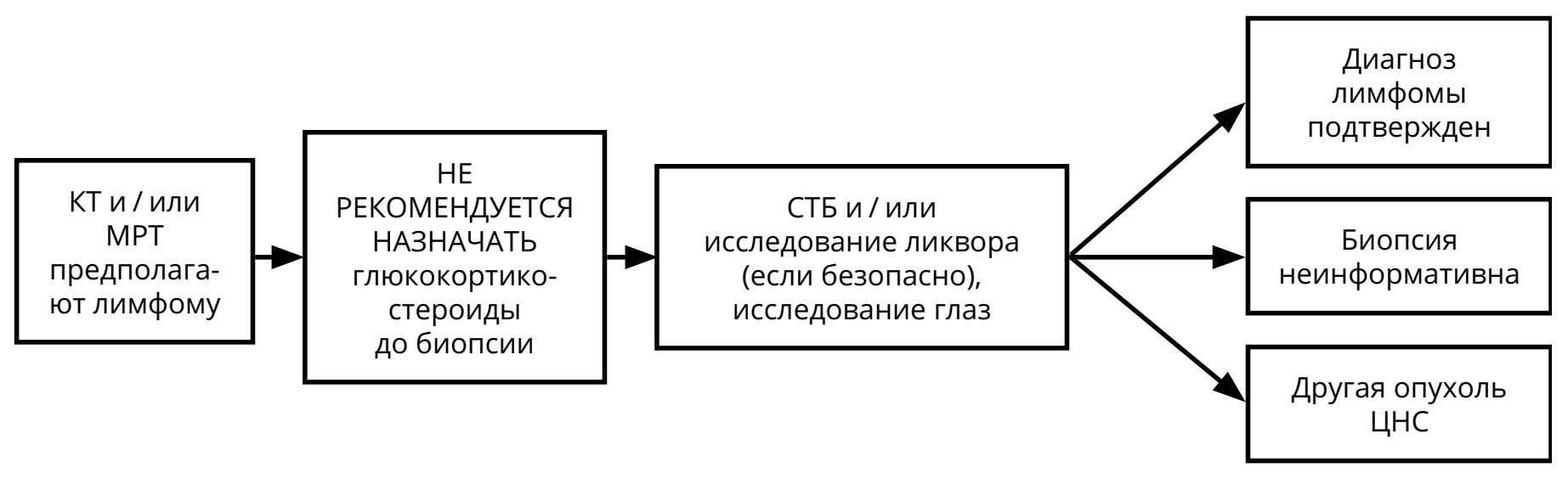
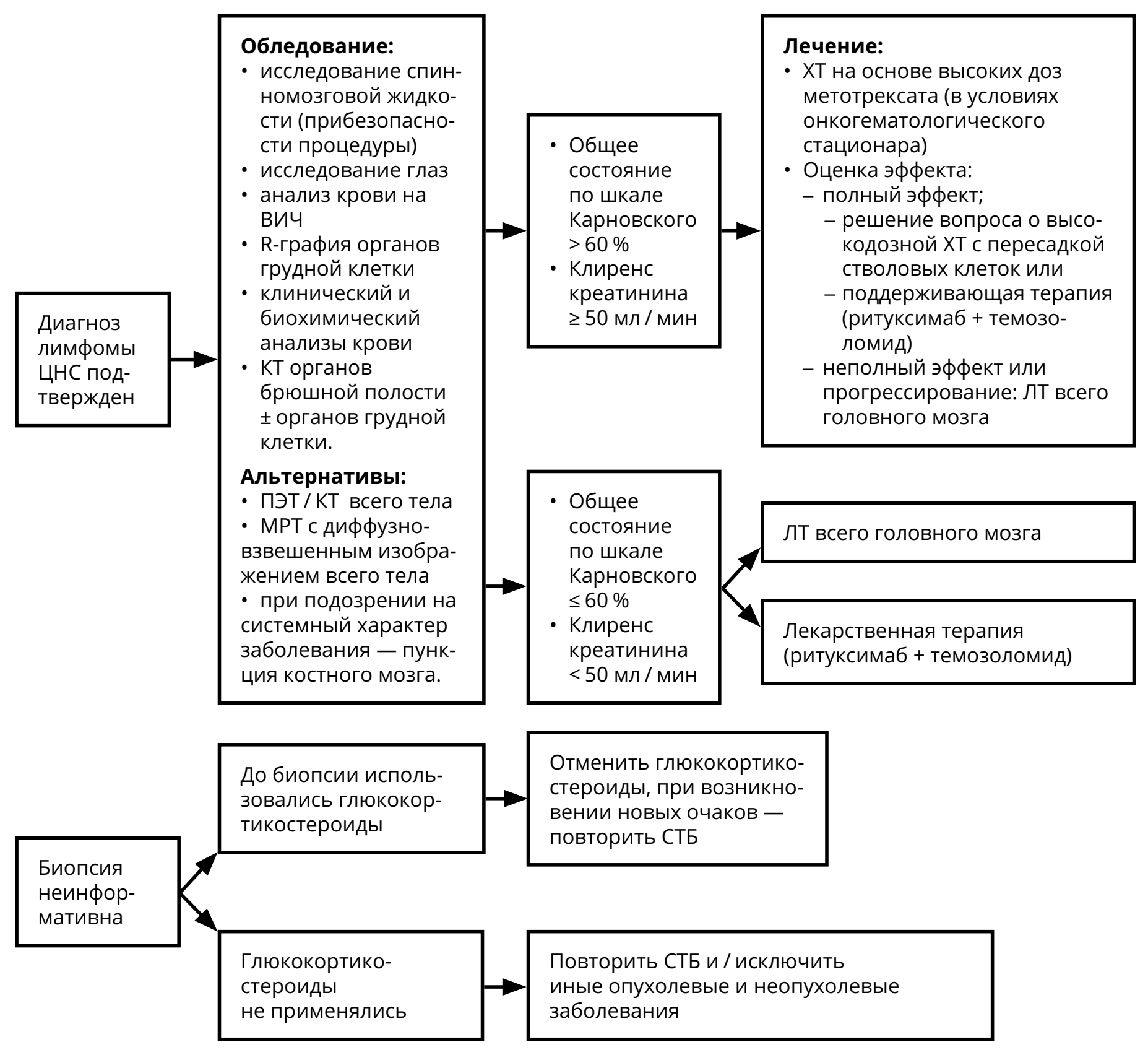
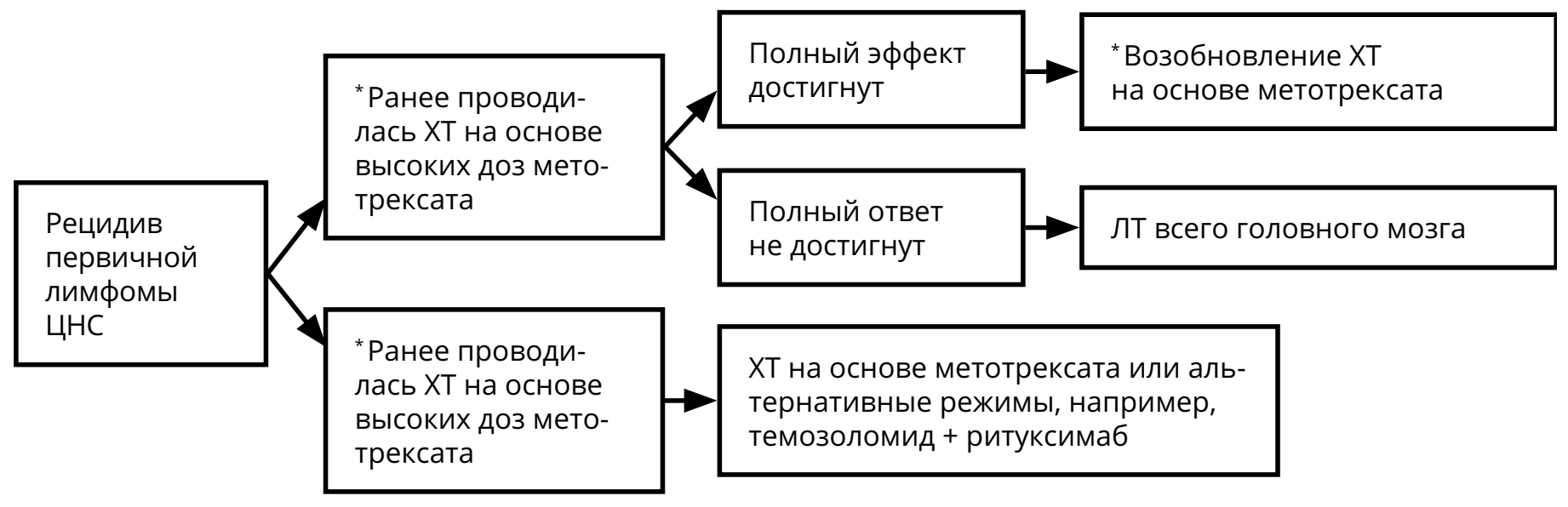
3.3.4. Первичная лимфома ЦНС
Относительно редкая опухоль ЦНС (5–7 % от всех первичных опухолей ЦНС), относящаяся, согласно онкогематологическим классификациям, к редким формам неходжкинских экстранодальных лимфом. Морфологически более, чем в 90 % случаев представлена диффузной B-клеточной лимфомой. Различают лимфомы ЦНС у иммунокомпетентных пациентов и ВИЧ-ассоциированные лимфомы. У 15–20 % больных с первичными лимфомами ЦНС выявляется поражение опухолью стекловидного тела глаза.
При рецидивах лимфомы ЦНС решение о методе лечения принимается исходя из нескольких параметров: времени с момента первичной верификации, продолжительности ремиссии, общего состояния больного, распространённости опухоли на момент рецидива (рис. 9).
3.3.5. Первичные герминогенные (герминативно-клеточные) опухоли ЦНС
Редкая группа первичных опухолей ЦНС (0,9 % от всех первичных опухолей ЦНС), встречается в основном в детском и молодом возрасте (медиана возраста на момент установления диагноза — примерно 17 лет), преобладает у лиц мужского пола (в соотношении м/ж 7:1). Гистологически все разновидности этих опухолей идентичны аналогичным семиномным и несеминомным опухолям яичка и яичника. Самой частой локализацией первичных герминативно-клеточных опухолей ЦНС является пинеальная область, что обусловливает две типичные группы симптомов: окклюзионно-гидроцефальный синдром и глазодвигательные нарушения. Поскольку негерминогенные герминативно-клеточные опухоли ЦНС характеризуются повышением в плазме крови опухолевых маркёров (АФП и/или β-ХГЧ), при подозрении на данные опухоли обязательно выполнение анализов крови на данные маркёры. Более того, при выявлении клинически значимого повышения одного или обоих маркёров (ХГЧ — более 5 × ВГН, АФП — более 2 × ВГН) лечение начинают без гистологической верификации опухоли с ХТ. По клиническому течению, формирующему подходы к лечению, разделяют герминому (устоялся также термин «чистая герминома» ЦНС) и негерминогенные герминативно-клеточные опухоли. При нормальных уровнях маркёров показана верификация диагноза. В соответствии с Морфологической классификацией ВОЗ опухолей ЦНС 2016 г. выделяют следующие морфологические типы первичных герминативно-клеточных опухолей ЦНС:
опухоль желточного мешка;
тератома со злокачественной трансформацией;
смешанные герминативно-клеточные опухоли.
Помимо маркёров, для полноценной диагностики данной группы опухолей необходимо выполнение МРТ с контрастированием всего головного и спинного мозга. Как и при первичной лимфоме ЦНС, при первичной герминоме ЦНС хирургическое удаление не улучшает прогноз, поэтому СТБ, эндоскопическая или открытая биопсия опухоли предпочтительнее удаления.
3.3.5.1. Первичная («чистая») герминома ЦНС
Современный подход к лечению заключается в ХТ в режиме EP (цисплатин +этопозид) (см. раздел 4) с последующим облучением желудочковой системы головного мозга СОД 24 Гр (при отсутствии данных за метастазирование по оболочкам спинного мозга). Поражение хиазмально-селярной области требует выполнения анализов крови на гормоны гипофиза на всех этапах лечения с участием эндокринолога (лучше — нейроэндокринолога). Краткий алгоритм лечения больных с первичной герминомой ЦНС:
МРТ головного и спинного мозга с контрастированием;
кровь на опухолевые маркёры (АФП, β-ХГЧ) — должны быть в пределах нормы;
обследование у невролога, офтальмолога, эндокринолога;
СТБ или прямая биопсия для верификации диагноза (при необходимости — решение вопроса о ликворошунтирующей операции);
ХТ по схеме EP (цисплатин + этопозид) — каждые 21 день;
после 2 курсов — контрольная МРТ головного и спинного мозга с контрастированием;
после 4 курсов — повторный контроль: МРТ головного и спинного мозга с контрастированием; при полном или «почти полном» эффекте — ЛТ в объёме облучения всей желудочковой системы (до уровня С2 шейного позвонка): РОД 1,8–2,0 Гр, СОД 24 Гр; в случае подозрения на остаточную опухоль (вероятнее всего — зрелую тератому) до ЛТ решается вопрос об удалении;
контрольная МРТ головного и спинного мозга каждые 3 мес. в течение первого года наблюдения, затем — каждые 6 мес. в течение 2‑го и 3‑го годов наблюдения, затем — 1 раз в год или при выявлении неврологических симптомов. Эффективность такого лечения достигает 90 % для 5‑летней и 10‑летней безрецидивной выживаемости, поэтому у фертильных пациентов мужского пола до начала лечения целесообразно решение вопроса о криоконсервации спермы.
3.3.5.2. Первичные негерминогенные герминативно-клеточные опухоли ЦНС
Ещё более редкая, чем первичная герминома ЦНС, группа опухолей, неоднородная по спектру морфологических форм (эмбриональная карцинома, опухоль желточного мешка, хориокарцинома, тератома (незрелая, тератома со злокачественной трансформацией)), с менее благоприятным по сравнению с «чистой» герминомой прогнозом.
Краткий алгоритм лечения больных с первичными негерминогенными герминативно-клеточными опухолями ЦНС:
МРТ головного и спинного мозга с контрастированием;
кровь на опухолевые маркёры (АФП, β-ХГЧ) — как правило, повышены;
обследование у невролога, офтальмолога, эндокринолога;
ХТ по схеме «цисплатин + ифосфамид + этопозид» каждые 21 день;
после 2 курсов — контрольная МРТ головного и спинного мозга с контрастированием, контроль опухолевых маркёров;
после 4 курсов — повторный контроль: МРТ головного и спинного мозга с контрастированием, контроль опухолевых маркёров; при полном или почти полном ответе– ЛТ в объёме краниоспинального облучения: РОД 1,8–2,0 Гр, СОД 36 Гр; в случае подозрения на остаточную опухоль (вероятнее всего — одну из разновидностей тератомы) — до ЛТ необходимо обсудить вопрос об удалении;
контрольная МРТ головного и спинного мозга каждые 3 мес. (+ контроль опухолевых маркёров) в течение первых 2 лет наблюдения, затем — каждые 6 мес. в течение 3‑го и 4‑го годов наблюдения, затем — 1 раз в год или при выявлении неврологических симптомов.
5‑летняя безрецидивная выживаемость при таком режиме лечения составляет 60–70 %.
До начала ХТ — решение вопроса о криоконсервации спермы.
3.4. Режимы лекарственной терапии первичных опухолей ЦНС
Рекомендуемые режимы лекарственной терапии различных вариантов первичных опухолей ЦНС представлены в табл. 1, 2, 3.
| PCV: ломустин 90 мг/м 2 внутрь в 1‑й день +винкристин 1,5 мг/м 2 в/в в 1‑й и 8‑й дни + прокарбазин 70 мг/м 2 внутрь в дни 8–21‑й дни, каждые 6 нед. |
|---|
| Метотрексат 3–8 г/м 2 в/в в 1‑й день (+ кальция фолинат 0,5 мг/кг в/в каждые 6 часов, начиная через 24 часа после введения метотрексата и под контролем снижения его концентрации в крови) + дексаметазон 8 мг/сут. в 1–3‑й дни, каждые 3 нед.; проводится только в стационарных условиях онкогематологического отделения или отделения химиотерапии |
|---|